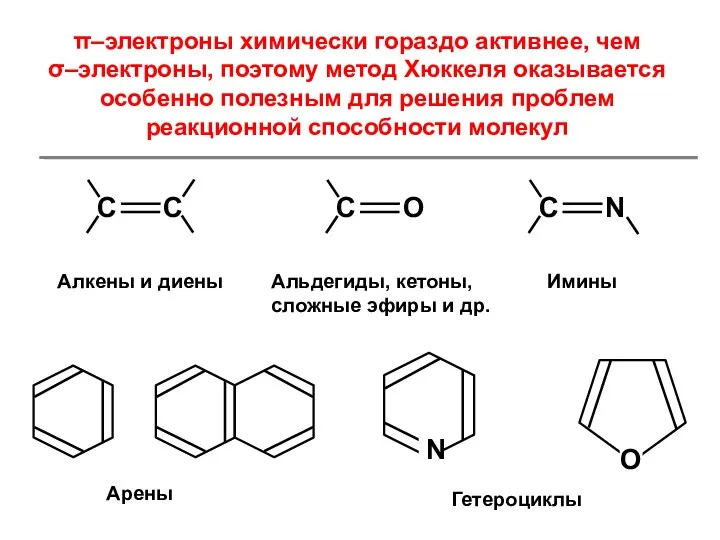
Содержание
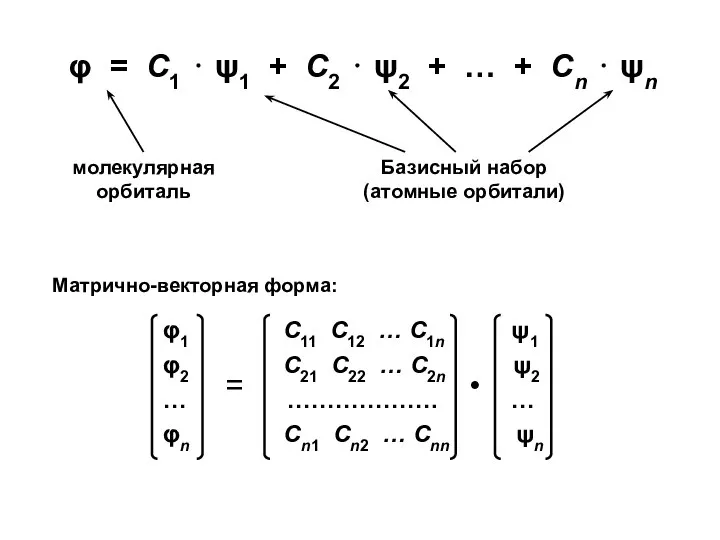
- 3. φ = С1 ⋅ ψ1 + С2 ⋅ ψ2 + … + Сn ⋅ ψn
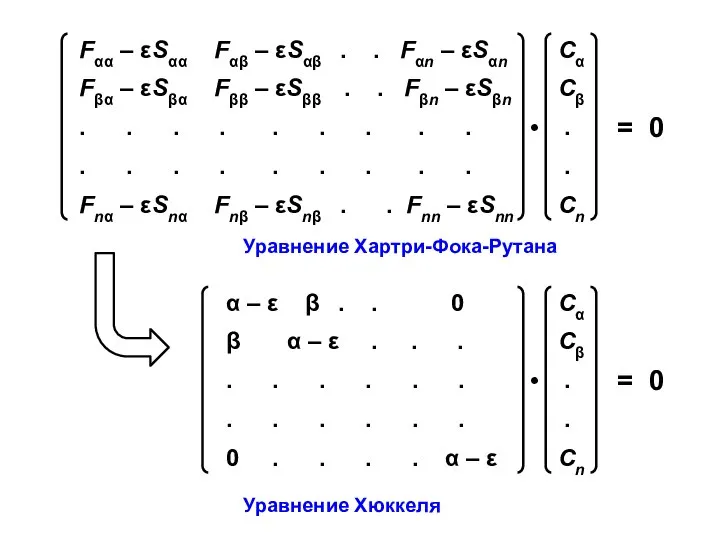
- 4. Уравнения Хартри-Фока-Рутана Fμν — матричные элементы оператора Фока, характеризующие либо энергию электрона в изолированном атоме с
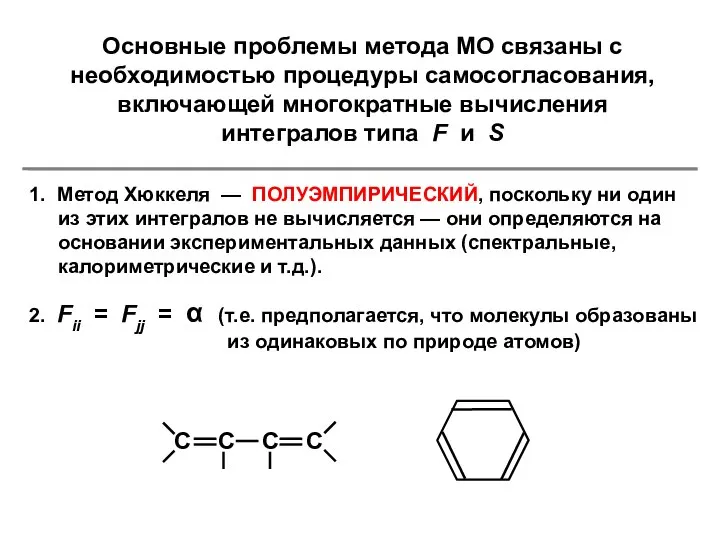
- 5. Основные проблемы метода МО связаны с необходимостью процедуры самосогласования, включающей многократные вычисления интегралов типа F и
- 6. Разделение недиагональных интегралов Fij на два типа (нулевые и ненулевые) осуществляется исключительно на химической основе —
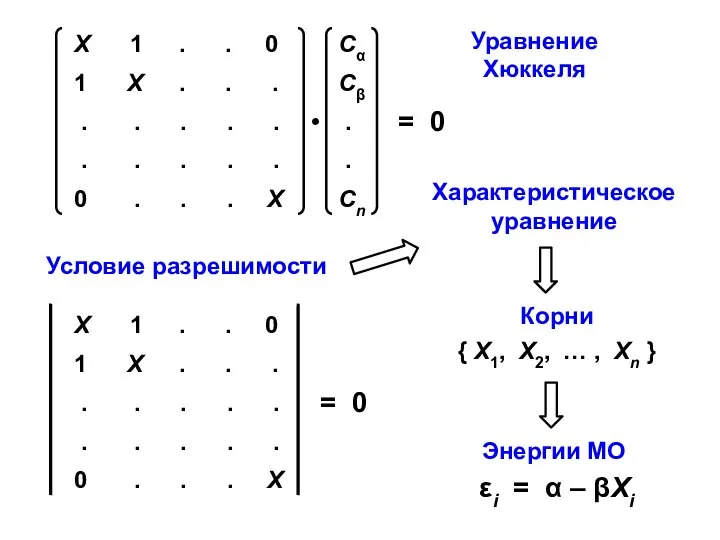
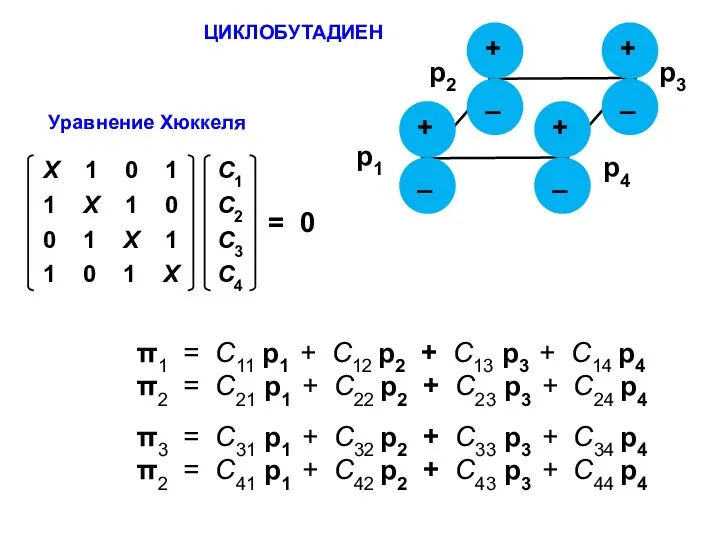
- 7. Уравнение Хартри-Фока-Рутана Уравнение Хюккеля
- 9. Уравнение Хюккеля
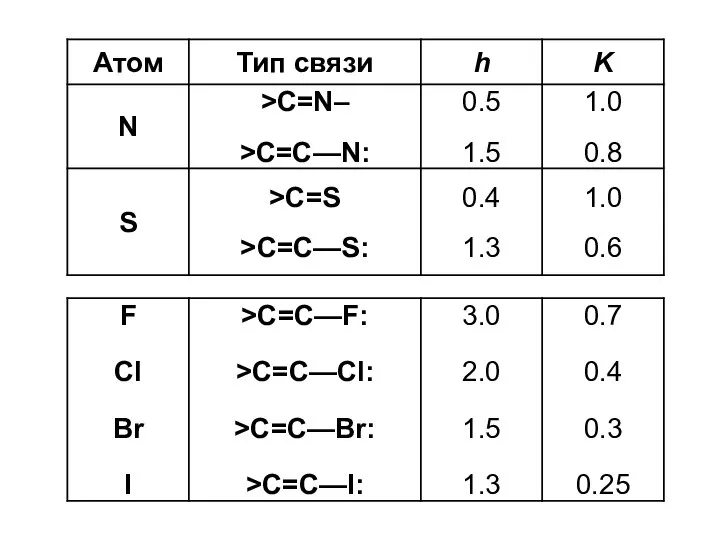
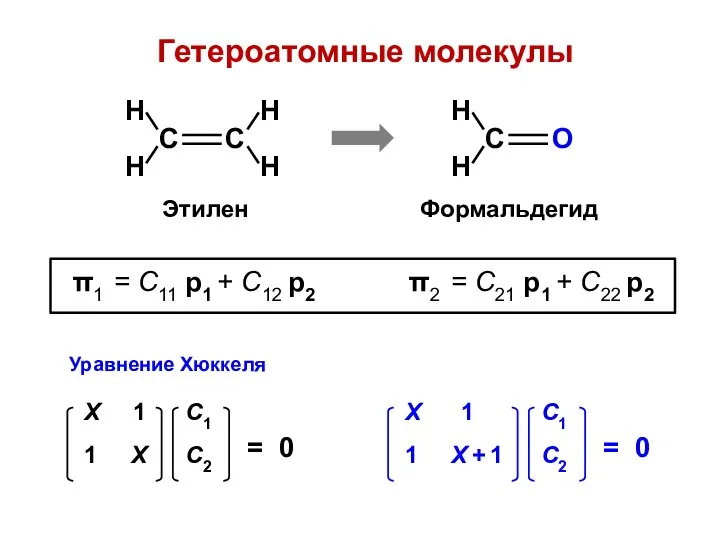
- 10. Гетероатомные молекулы в методе МОХ —С—С—С— αС ⎯→ αX βCC ⎯→ βCX αX = αС +
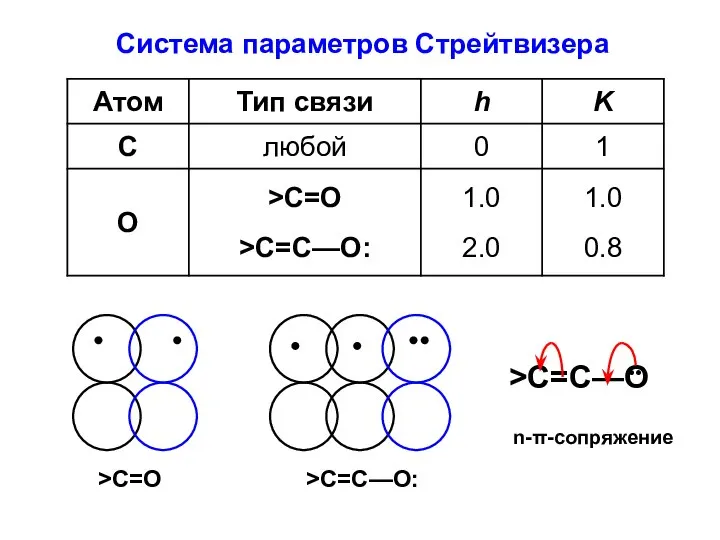
- 11. Система параметров Стрейтвизера
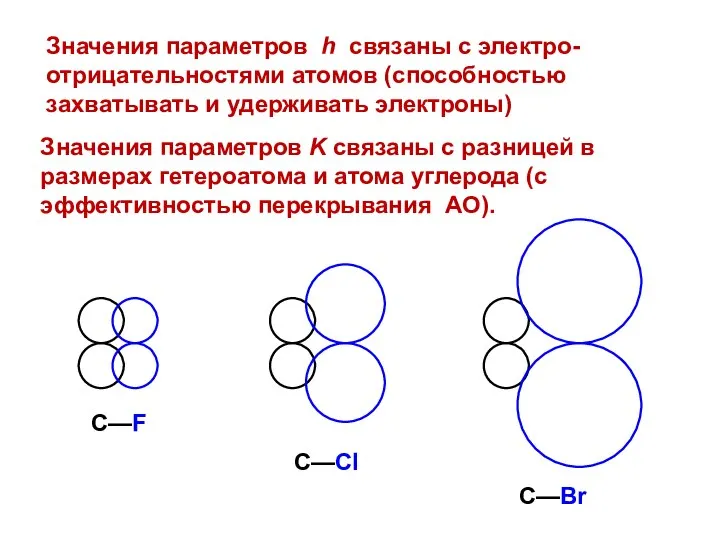
- 13. Значения параметров K связаны с разницей в размерах гетероатома и атома углерода (с эффективностью перекрывания АО).
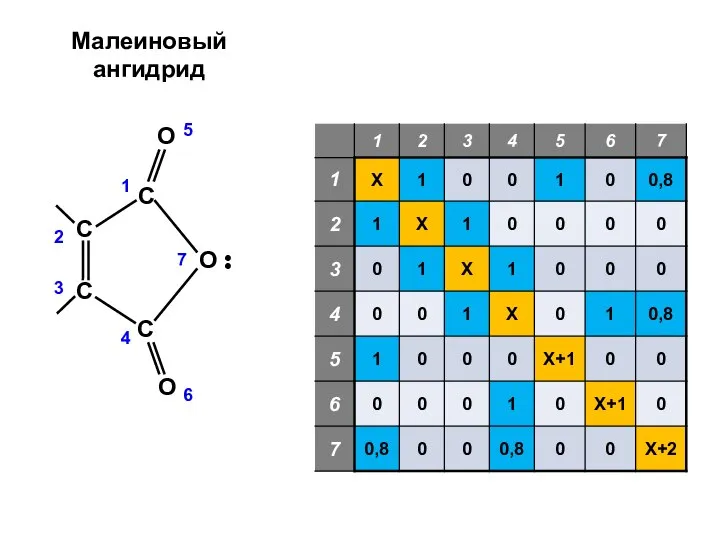
- 14. Малеиновый ангидрид
- 15. Домашнее задание
- 16. Алгоритм решения хюккелевской задачи 1. Построение матрицы Хюккеля по топологии молекулы (с учетом гетероатомов) 2. Построение
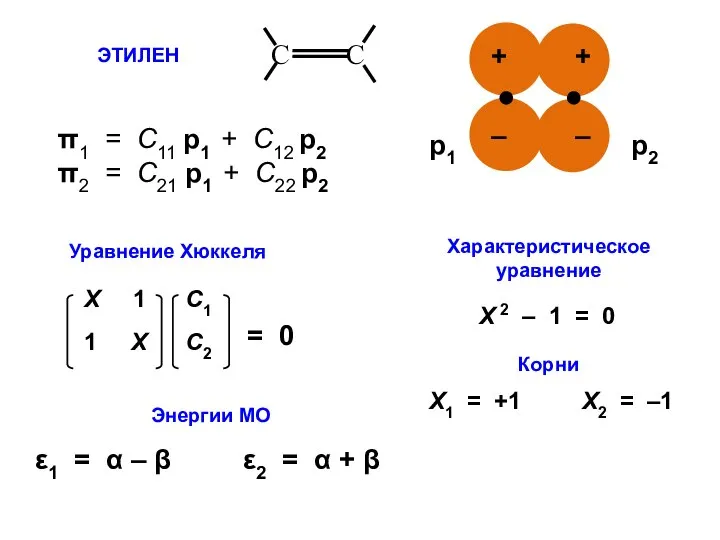
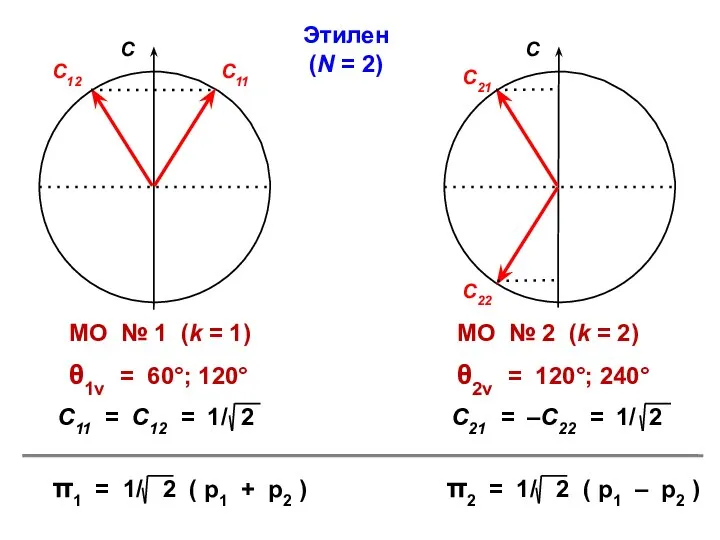
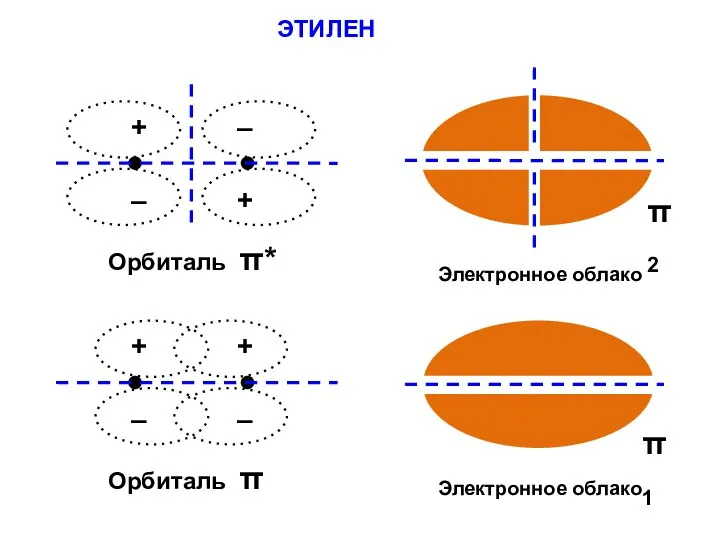
- 17. ЭТИЛЕН π1 = С11 p1 + C12 p2 π2 = С21 p1 + C22 p2 Энергии
- 18. С1 ⋅ Х + С2 = 0 С1 + С2 ⋅ Х = 0
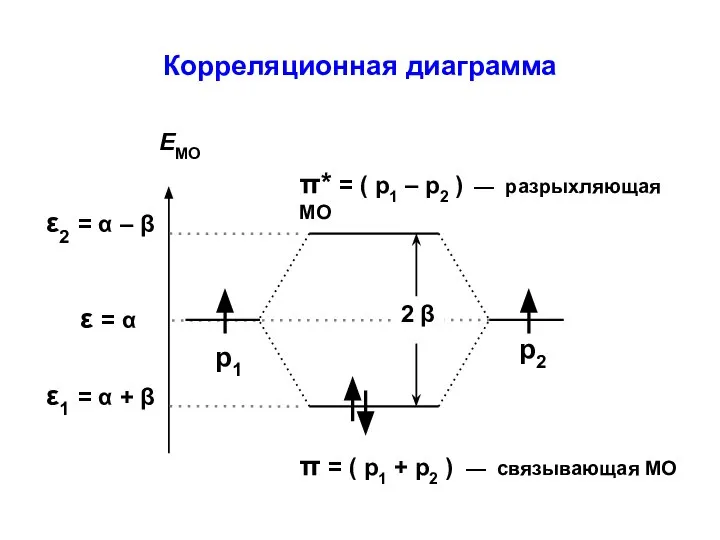
- 19. ε1 = α – β ε2 = α + β МО АО Атомно-молекулярная матрица
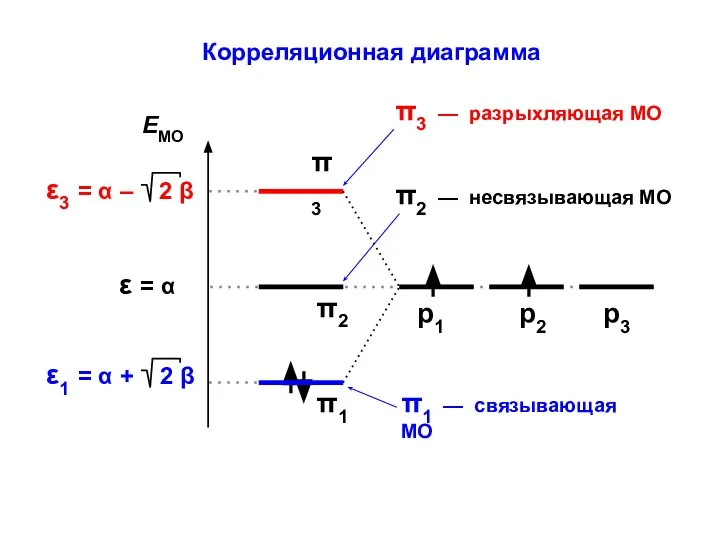
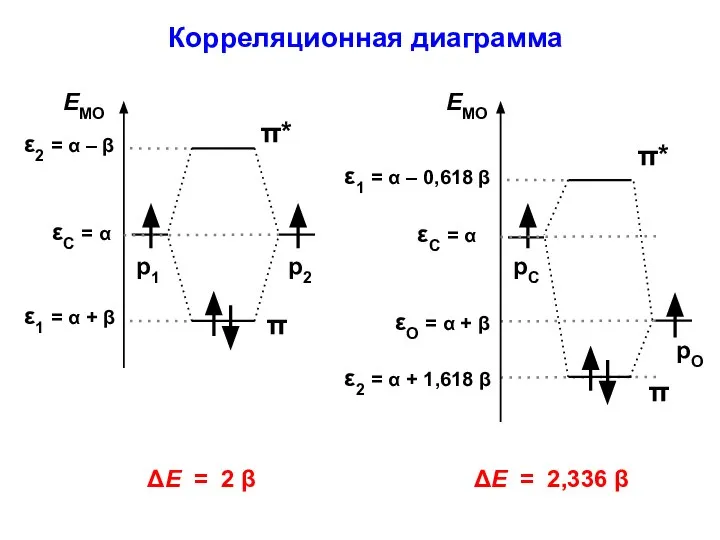
- 20. Корреляционная диаграмма
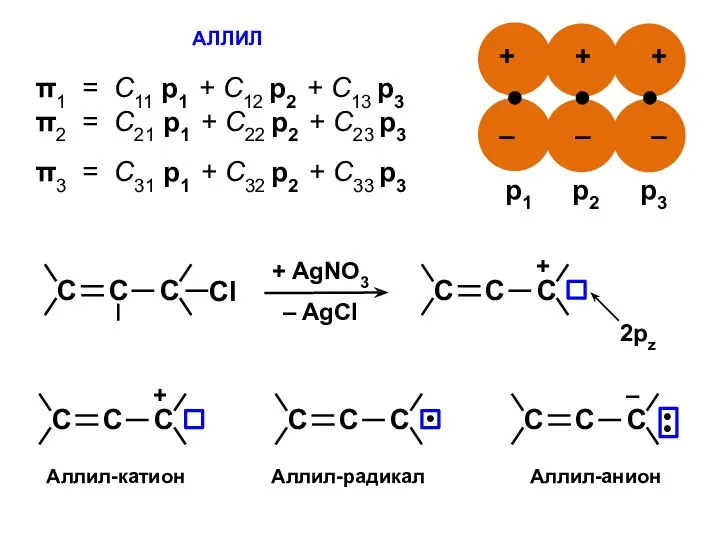
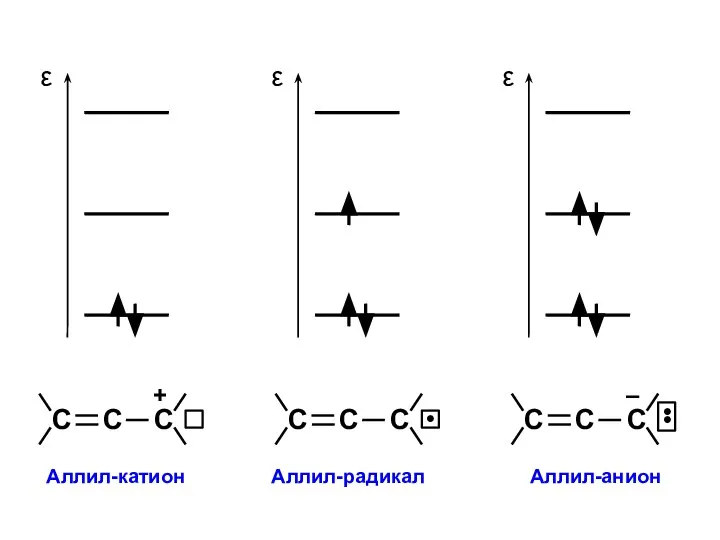
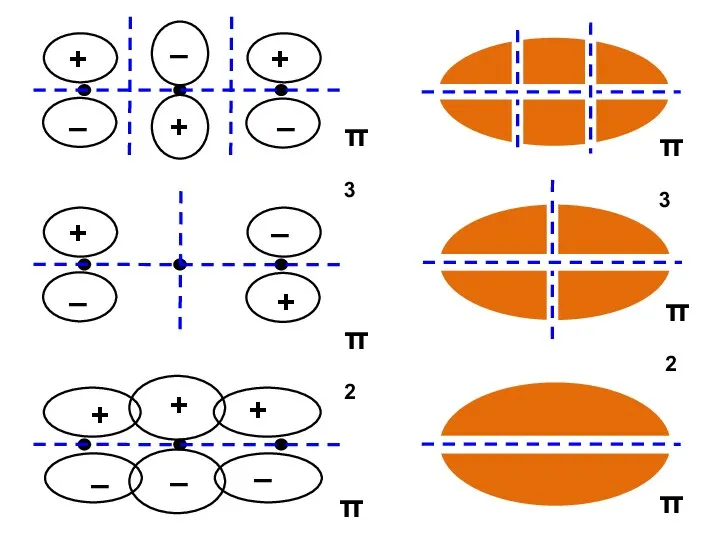
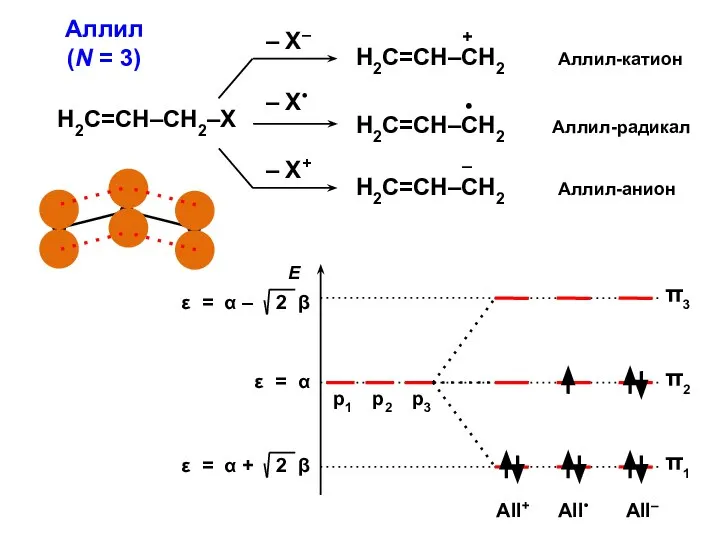
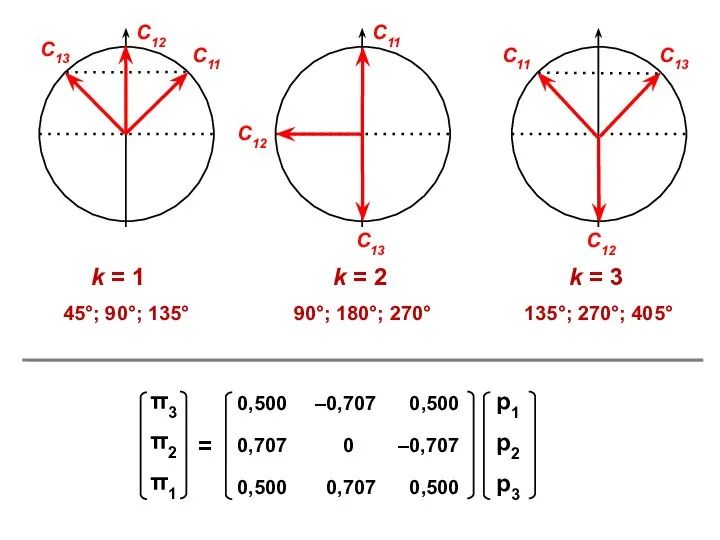
- 22. АЛЛИЛ π1 = С11 p1 + C12 p2 + C13 p3 π2 = С21 p1 +
- 24. С1 ⋅ Х + С2 + 0 = 0 С1 + С2 ⋅ Х + С3
- 26. Корреляционная диаграмма
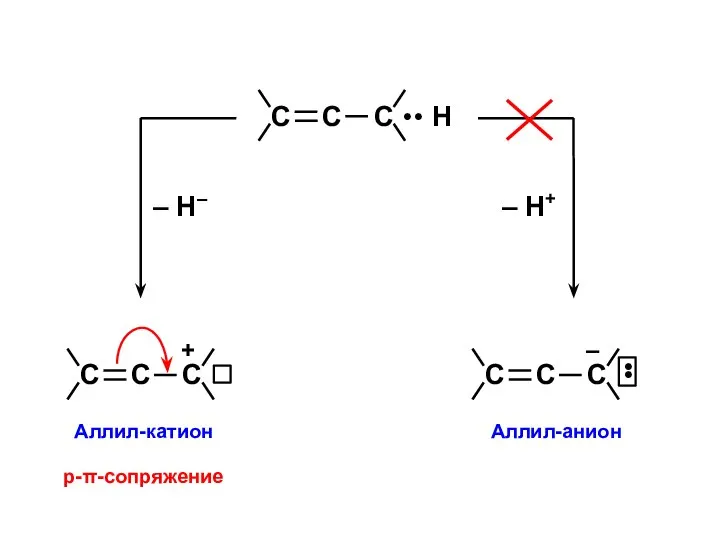
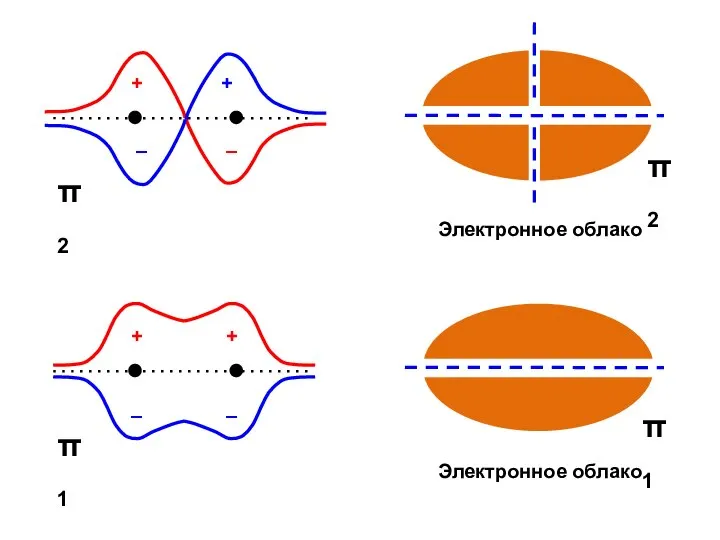
- 28. р-π-сопряжение
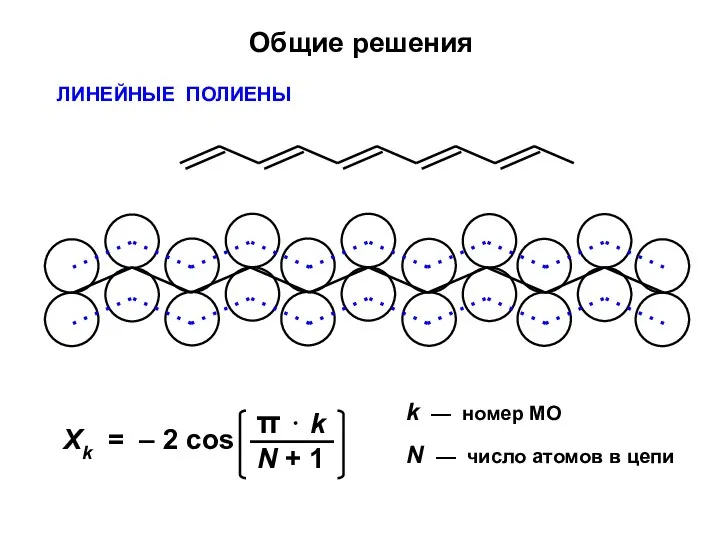
- 30. Общие решения ЛИНЕЙНЫЕ ПОЛИЕНЫ k — номер МО N — число атомов в цепи
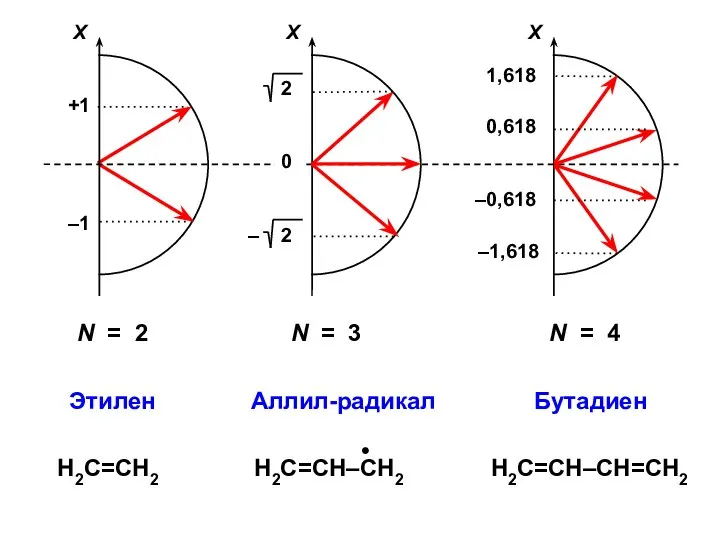
- 31. N = 2 N = 3 N = 4
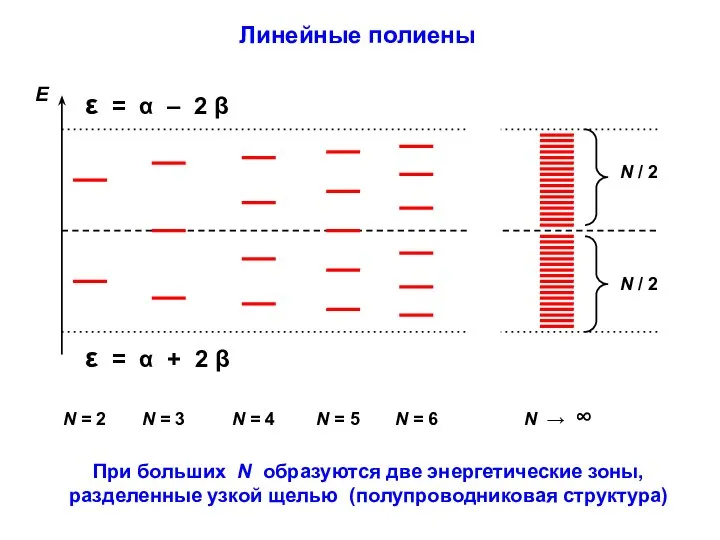
- 32. При больших N образуются две энергетические зоны, разделенные узкой щелью (полупроводниковая структура) Линейные полиены
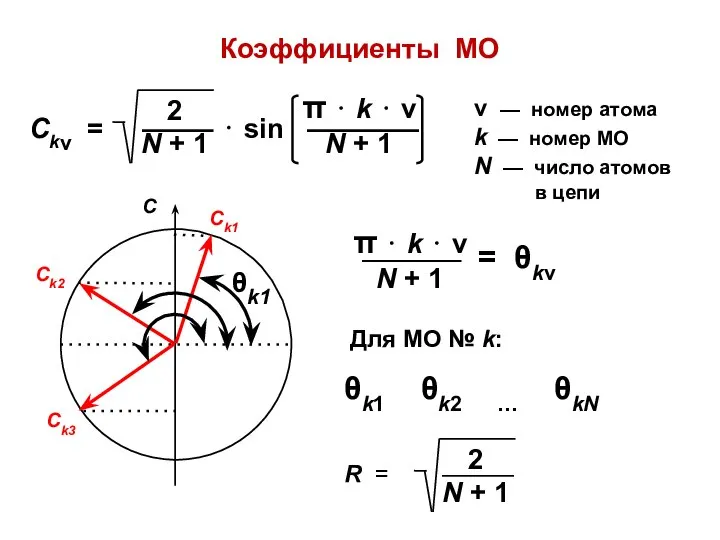
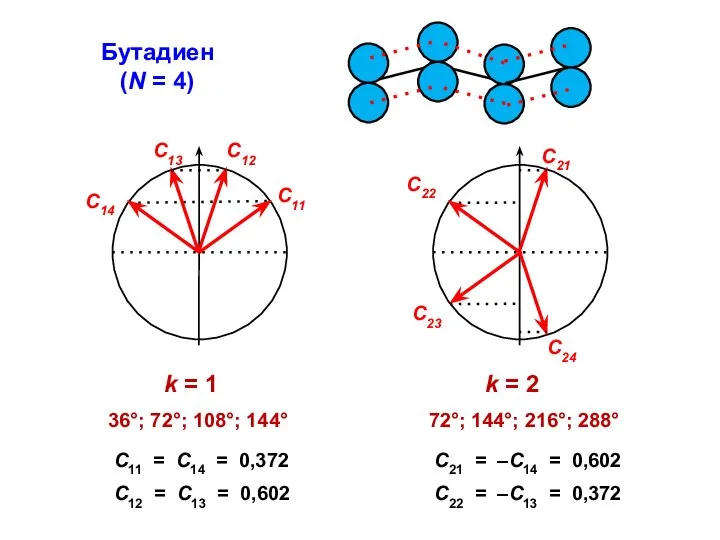
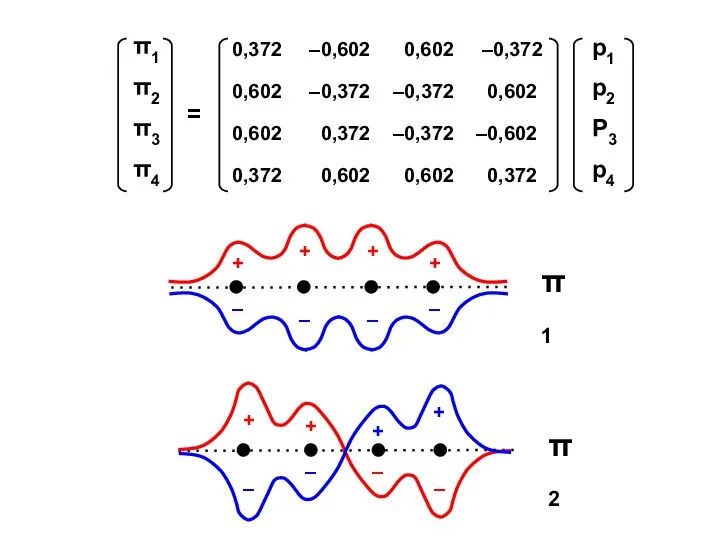
- 33. Коэффициенты МО
- 34. Этилен (N = 2)
- 36. Аллил (N = 3) Н2С=СН–СН2–Х
- 39. Бутадиен (N = 4)
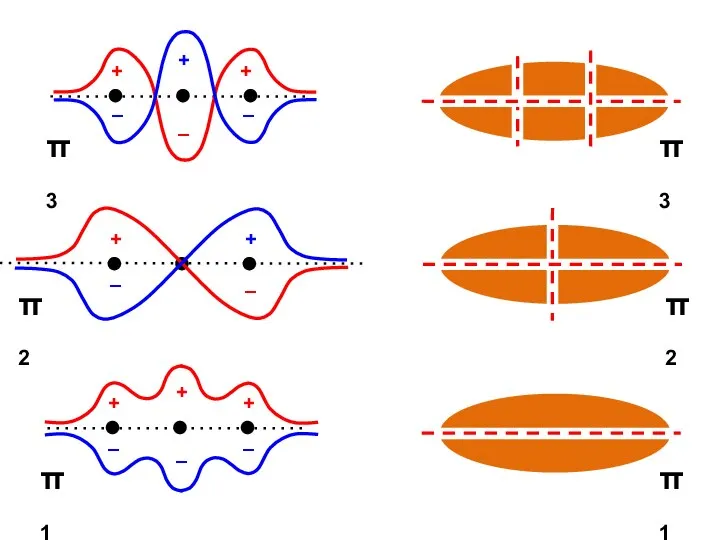
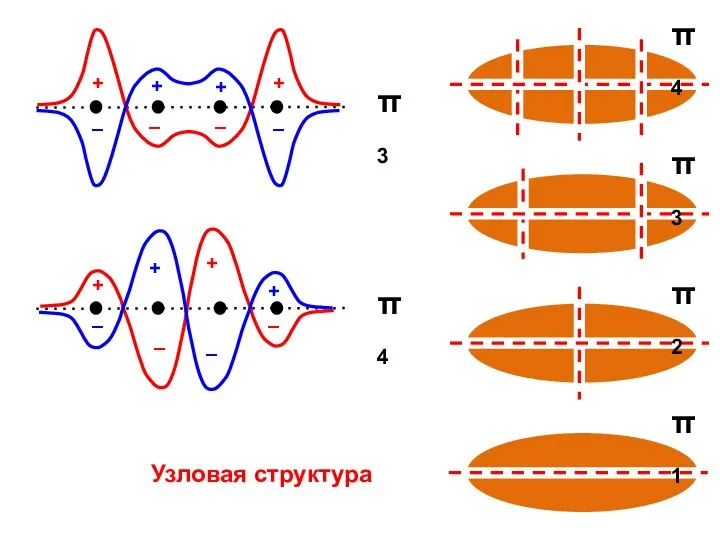
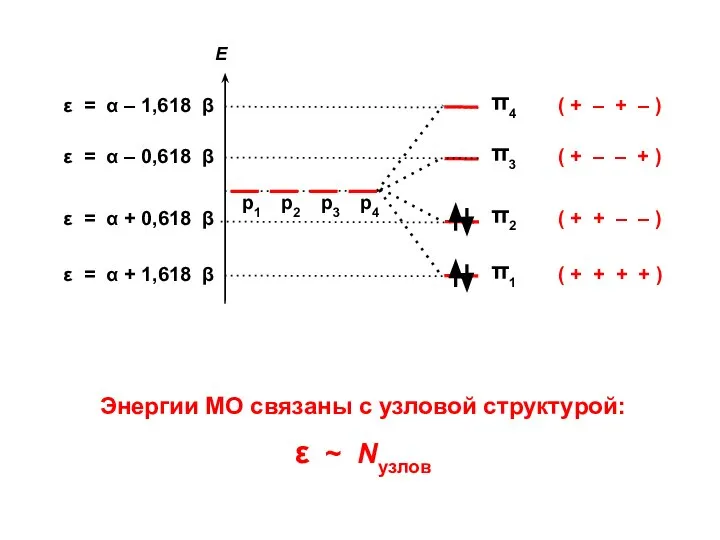
- 42. Узловая структура
- 43. ( + + + + ) ( + + – – ) ( + – –
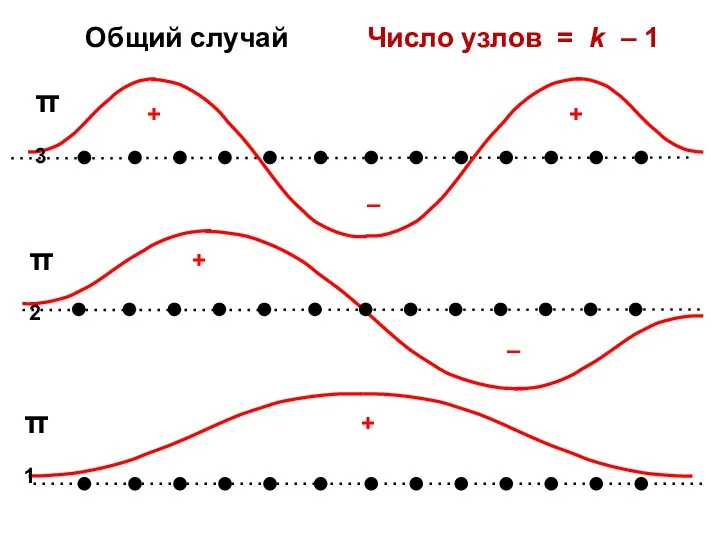
- 44. Общий случай Число узлов = k – 1
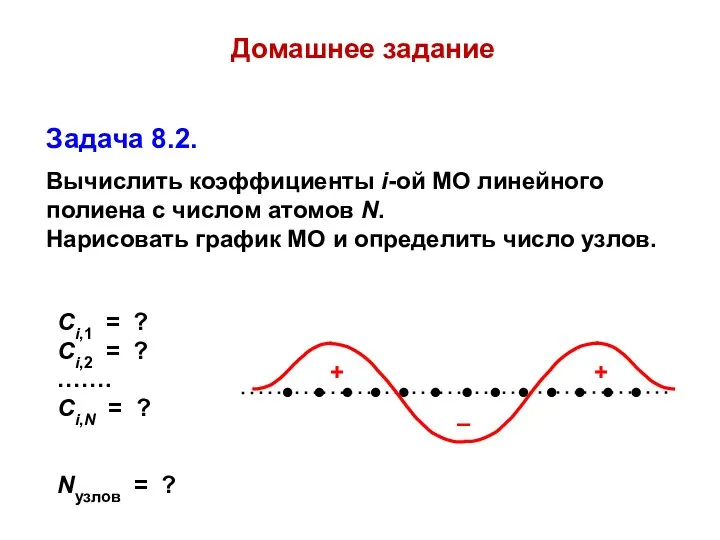
- 45. Домашнее задание Задача 8.2. Вычислить коэффициенты i-ой МО линейного полиена с числом атомов N. Нарисовать график
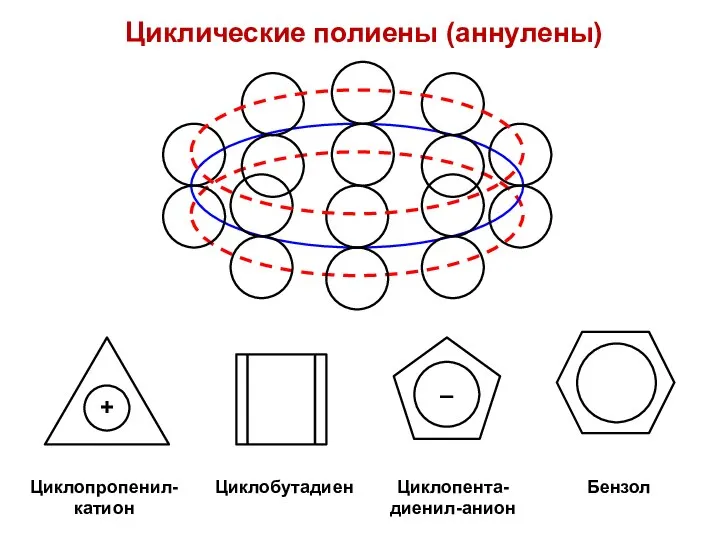
- 46. Циклические полиены (аннулены)
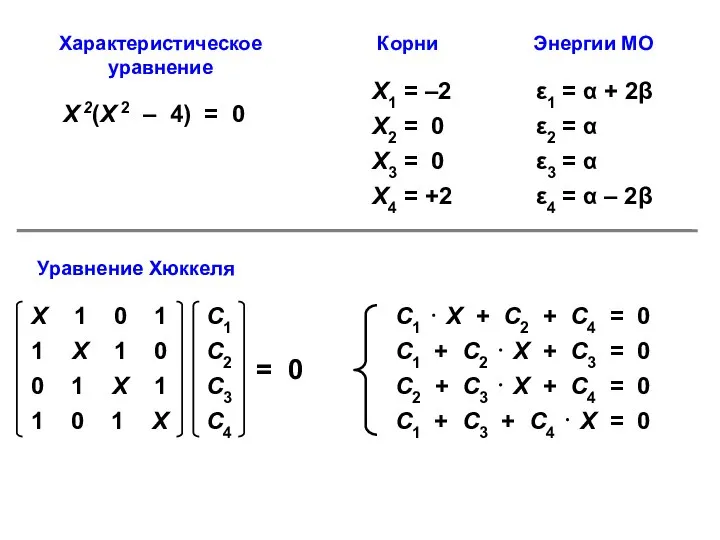
- 47. ЦИКЛОБУТАДИЕН π1 = С11 p1 + C12 p2 + С13 p3 + C14 p4 π2 =
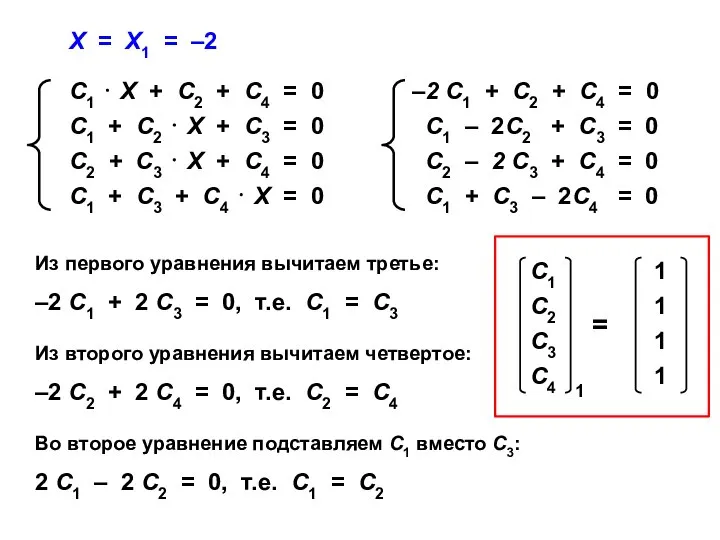
- 49. Х = Х1 = –2 Из первого уравнения вычитаем третье: –2 С1 + 2 С3 =
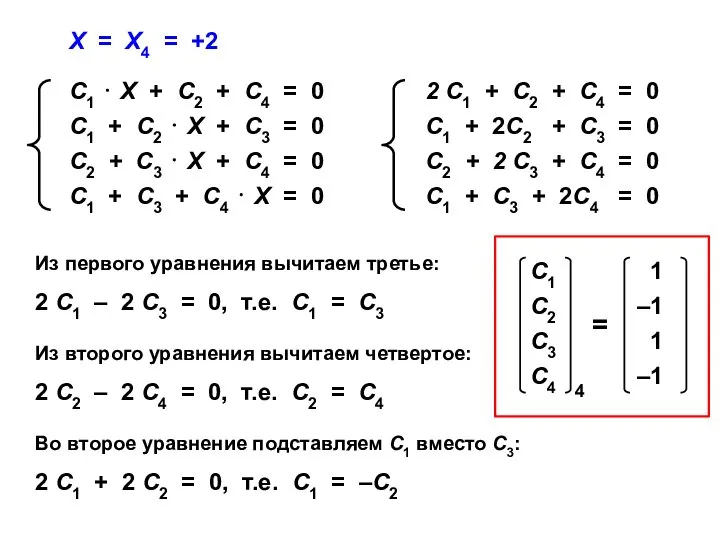
- 50. Х = Х4 = +2 Из первого уравнения вычитаем третье: 2 С1 – 2 С3 =
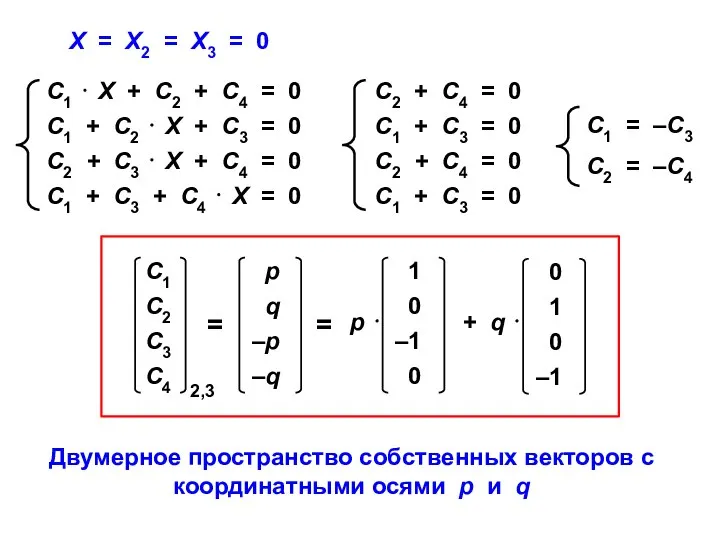
- 51. Х = Х2 = Х3 = 0 Двумерное пространство собственных векторов с координатными осями p и
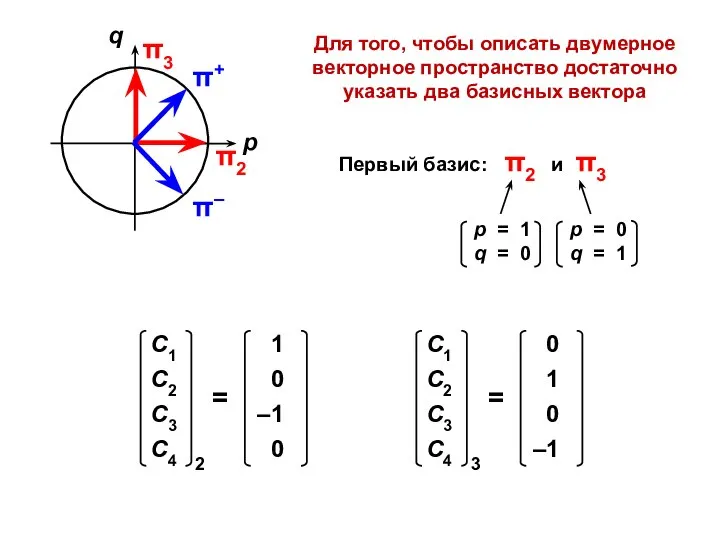
- 52. Для того, чтобы описать двумерное векторное пространство достаточно указать два базисных вектора Первый базис: π2 и
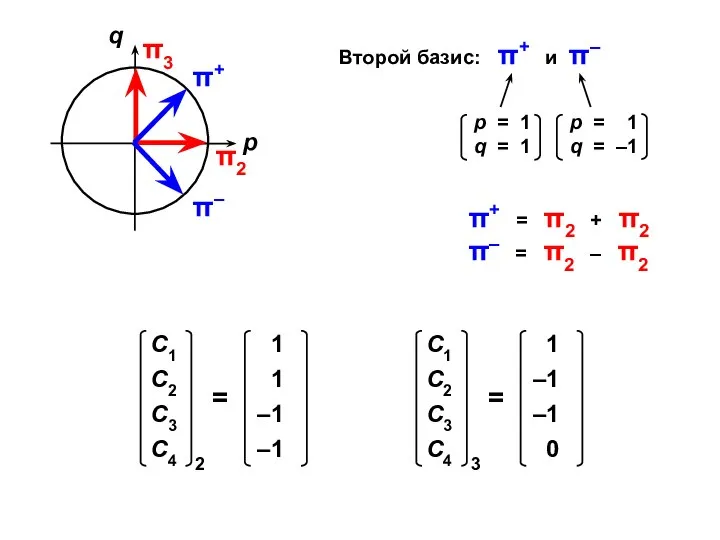
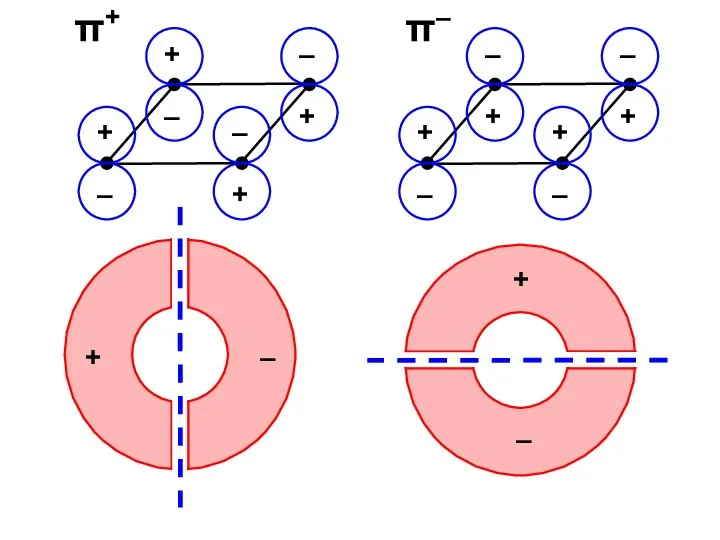
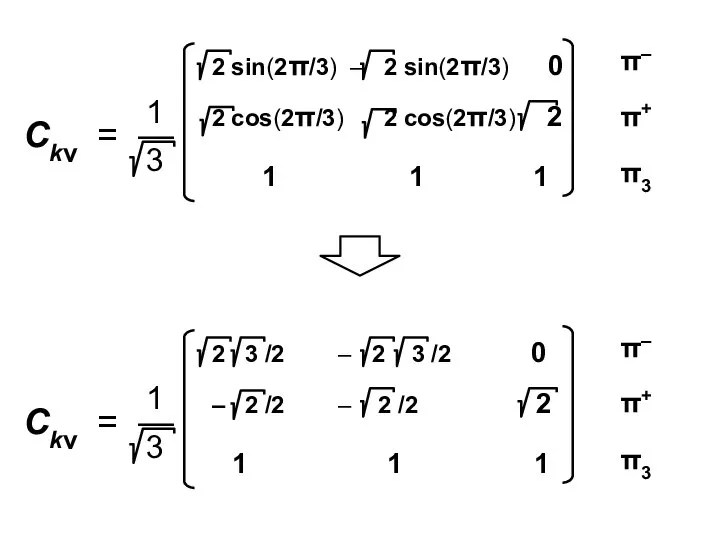
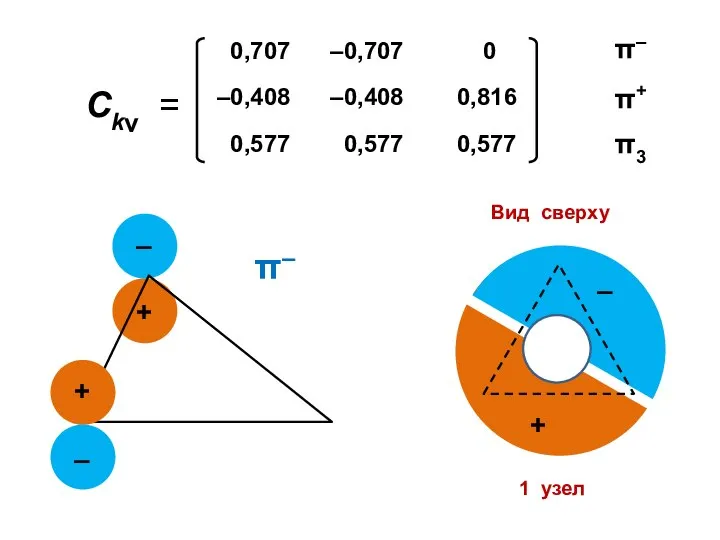
- 53. Второй базис: π+ и π– π+ = π2 + π2 π– = π2 – π2
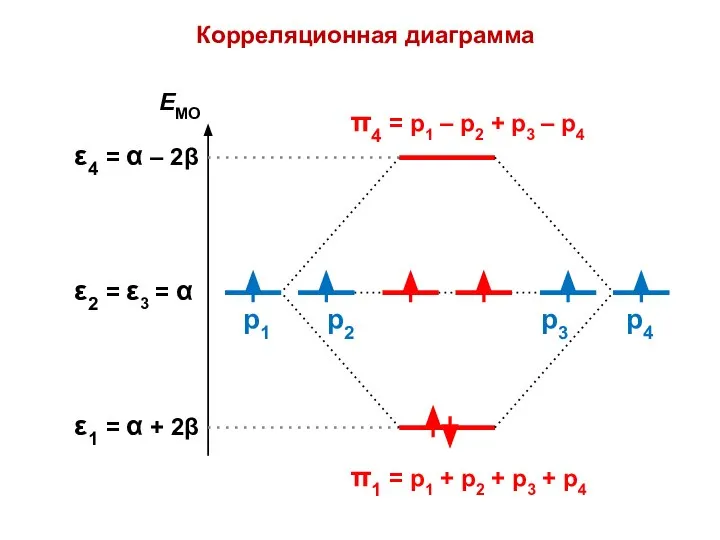
- 54. Корреляционная диаграмма
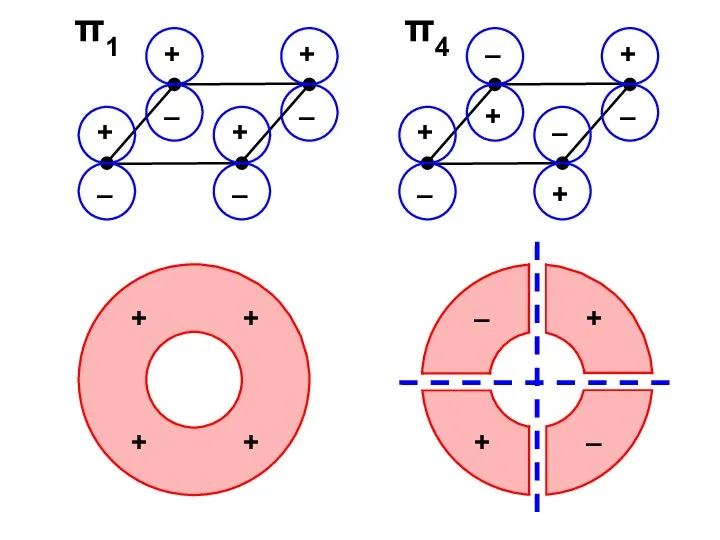
- 55. π1 π4
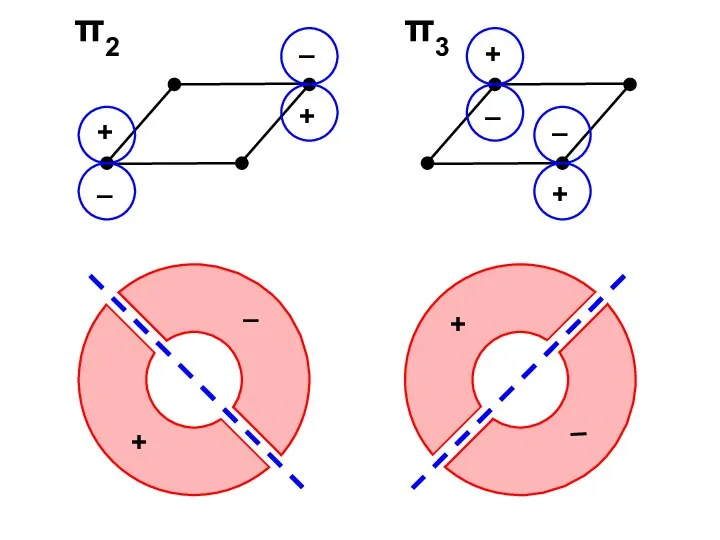
- 56. π2 π3
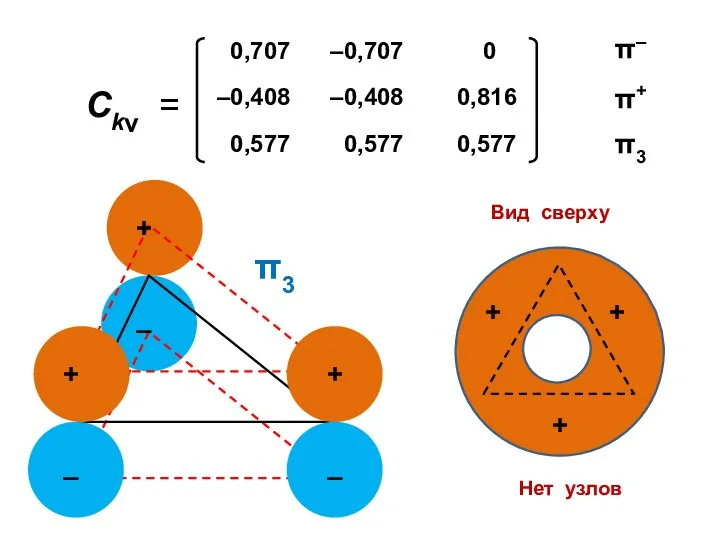
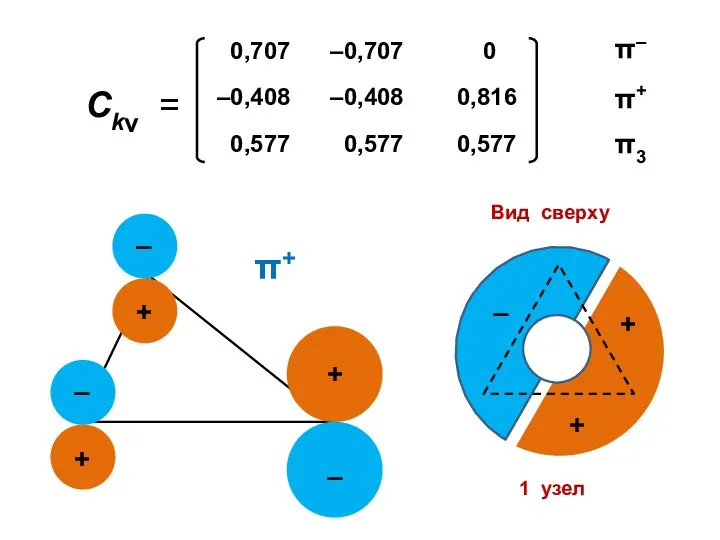
- 57. π+ π–
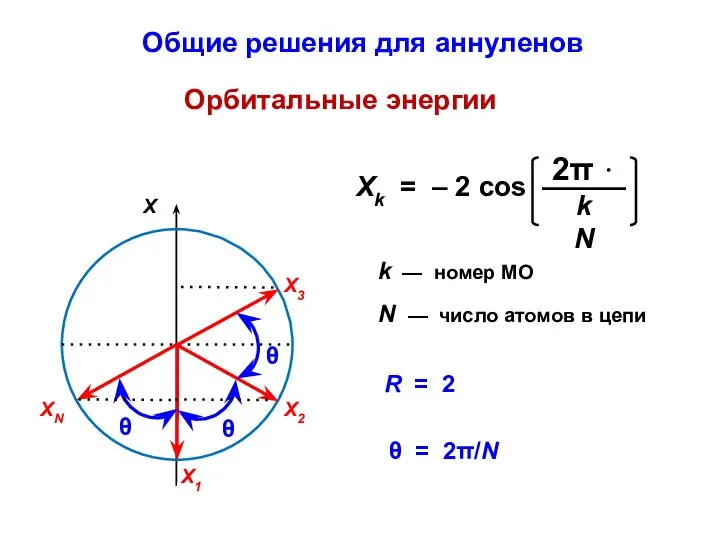
- 58. k — номер МО N — число атомов в цепи Орбитальные энергии θ = 2π/N R
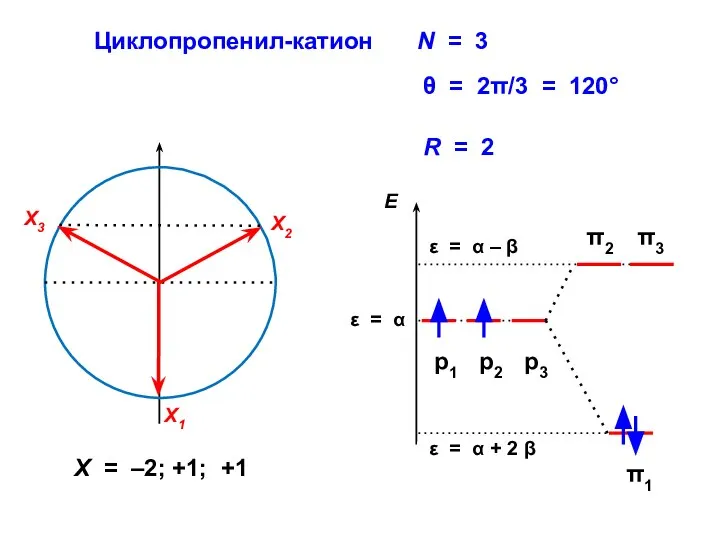
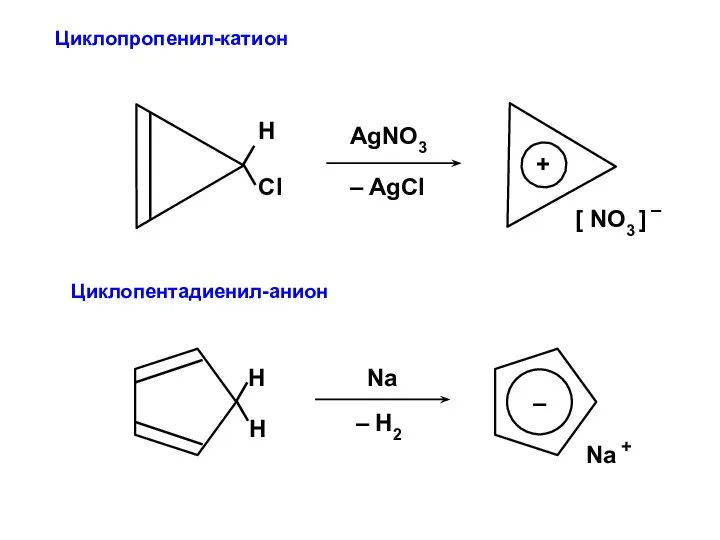
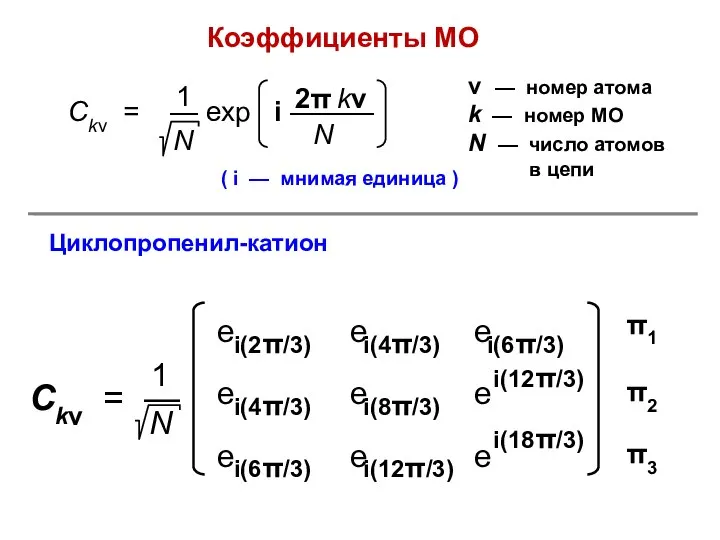
- 59. Циклопропенил-катион R = 2 X = –2; +1; +1
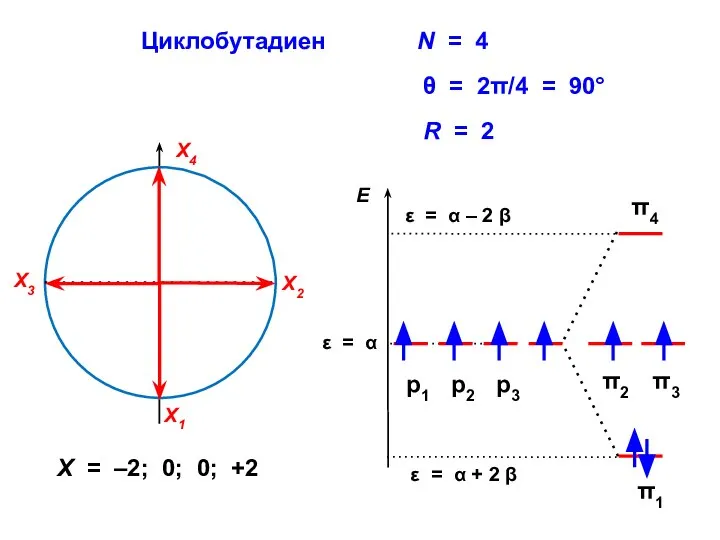
- 60. Циклобутадиен R = 2 X = –2; 0; 0; +2
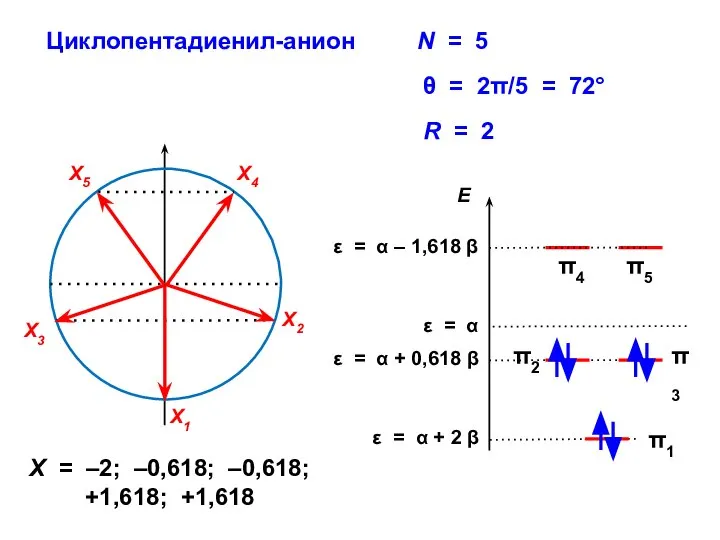
- 61. Циклопентадиенил-анион R = 2 X = –2; –0,618; –0,618; +1,618; +1,618
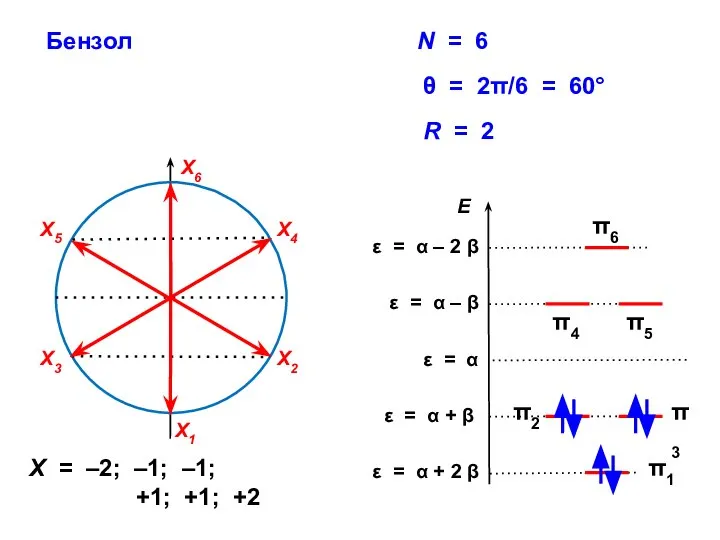
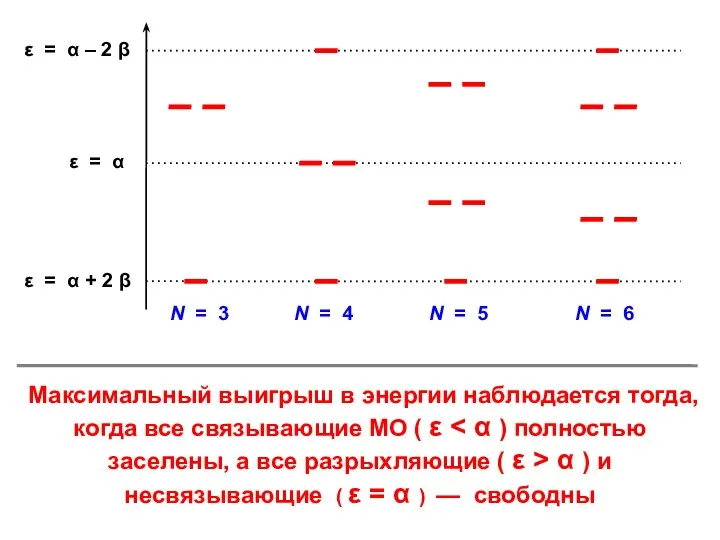
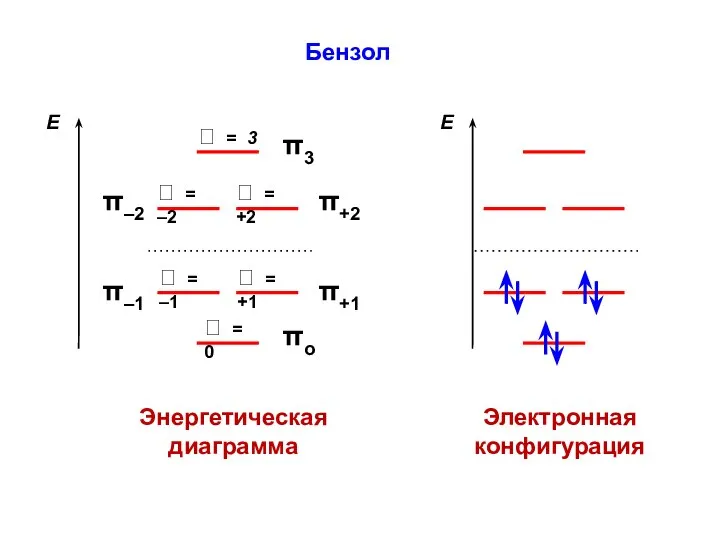
- 62. Бензол R = 2 X = –2; –1; –1; +1; +1; +2
- 63. Максимальный выигрыш в энергии наблюдается тогда, когда все связывающие МО ( ε α ) и несвязывающие
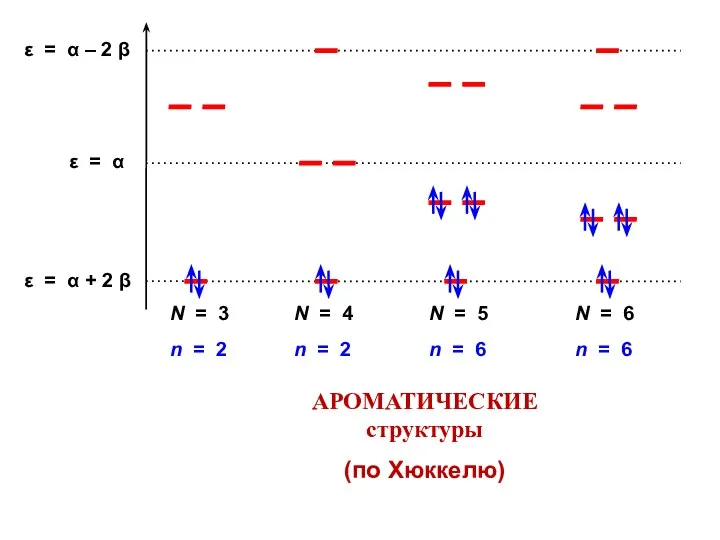
- 64. АРОМАТИЧЕСКИЕ структуры (по Хюккелю)
- 65. Число связывающих МО всегда нечетно и его можно выразить формулой (2k + 1), где k =
- 66. Циклопропенил-катион Циклопентадиенил-анион
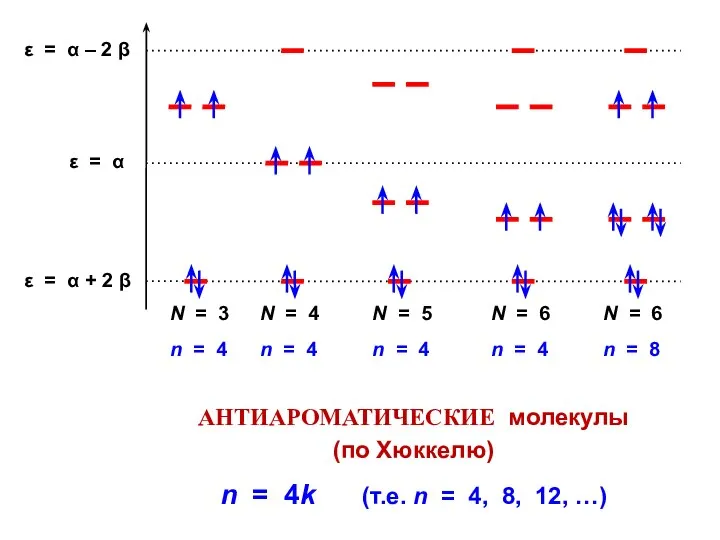
- 67. АНТИАРОМАТИЧЕСКИЕ молекулы (по Хюккелю) n = 4k (т.е. n = 4, 8, 12, …)
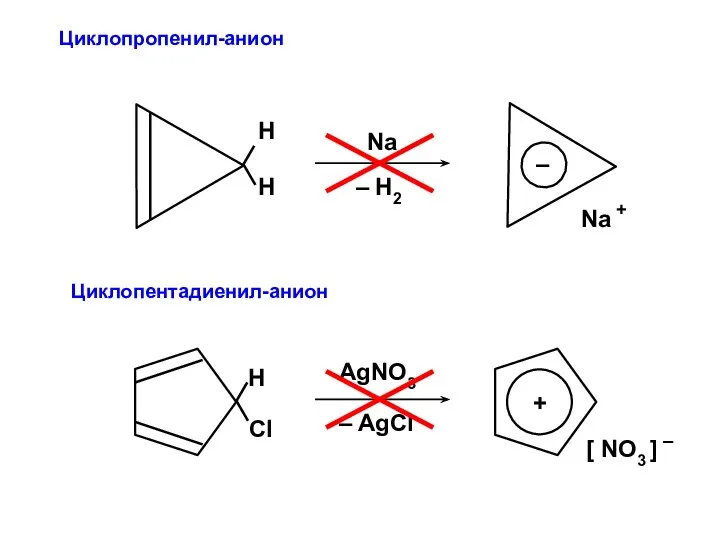
- 68. Циклопропенил-анион Циклопентадиенил-анион
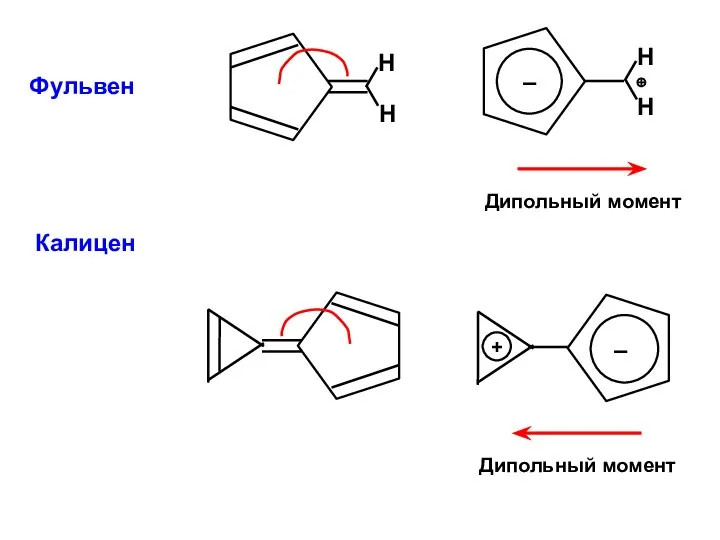
- 69. Фульвен Калицен
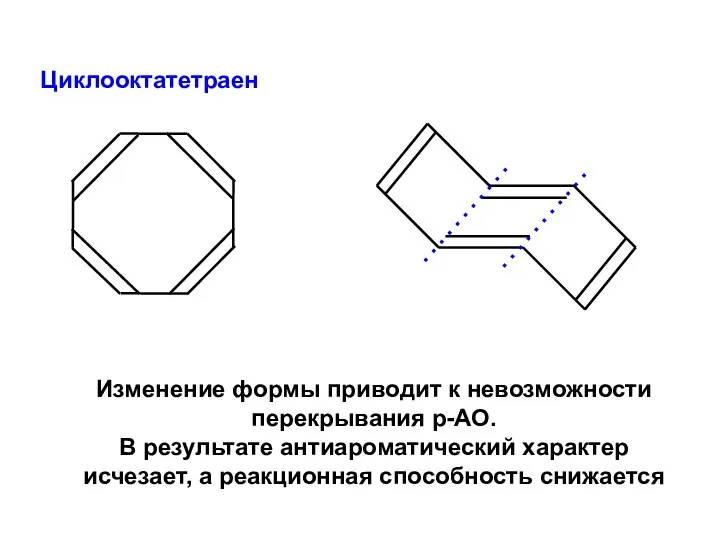
- 70. Циклооктатетраен Изменение формы приводит к невозможности перекрывания р-АО. В результате антиароматический характер исчезает, а реакционная способность
- 71. Атомы, содержащие во внешней подоболочке n = 4 + 2 электронов (т.е. n = 2 (s),
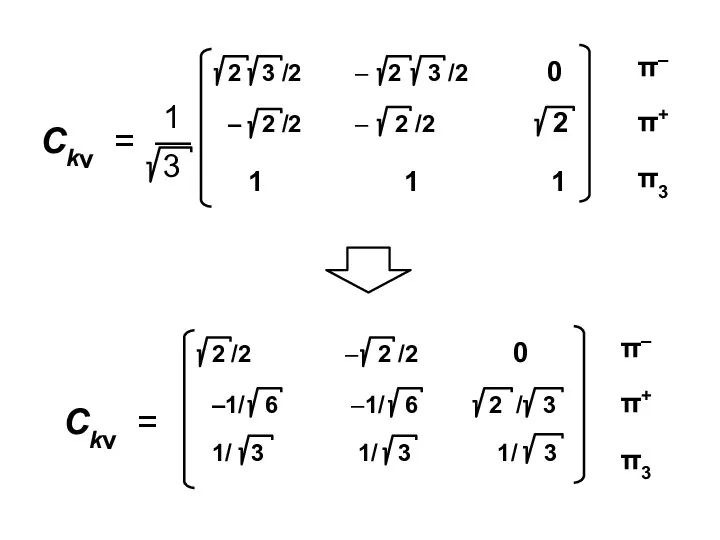
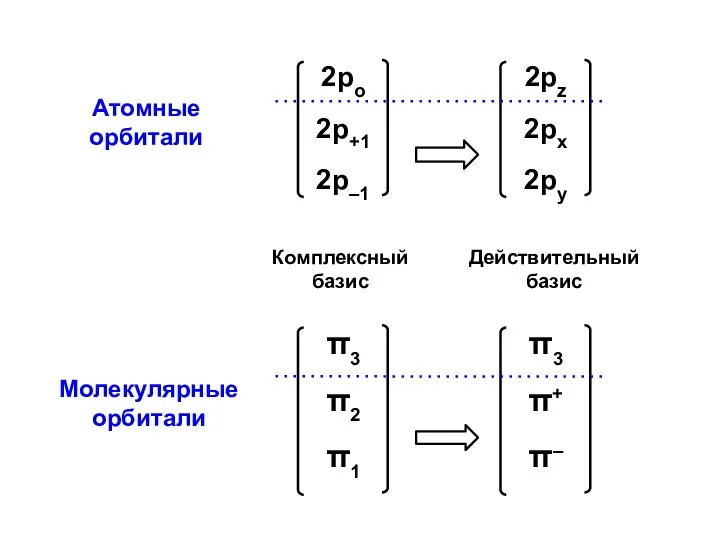
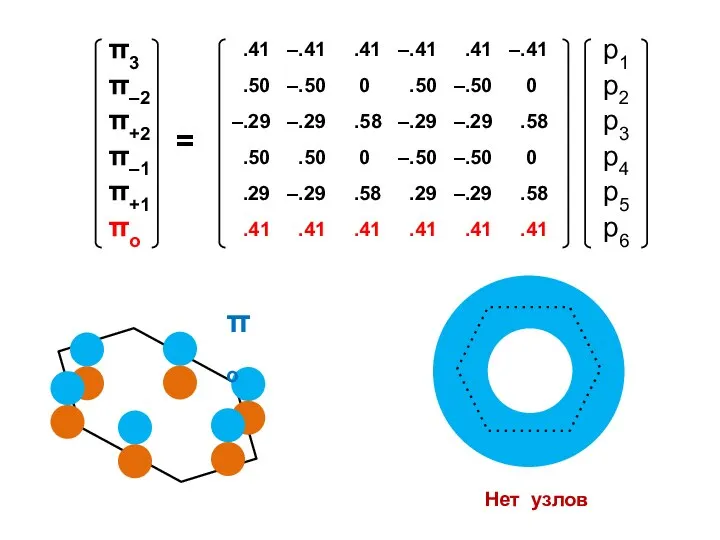
- 72. Коэффициенты МО ( i — мнимая единица ) ν — номер атома k — номер МО
- 80. Атомные орбитали Молекулярные орбитали
- 81. Процедура преобразования к действительному базису возможна для любого аннулена
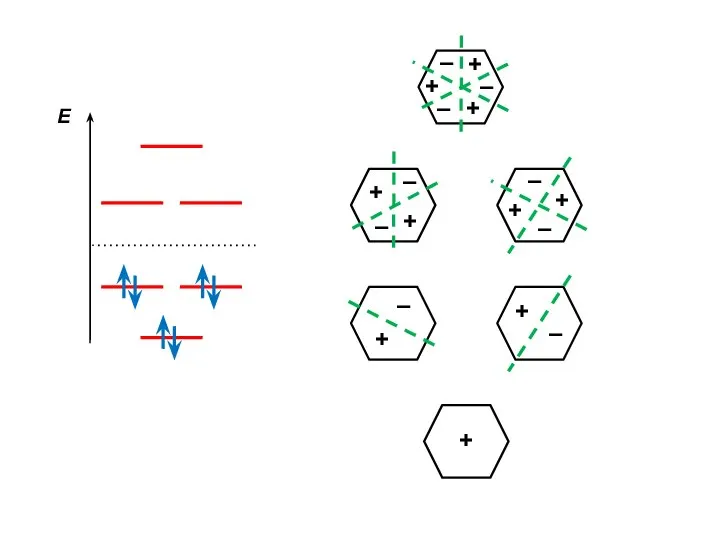
- 82. Бензол Энергетическая диаграмма Электронная конфигурация
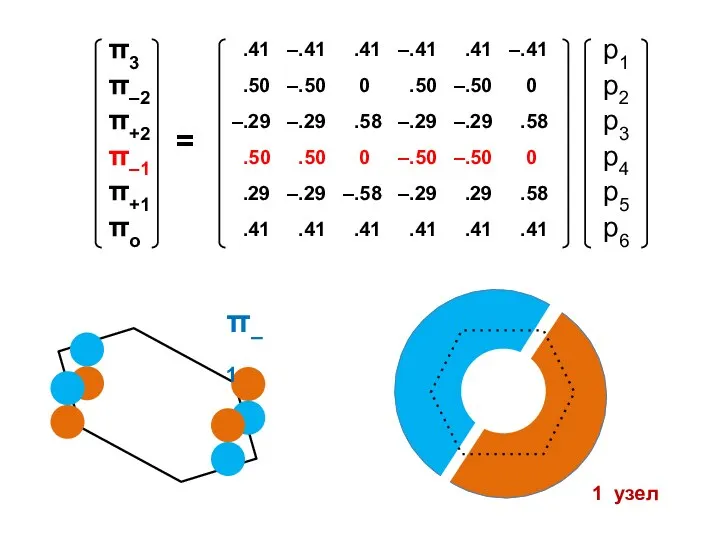
- 85. 1 узел
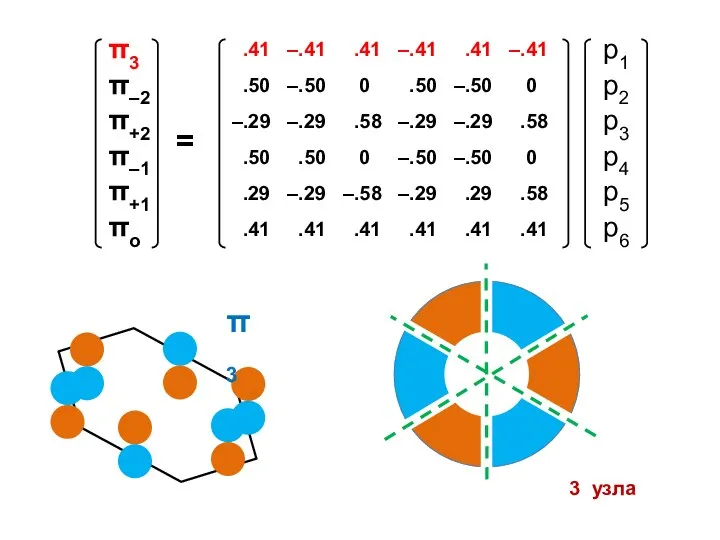
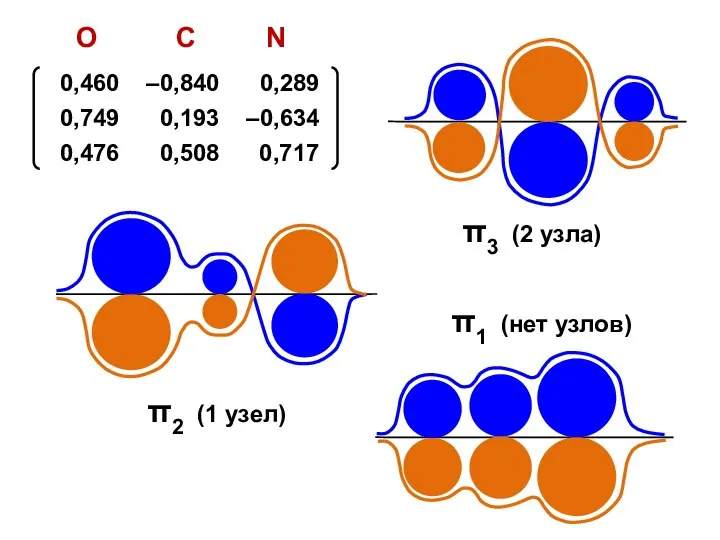
- 90. Гетероатомные молекулы π1 = С11 p1 + C12 p2 π2 = С21 p1 + C22 p2
- 91. Х1 = +1 Х2 = –1 Х 2 + Х – 1 = 0 Х1 =
- 92. Коэффициенты МО С1 ⋅ Х + С2 = 0 С1 + С2 ⋅ Х + С2
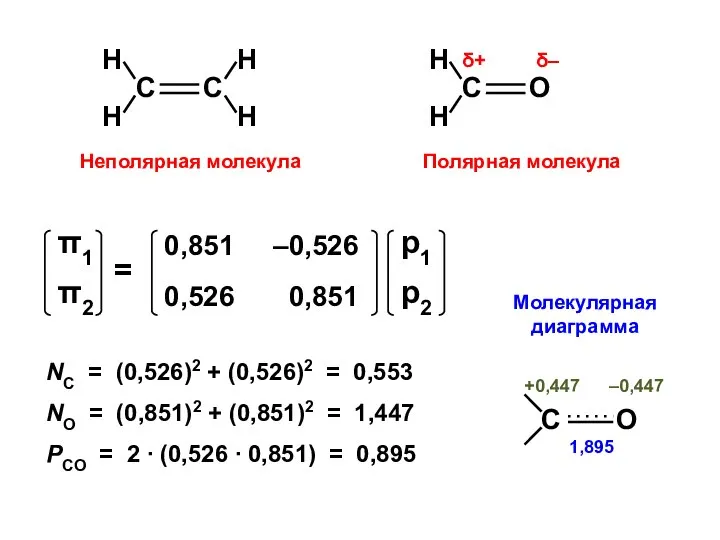
- 93. Атомно-молекулярная матрица этилен формальдегид
- 94. ΔЕ = 2 β Корреляционная диаграмма рО ΔЕ = 2,336 β
- 95. ЭТИЛЕН
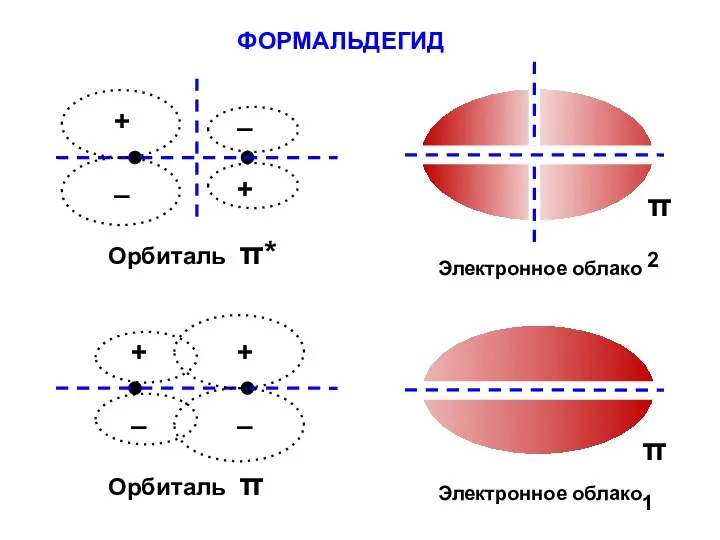
- 96. ФОРМАЛЬДЕГИД
- 97. NC = (0,526)2 + (0,526)2 = 0,553 NO = (0,851)2 + (0,851)2 = 1,447 PCO =
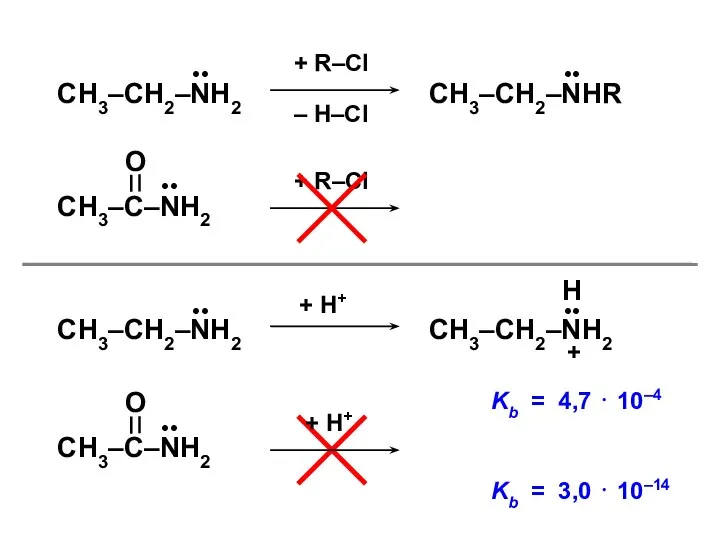
- 98. δ+ δ– δ– δ+
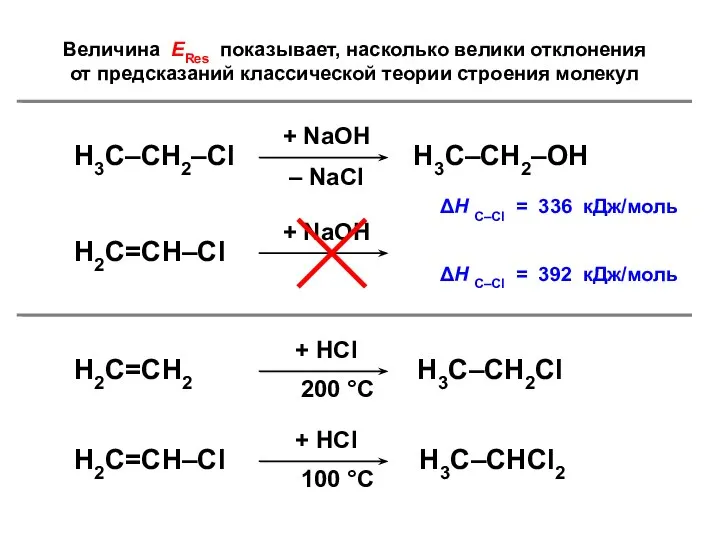
- 99. Винилхлорид >C=C—Cl: h = 2,0 K = 0,4 Det = Х 3 + 2Х 2 –
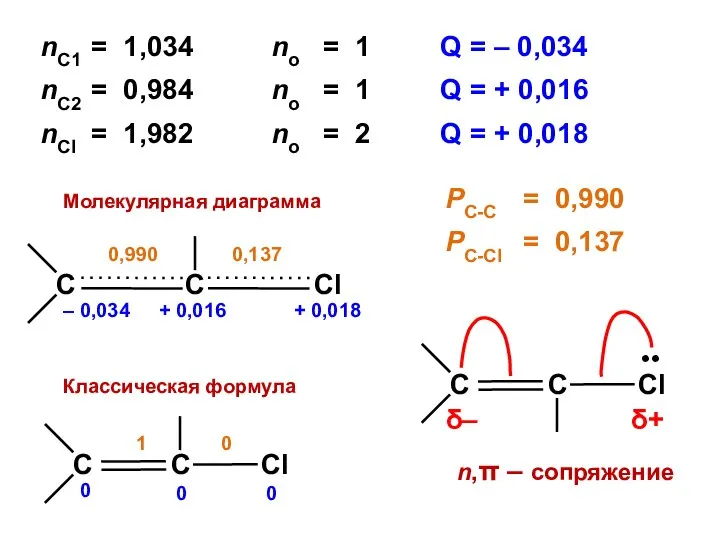
- 101. nC1 = 1,034 no = 1 Q = – 0,034 nC2 = 0,984 no = 1
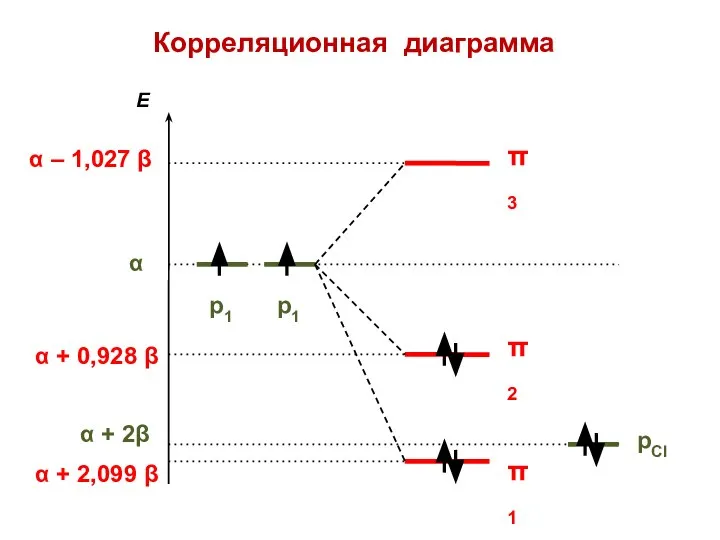
- 103. Корреляционная диаграмма
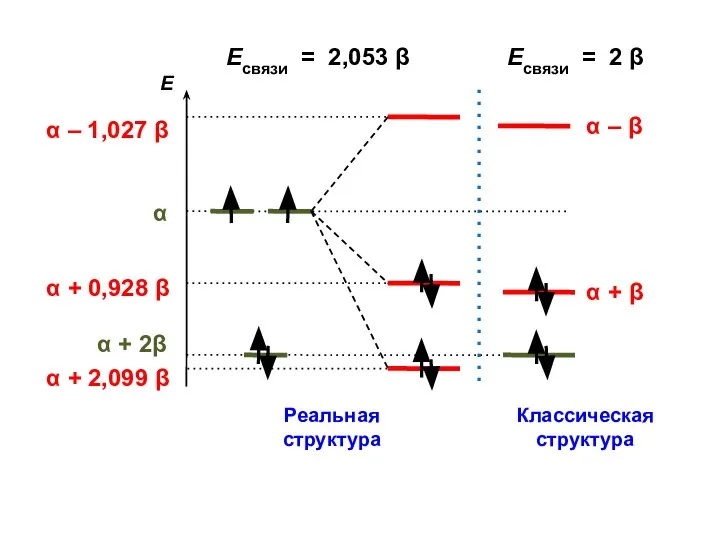
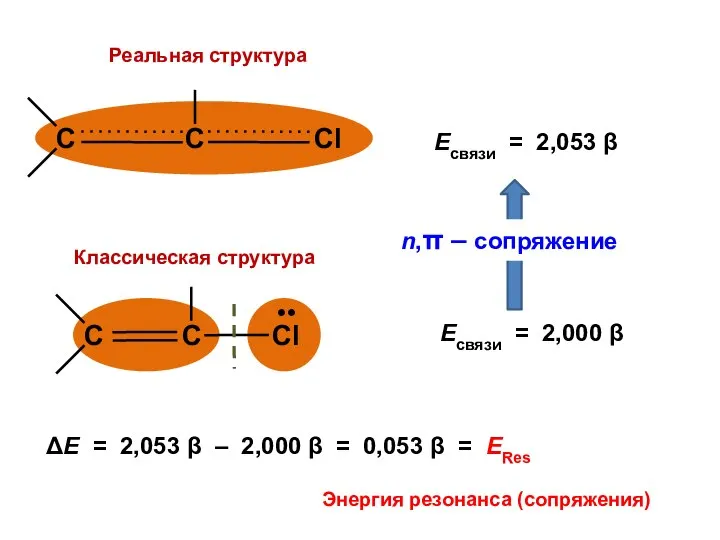
- 104. Есвязи = 2,053 β Есвязи = 2 β
- 105. ΔЕ = 2,053 β – 2,000 β = 0,053 β = ЕRes Энергия резонанса (сопряжения)
- 106. Величина ЕRes показывает, насколько велики отклонения от предсказаний классической теории строения молекул
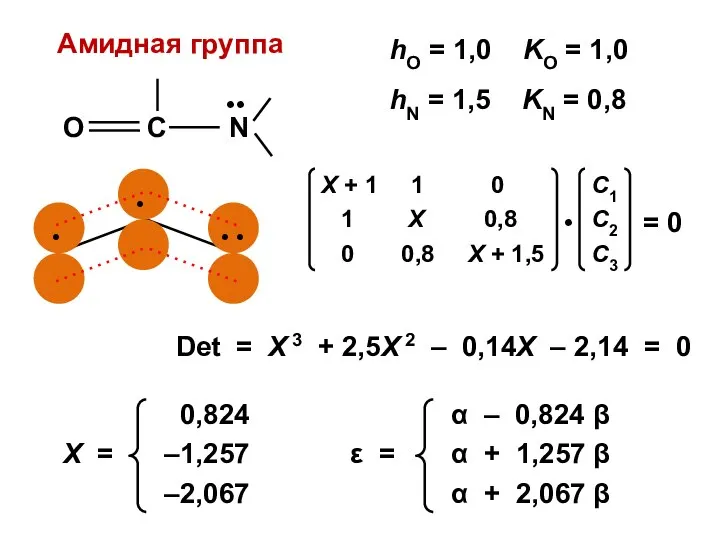
- 107. hO = 1,0 KO = 1,0 Det = Х 3 + 2,5Х 2 – 0,14Х –
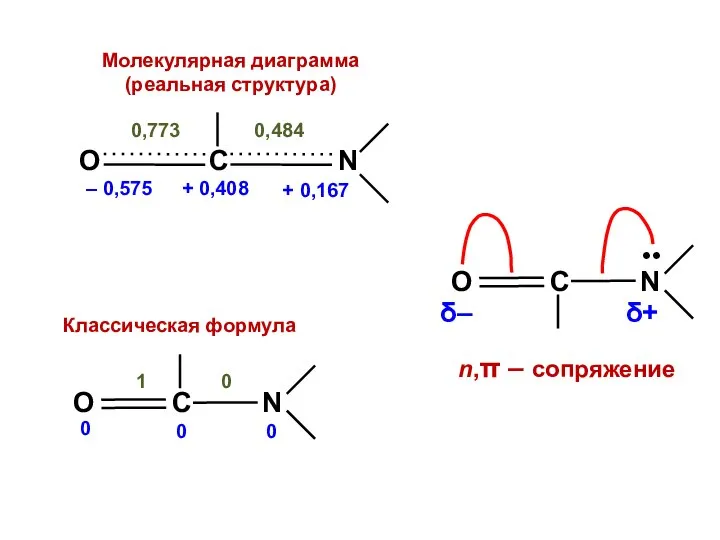
- 108. nO = 1,575 no = 1 Q = – 0,575 nC = 0,592 no = 1
- 109. δ+ δ–
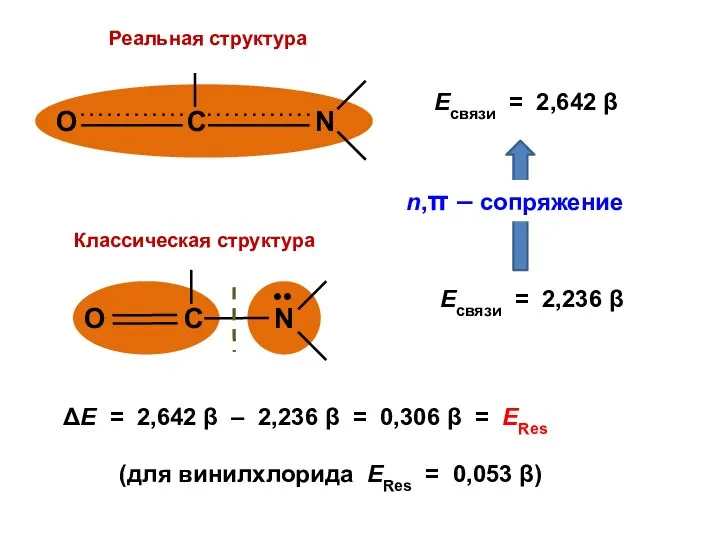
- 111. ΔЕ = 2,642 β – 2,236 β = 0,306 β = ЕRes (для винилхлорида ЕRes =
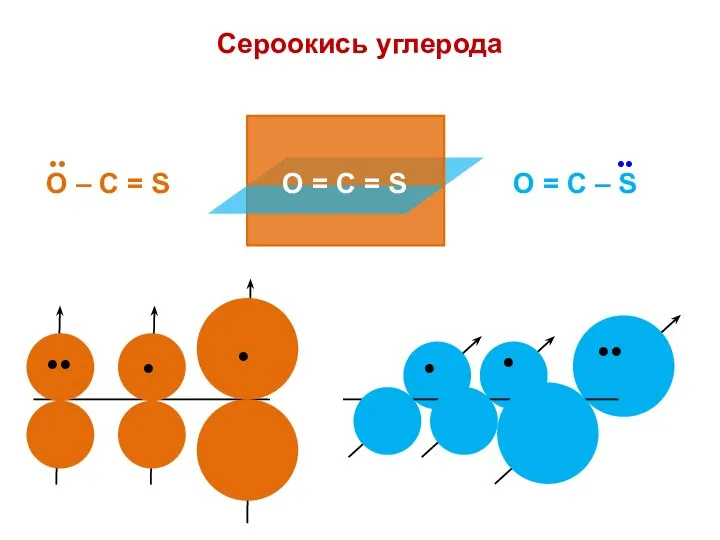
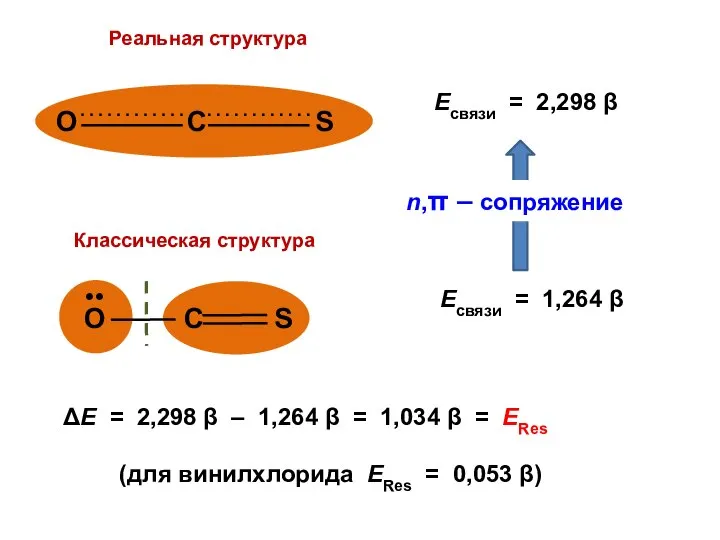
- 113. Сероокись углерода O = С = S
- 114. hO = 2,0 KO = 0,8 Det = Х 3 + 2,4Х 2 – 0,84Х –
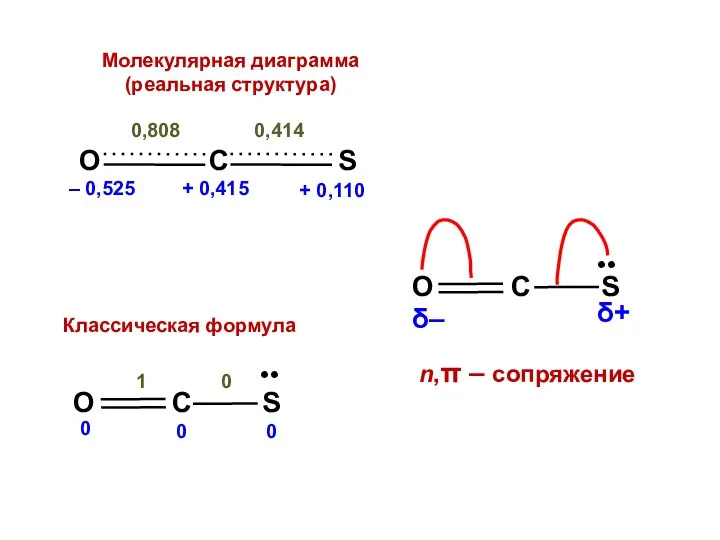
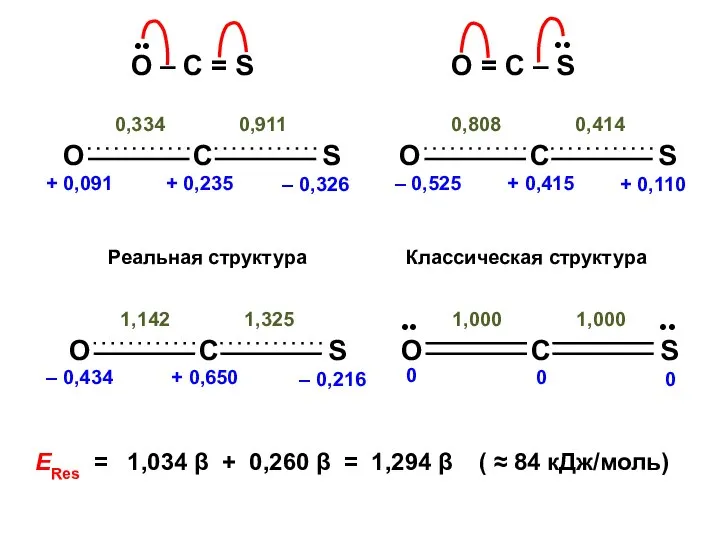
- 115. nO = 1,909 no = 2 Q = + 0,091 nC = 0,765 no = 1
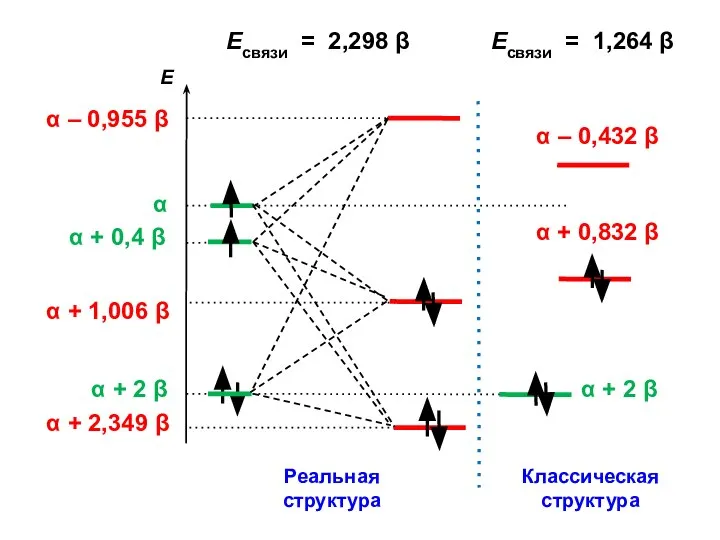
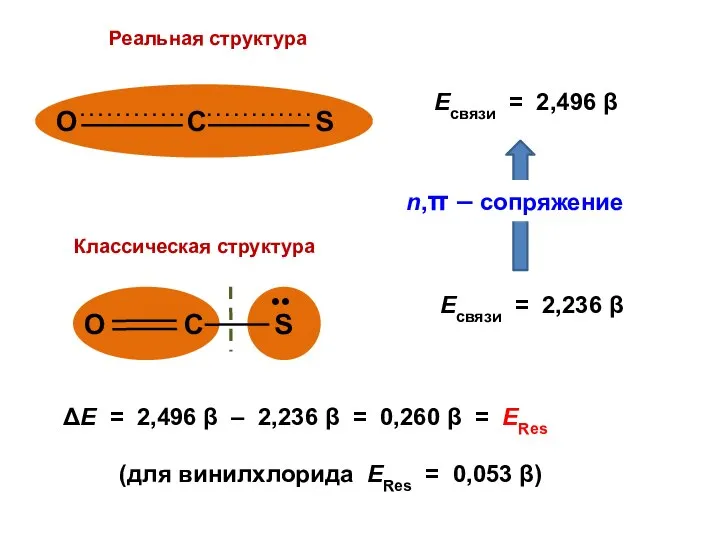
- 117. Есвязи = 2,298 β Есвязи = 1,264 β
- 118. ΔЕ = 2,298 β – 1,264 β = 1,034 β = ЕRes (для винилхлорида ЕRes =
- 119. hO = 1,0 KO = 1,0 Det = Х 3 + 2,3Х 2 – 0,06Х –
- 120. nO = 1,525 no = 1 Q = – 0,525 nC = 0,585 no = 1
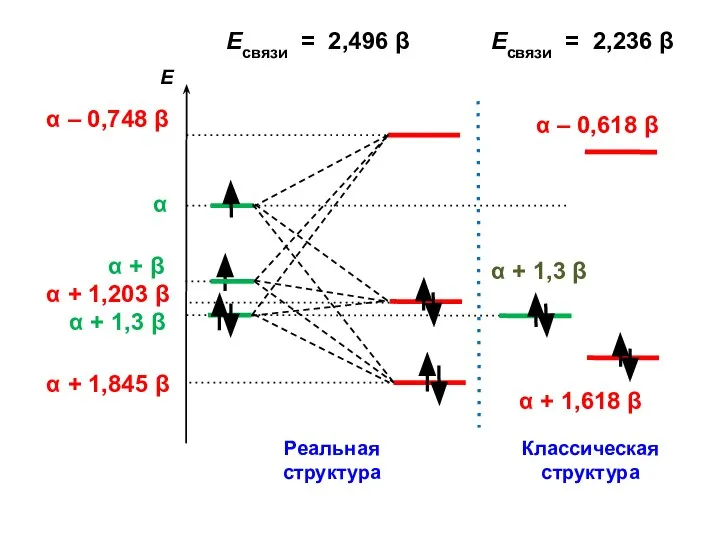
- 122. Есвязи = 2,496 β Есвязи = 2,236 β
- 123. ΔЕ = 2,496 β – 2,236 β = 0,260 β = ЕRes (для винилхлорида ЕRes =
- 124. ЕRes = 1,034 β + 0,260 β = 1,294 β ( ≈ 84 кДж/моль)
- 125. Задача 8.3.
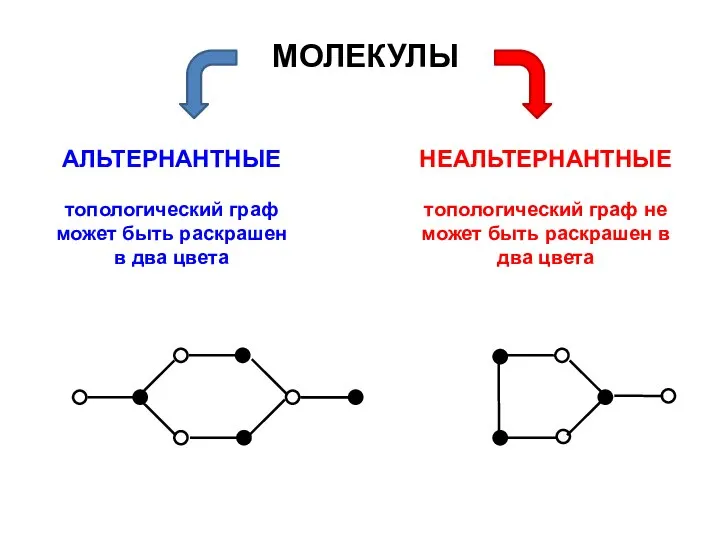
- 126. АЛЬТЕРНАНТНЫЕ топологический граф может быть раскрашен в два цвета НЕАЛЬТЕРНАНТНЫЕ топологический граф не может быть раскрашен
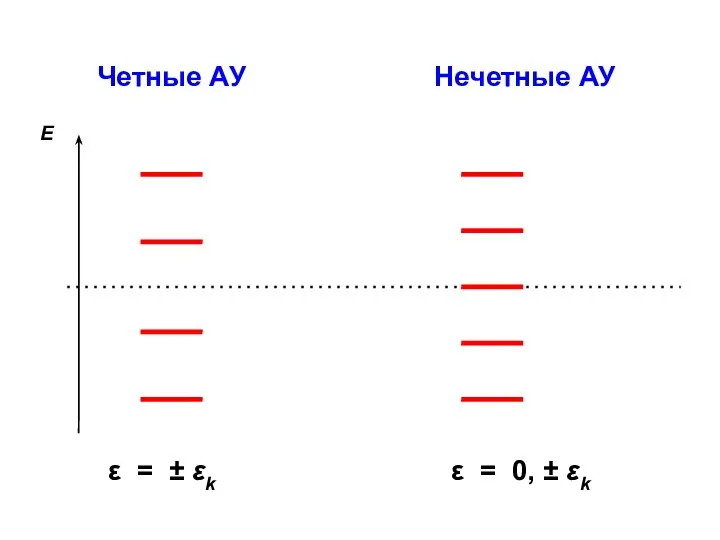
- 127. В четных АУ нециклического типа величины Х имеют вид ± Хk , т.е. встречаются только парами
- 128. Четные АУ Нечетные АУ Е ε = ± εk ε = 0, ± εk
- 129. Для нециклических альтернантных молекул все величины Х различны между собой; все энергетические уровни не вырождены Для
- 131. Скачать презентацию




































 Презентация Законодательство по охране труда
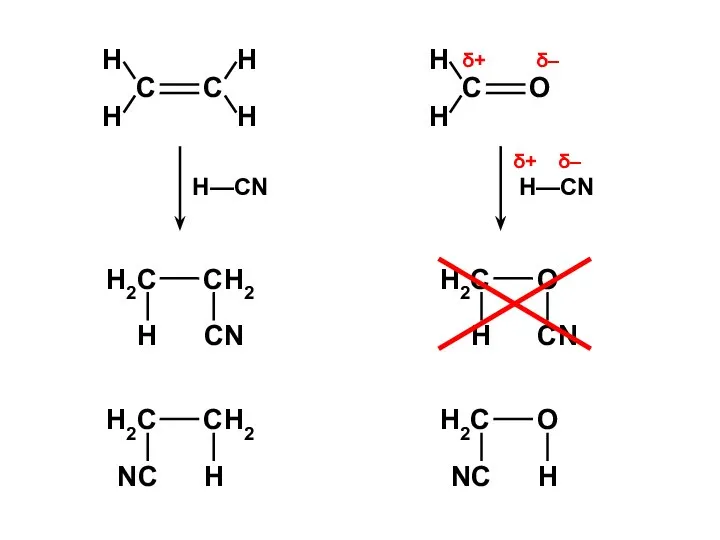
Презентация Законодательство по охране труда ЧМ 2018 по футболу: волонтёры
ЧМ 2018 по футболу: волонтёры Презентация на тему "Анализ работы методического объединения учителей специальных (коррекционных) классов VII вида" - скачать
Презентация на тему "Анализ работы методического объединения учителей специальных (коррекционных) классов VII вида" - скачать  Проект ЦС СТС на базе SI 2000 V.5
Проект ЦС СТС на базе SI 2000 V.5 Теорема Гаусса 2
Теорема Гаусса 2 Научное и художественное познание Пифагора. Пифагоризм. Выполнила: Шаврина Екатерина, ученица 8б кл. МАОУ№15 г. Челябинска. Научный
Научное и художественное познание Пифагора. Пифагоризм. Выполнила: Шаврина Екатерина, ученица 8б кл. МАОУ№15 г. Челябинска. Научный  Качество - это образ жизни. Качество продукции компании APPLE
Качество - это образ жизни. Качество продукции компании APPLE Христианство. Православие. Часть III. Алтарь
Христианство. Православие. Часть III. Алтарь Politikas jēdziens. Ko pēta politikas zinātne
Politikas jēdziens. Ko pēta politikas zinātne Организационная культура
Организационная культура Проблемы и перспективы измерения эффективности маркетинга в Украине
Проблемы и перспективы измерения эффективности маркетинга в Украине Футбол – це не просто гра
Футбол – це не просто гра Святая Матрона Московская
Святая Матрона Московская Противопожарная сигнализация
Противопожарная сигнализация Бур лун
Бур лун Использование систем «Велокс» и «Факро» в малоэтажном строительстве
Использование систем «Велокс» и «Факро» в малоэтажном строительстве Разработка маркетинговых решений по ценам
Разработка маркетинговых решений по ценам Valentine`s Day
Valentine`s Day  Корпоративная этика
Корпоративная этика Праздник весны – масленица
Праздник весны – масленица Презентация игра Россия
Презентация игра Россия Аналитическая работа по предприятию «Книжный магазин»
Аналитическая работа по предприятию «Книжный магазин» ортогональный оператор
ортогональный оператор Понятие и виды недействительных сделок Подготовили студенты 2 курса группы Юб03/1303 Ершов Вадим и Моргун Анастасия
Понятие и виды недействительных сделок Подготовили студенты 2 курса группы Юб03/1303 Ершов Вадим и Моргун Анастасия  Занятия бадминтоном
Занятия бадминтоном Фотоальбом
Фотоальбом Общие сведения о зубчатых передачах
Общие сведения о зубчатых передачах Easter egg hunt
Easter egg hunt