Содержание
- 2. Классификация антибиотиков По клеточной мишени Ингибиторы биосинтеза Клеточной стенки Ингибиторы биосинтеза Белка Ингибиторы метаболизма (синтез дНТФ)
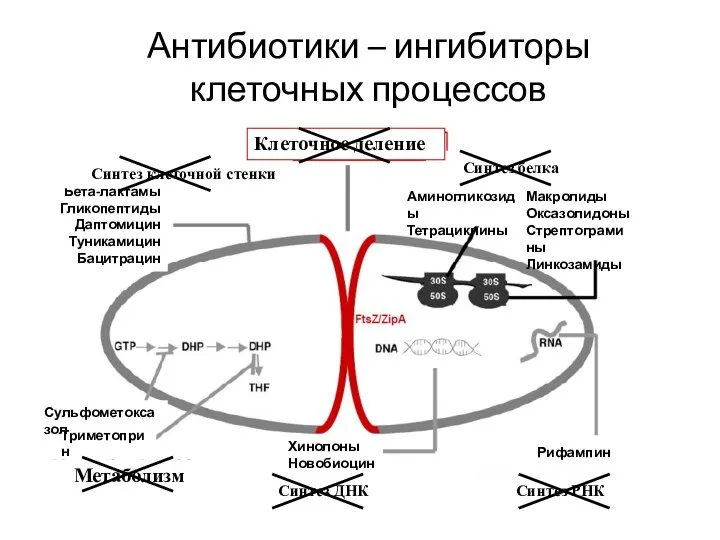
- 3. Антибиотики – ингибиторы клеточных процессов
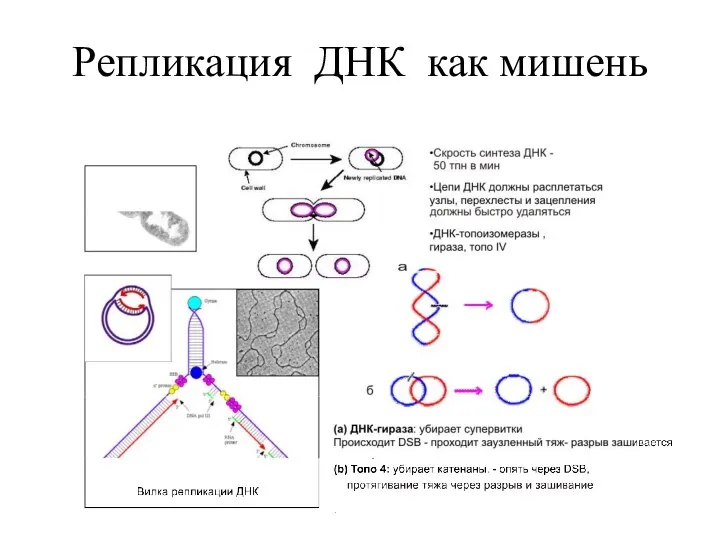
- 4. Репликация ДНК как мишень
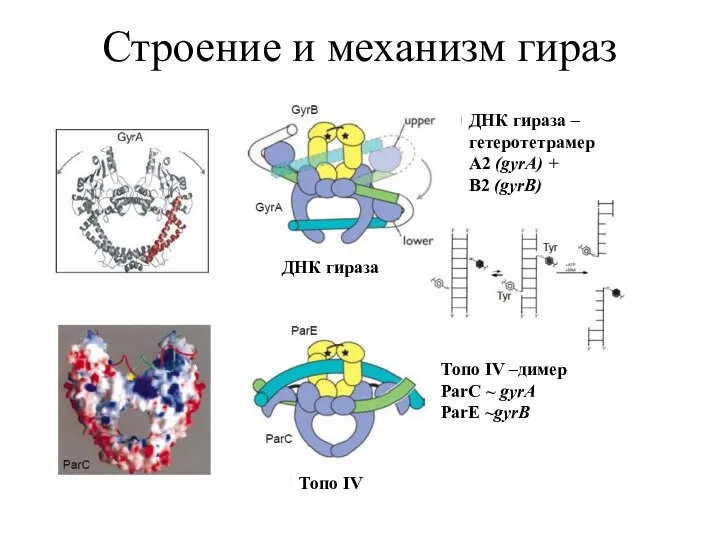
- 5. Строение и механизм гираз ДНК гираза Топо IV ДНК гираза – гетеротетрамер A2 (gyrA) + B2
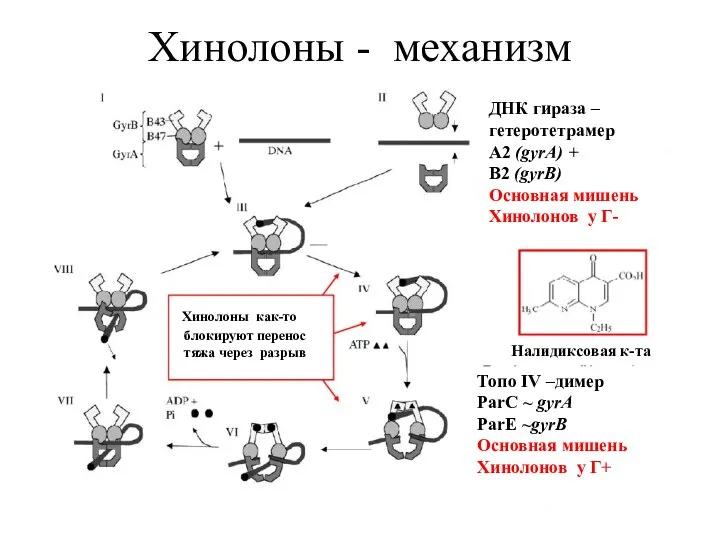
- 6. Хинолоны - механизм
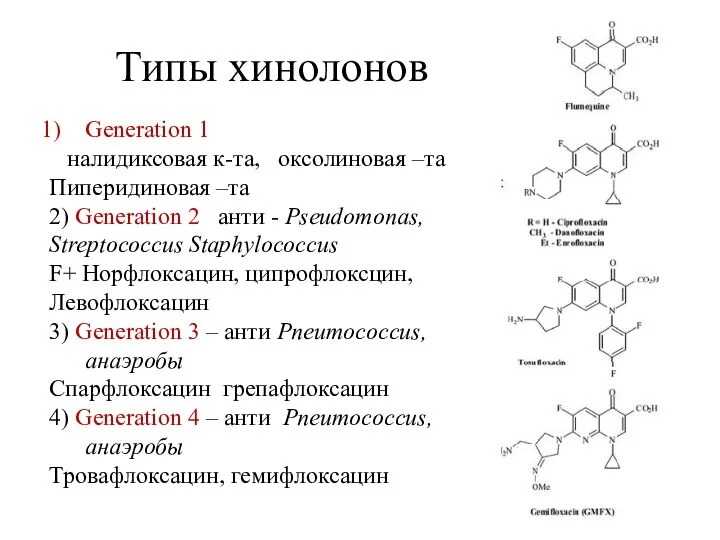
- 7. Типы хинолонов Generation 1 налидиксовая к-та, оксолиновая –та Пиперидиновая –та 2) Generation 2 анти - Pseudomonas,
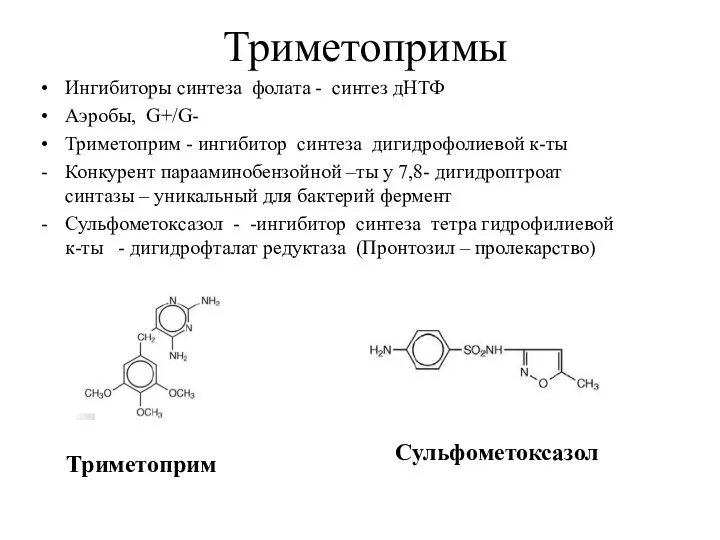
- 8. Триметопримы Ингибиторы синтеза фолата - синтез дНТФ Аэробы, G+/G- Триметоприм - ингибитор синтеза дигидрофолиевой к-ты Конкурент
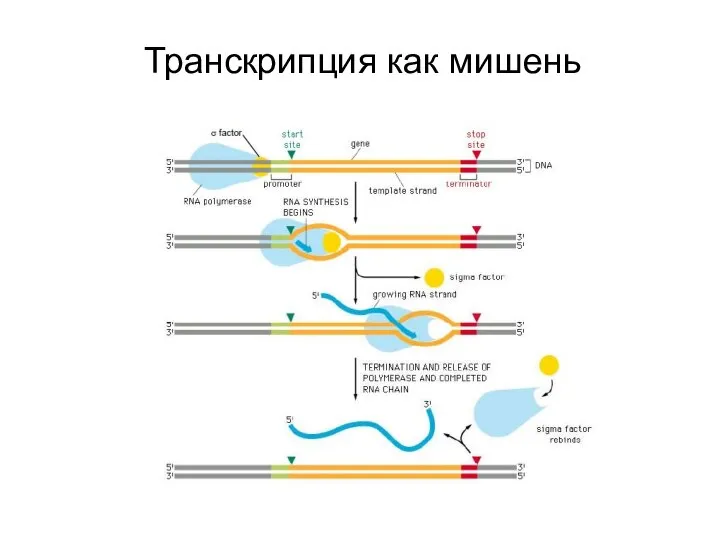
- 9. Транскрипция как мишень
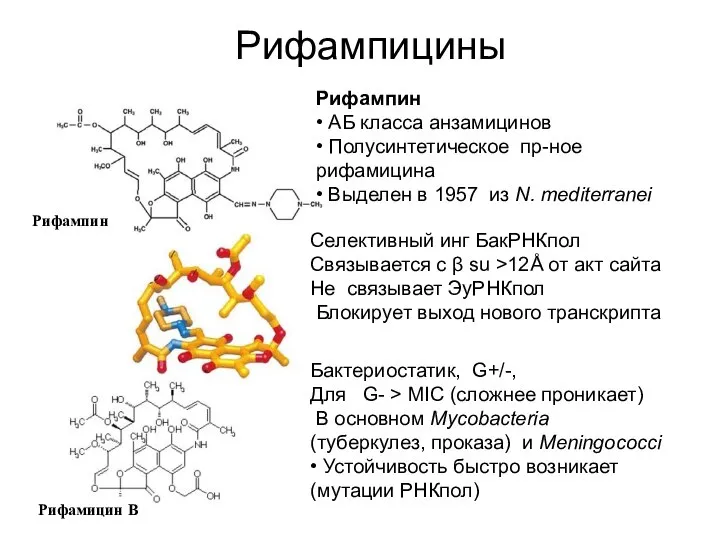
- 10. Рифампицины
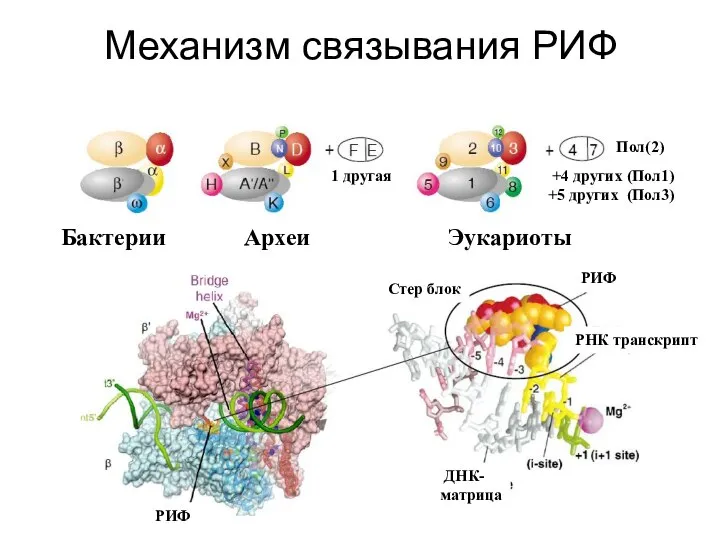
- 11. Механизм связывания РИФ
- 12. Рибосома как мишень Рибосома – сложно-организованная молекулярная машитна Существует множество способов нарушения функций трансляции Наиболее распространенная
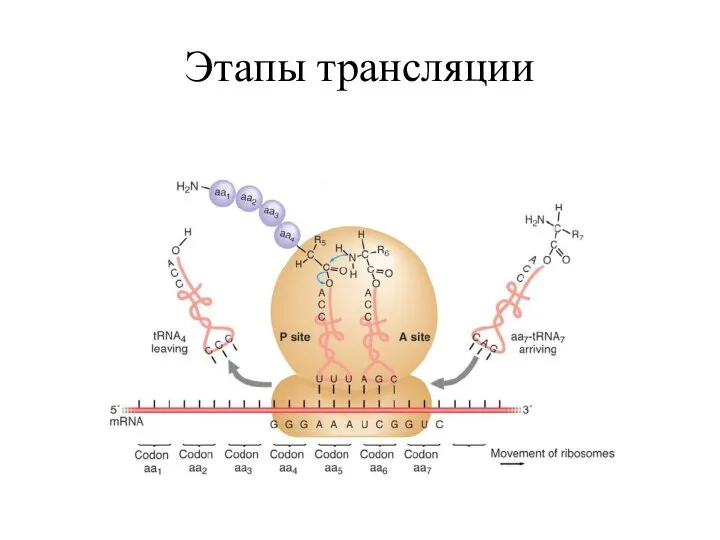
- 13. Этапы трансляции
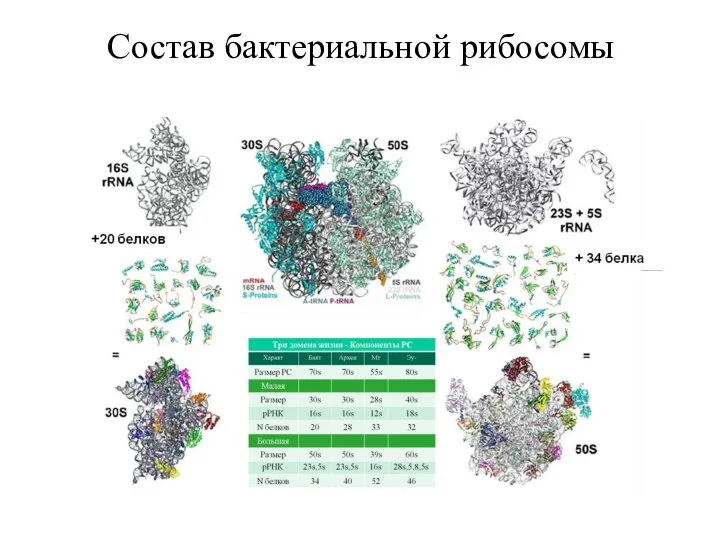
- 14. Состав бактериальной рибосомы
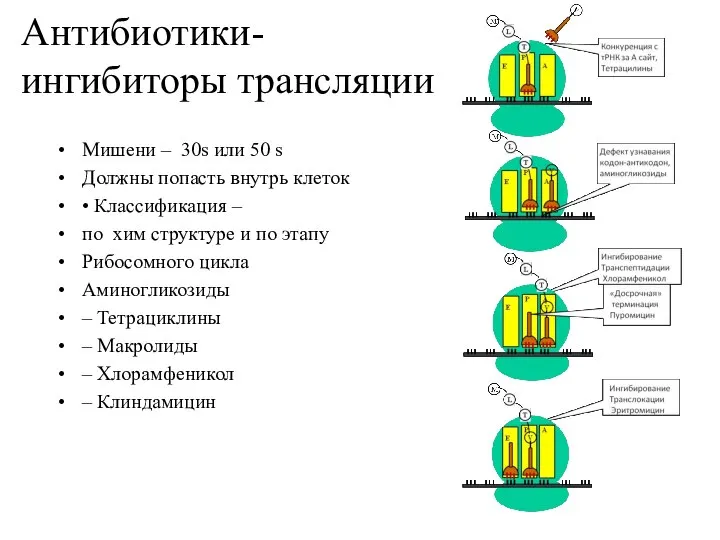
- 15. Антибиотики- ингибиторы трансляции Мишени – 30s или 50 s Должны попасть внутрь клеток • Классификация –
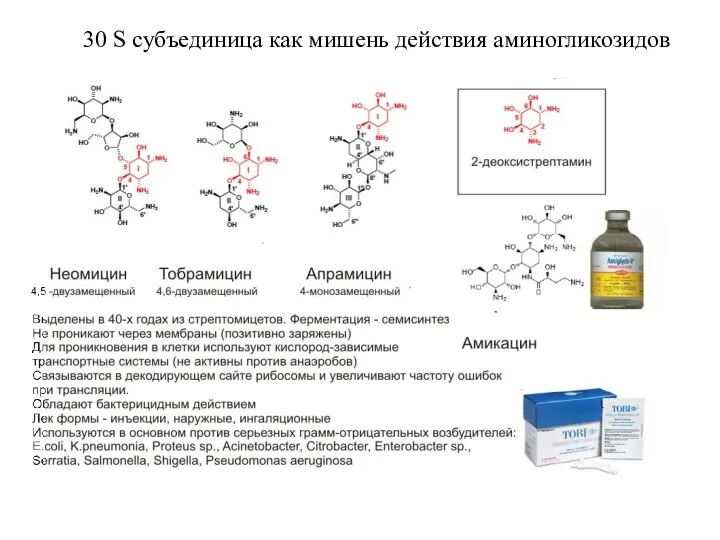
- 16. 3л S субъединица как мишень действия аминогликозидов 30 S субъединица как мишень действия аминогликозидов
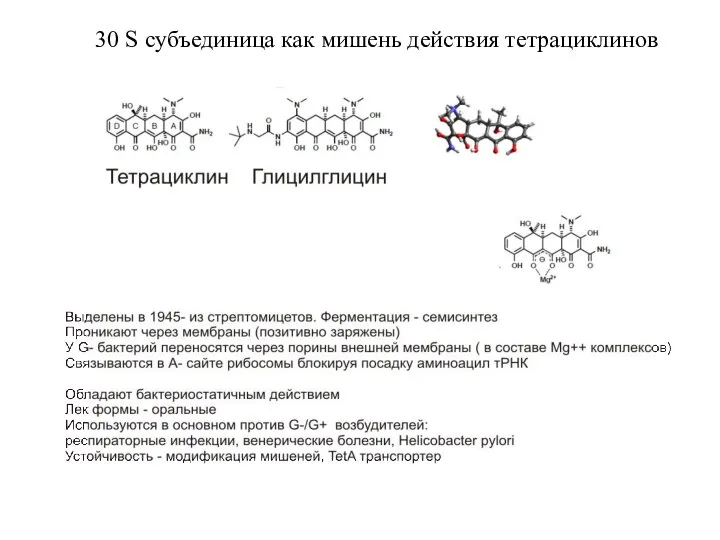
- 17. 30 S субъединица как мишень действия тетрациклинов
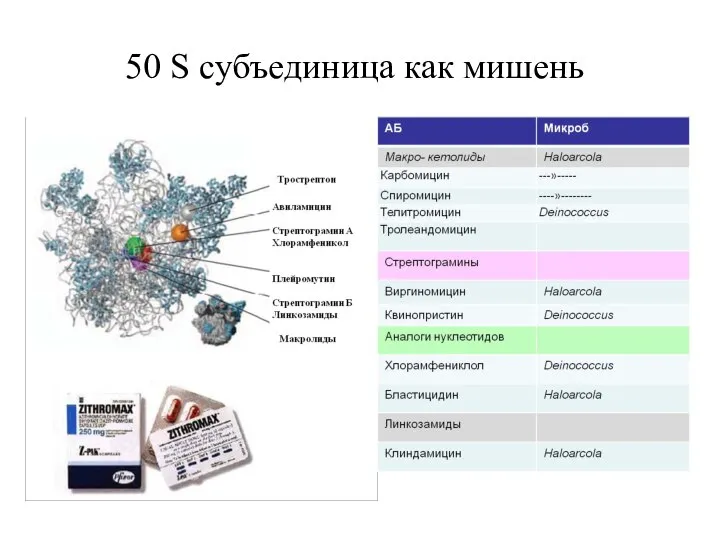
- 18. 50 S субъединица как мишень
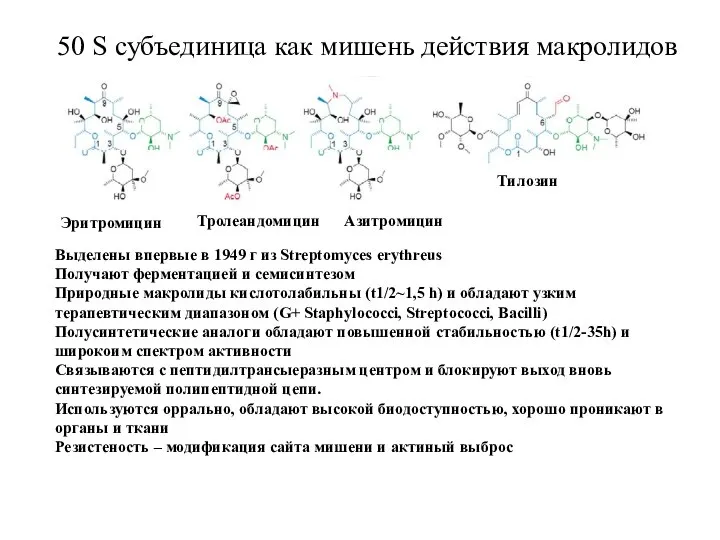
- 19. 50 S субъединица как мишень действия макролидов Эритромицин Тролеандомицин Азитромицин Тилозин Выделены впервые в 1949 г
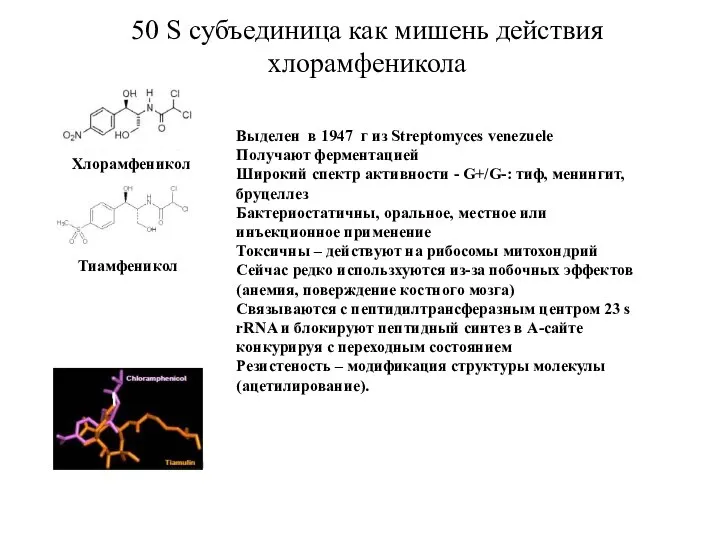
- 20. Тиамфеникол Хлорамфеникол Выделен в 1947 г из Streptomyces venezuele Получают ферментацией Широкий спектр активности - G+/G-:
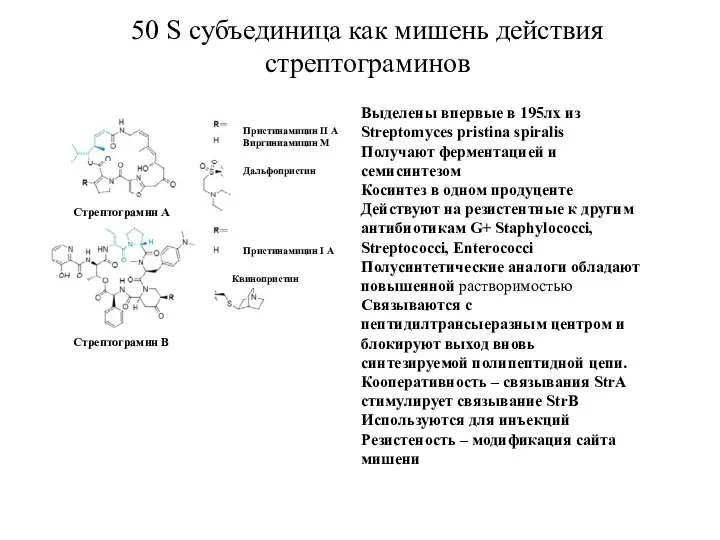
- 21. Выделены впервые в 195лх из Streptomyces pristina spiralis Получают ферментацией и семисинтезом Косинтез в одном продуценте
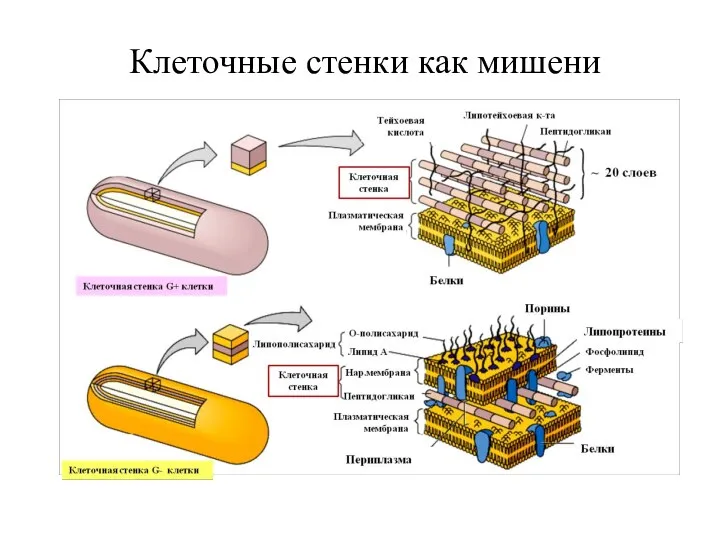
- 22. Клеточные стенки как мишени
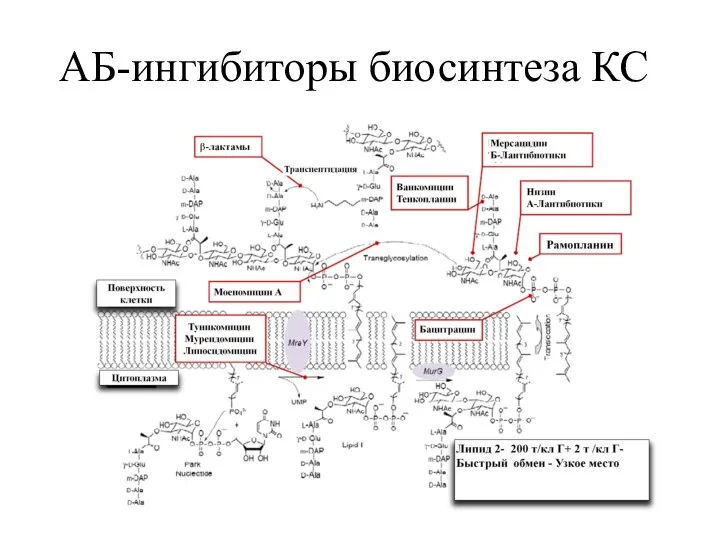
- 23. АБ-ингибиторы биосинтеза КС
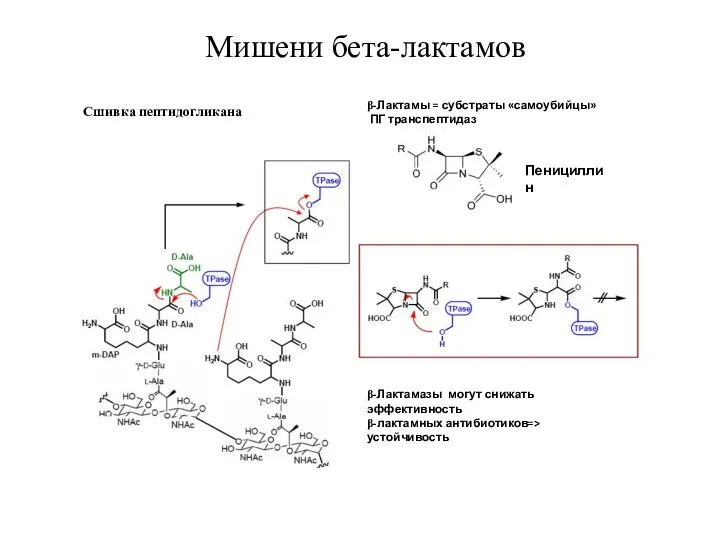
- 24. Мишени бета-лактамов
- 25. Ингибиторы КС- механизм 1 (литический) КС бактерий – ковалентно-сшитый полимерный матрикс пептидогликана Механическая прочность, устойчивость к
- 26. Ингибиторы КС- механизм 2 (нелитический) Двукомпонентные системы – регуляция активности автолизина PBP1 ингибиторы – филаментация клеток,
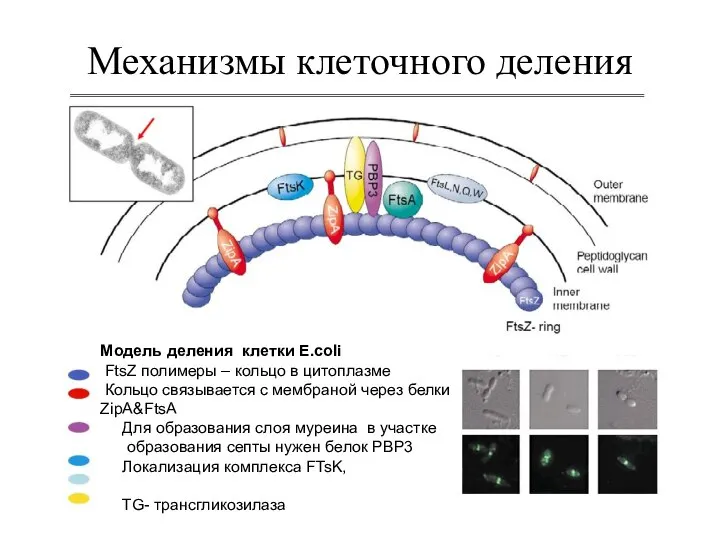
- 27. Механизмы клеточного деления
- 28. Нерибоcомные катионные пептиды Внедряются в бактериальную мембрану пермеабилизация Местного действия – токсичные побочные эффекты - G+,
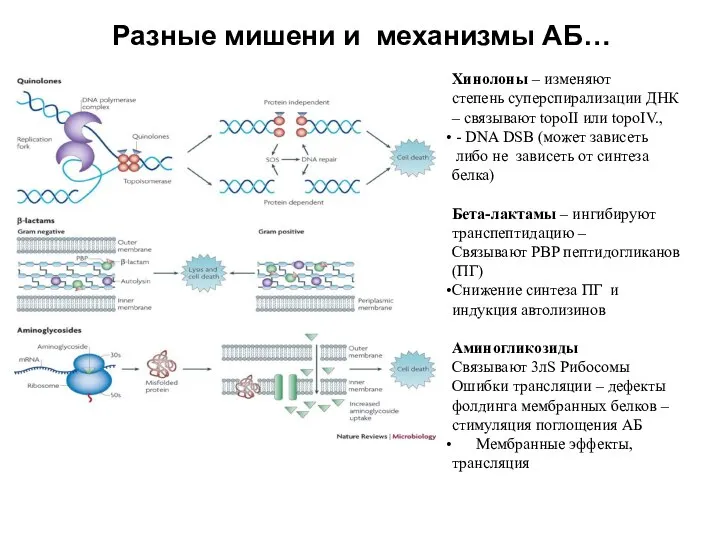
- 29. Разные мишени и механизмы АБ… Хинолоны – изменяют cтепень суперспирализации ДНК – связывают topoII или topoIV.,
- 30. Общий механизм АБ-индуцированной смерти клеток Обработка бактерицидными антибиотиками в летальных концентрациях приводит к образованию вредоносных гидрокил-радикалов
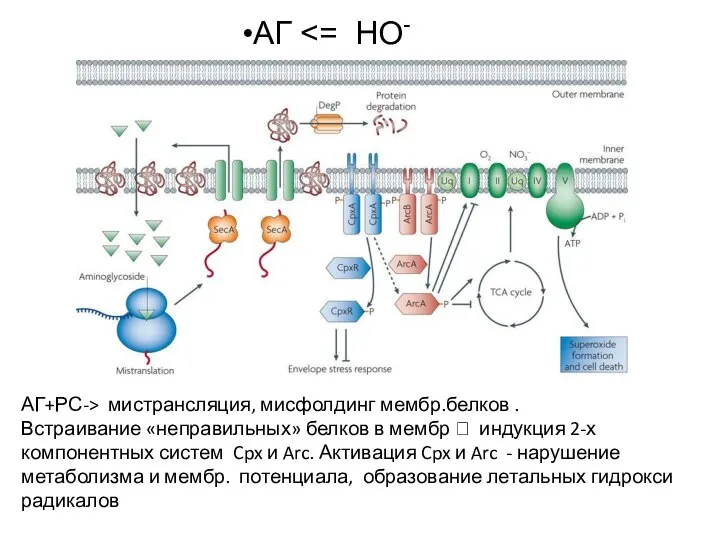
- 31. АГ АГ+РС-> мистрансляция, мисфолдинг мембр.белков . Встраивание «неправильных» белков в мембр ? индукция 2-х компонентных систем
- 33. Скачать презентацию






 Задачи педагогического коллектива по повышению эффективности здоровьесбережения школьников и безопасных условий обучения
Задачи педагогического коллектива по повышению эффективности здоровьесбережения школьников и безопасных условий обучения Основы проектирования и оснащения производства
Основы проектирования и оснащения производства О чем рассказывает герб
О чем рассказывает герб Главная площадь города
Главная площадь города Урок по предпринимательству
Урок по предпринимательству  Правописание окончаний имен существительных в родительном, дательном, предложном падежах (сопоставление) - презентация для началь
Правописание окончаний имен существительных в родительном, дательном, предложном падежах (сопоставление) - презентация для началь Задумался как-то раз Билл Гейтс об увеличении посещаемости своего сайта нужной целевой аудиторией Задумался как-то раз Билл Г
Задумался как-то раз Билл Гейтс об увеличении посещаемости своего сайта нужной целевой аудиторией Задумался как-то раз Билл Г Таргетированные SMS рассылки i-dgtl.ru
Таргетированные SMS рассылки i-dgtl.ru Русское деревянное культовое зодчество
Русское деревянное культовое зодчество СИГНАЛЫ БЕДСТВИЯ ПЕРЕДАВАЕМЫЕ ЖЕСТАМИ Урок 8-10 класс Выполнил: Урманов М.Ю. преподаватель-организатор ОБЖ МБОУ лицея №1 2012 год
СИГНАЛЫ БЕДСТВИЯ ПЕРЕДАВАЕМЫЕ ЖЕСТАМИ Урок 8-10 класс Выполнил: Урманов М.Ю. преподаватель-организатор ОБЖ МБОУ лицея №1 2012 год Презентация "Роль денег в экономике" - скачать презентации по Экономике
Презентация "Роль денег в экономике" - скачать презентации по Экономике Коммерческое предложение для АО «Калининградский янтарный комбинат»
Коммерческое предложение для АО «Калининградский янтарный комбинат» Презентация на тему "Анализ анкетирования родителей по вопросам взаимодействия со школой" - скачать презентации по Педагогик
Презентация на тему "Анализ анкетирования родителей по вопросам взаимодействия со школой" - скачать презентации по Педагогик Лекция №2 ЭНДОДОНТИЧЕСКИЙ ИНСТРУМЕНТАРИЙ
Лекция №2 ЭНДОДОНТИЧЕСКИЙ ИНСТРУМЕНТАРИЙ 2. Java Spring Core 2. Maven
2. Java Spring Core 2. Maven Двумерный массив
Двумерный массив Лечка. Семиотика и синдромология болезней крови. Анемии.ppt
Лечка. Семиотика и синдромология болезней крови. Анемии.ppt Формирование таможенного права Выполнил студент первого курса ФТД Бобырь Алексей
Формирование таможенного права Выполнил студент первого курса ФТД Бобырь Алексей Новая жизнь старых вещей
Новая жизнь старых вещей Выполнил: ФИО ФИО ФИО
Выполнил: ФИО ФИО ФИО Нарушения регионарного кровообращения
Нарушения регионарного кровообращения Иммобилайзер Smartra 3. KIA Motors
Иммобилайзер Smartra 3. KIA Motors Функции, состав крови
Функции, состав крови  Тәуелсіз қазақсатнның бибітшілікпен жасампаздылық жолындағы 25 жыл өркедеу дәуірі және ұл көшбасшысы - Н.Ә.Назарбаев
Тәуелсіз қазақсатнның бибітшілікпен жасампаздылық жолындағы 25 жыл өркедеу дәуірі және ұл көшбасшысы - Н.Ә.Назарбаев Финансы, Папа Галактика Россия
Финансы, Папа Галактика Россия МУЗЫКА в КИНО
МУЗЫКА в КИНО Основные направления государственной политики в области противодействия коррупции в РФ на современном этапе
Основные направления государственной политики в области противодействия коррупции в РФ на современном этапе Ventilator auxiliar
Ventilator auxiliar