Содержание
- 2. Патофизиология злокачественных опухолей I-II
- 3. Опухоль (tumor – лат, новообразование, neoplasma – греч., бластома – blastoma – лат.) – есть избыточное
- 4. ТЕРМИНОЛОГИЯ Blastoma - (гр. blastos - зародыш, oma - опухоль). Oncos - (гр. опухоль). Cancer -
- 5. Условия, способствующие росту злокачественных заболеваний (медико-социальные условия) Улучшение диагностики. Более тщательный учет онкологических больных – диспансеризация,
- 6. «Неопластические ростки на разных стадиях формирования присутствуют в любом организме: в молодом – в меньшем числе
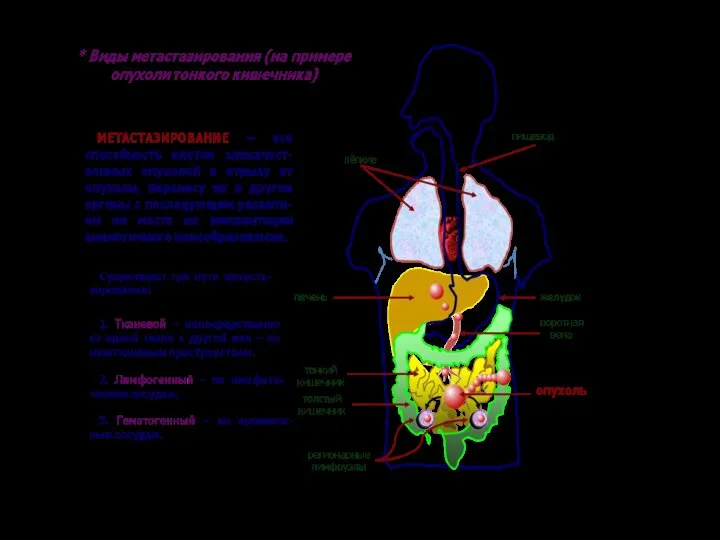
- 7. Неопластические процессы распространенны убиквитарно (ubigue – лат. везде, повсюду)
- 8. ЭКСПЕРИМЕНТАЛЬНЫЕ МЕТОДЫ ВОСПРОИЗВЕДЕНИЯ ЗЛОКАЧЕСТВЕННОГО РОСТА 1. Метод индукции (лат. inductio – наведение, побуждение): индукция опухоли химическими
- 9. 2. Метод эксплантации (лат. еx вне + plantare – сажать) – выращивать злокачественных клеток вне организма,
- 10. БИОЛОГИЧЕСКИЕ ОСОБЕННОСТИ ЗЛОКАЧЕСТВЕННЫХ НОВООБРАЗОВАНИЙ 1. Относительная автономность и нерегулируемость роста опухоли организмом. 2. Снижение уровня дифференцировки
- 11. биохимическую анаплазию; тканевую и клеточную анаплазию; физико-химическую анаплазию; функциональную анаплазию; иммунологическую анаплазию. 3. Наследуемость изменений. 4.
- 12. Относительная автономность и нерегулируемость роста опухоли организмом Это строго обязательный, универсальный признак, любой злокачественной опухоли. Означает
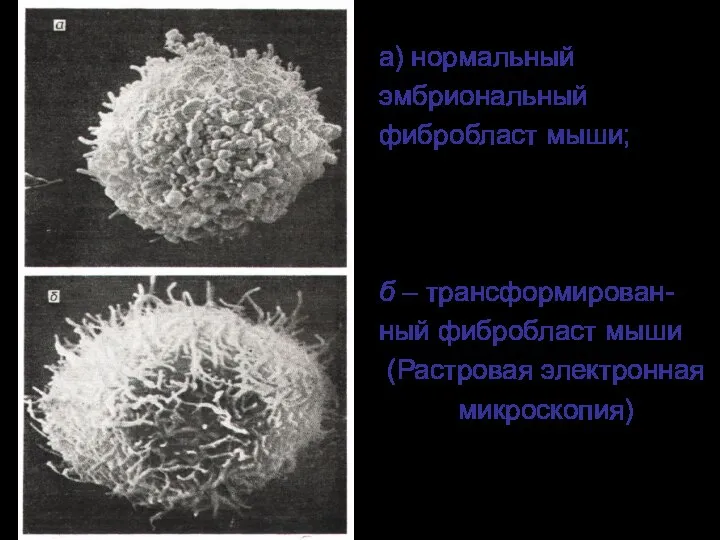
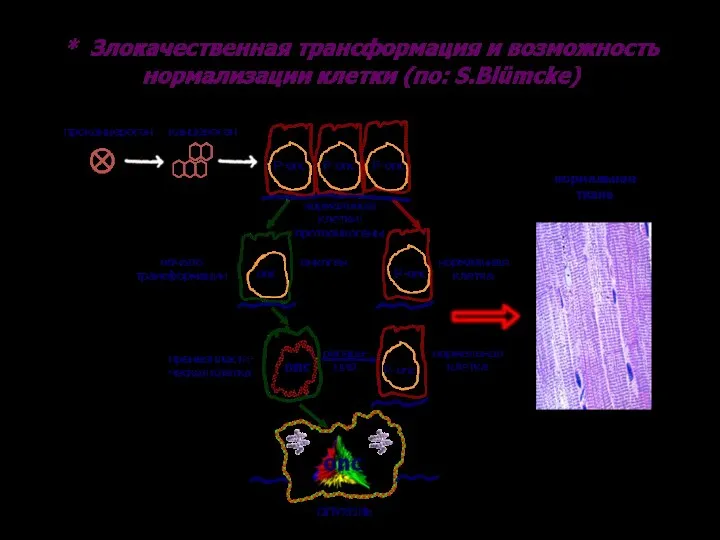
- 13. а) нормальный эмбриональный фибробласт мыши; б – трансформирован- ный фибробласт мыши (Растровая электронная микроскопия)
- 14. Варианты биохимической (метаболической анаплазии) Монотонизация или изоферментное упрощение Биохимическое усложнение Изоэнзимная перестройка
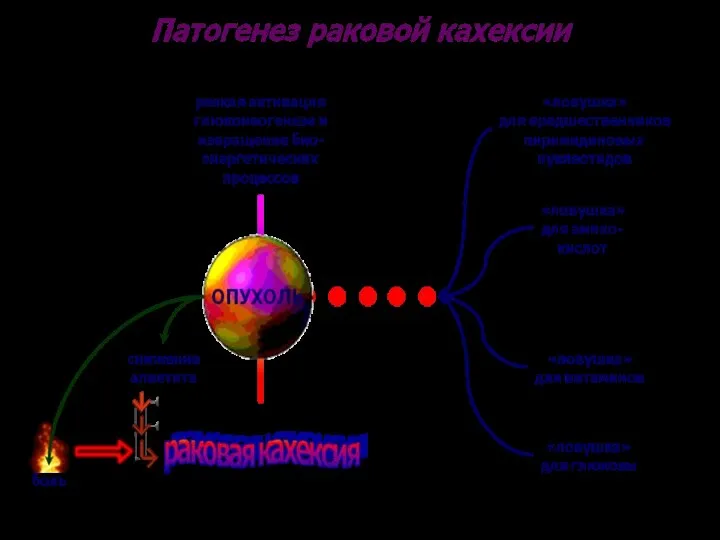
- 15. Характеристика обмена веществ в злокачественной клетке Белковый обмен: интенсивно извлекаются из притекающей крови аминокислоты («ловушка для
- 16. Характеристика обмена веществ в злокачественной клетке 2. Углеводный обмен: интенсивно извлекается глюкоза из притекающей крови («ловушка
- 17. Характеристика обмена веществ в злокачественной клетке 3. Жировой обмен: активно извлекаются из притекающей крови жирные кислоты,
- 18. «Каждая отдельная опухолевая клетка, в отношении к прочим частям тела живет, как бы, жизнью паразита» Р.
- 19. Метаболический атипизм злокачественных клеток в целом создает условия для существенного (значительного) повышения их «конкурентноспособности» и выживаемости
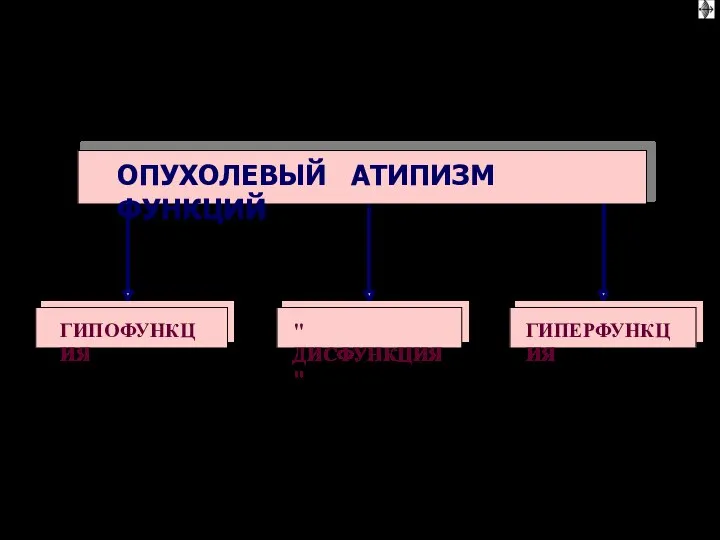
- 20. Функциональная анаплазия – утрата, извращение или чаще несоответствие, неподчинение функции опухолевых клеток регуляторным влияниям организма
- 21. ИММУНОЛОГИЧЕСКАЯ АНАПЛАЗИЯ ОПУХОЛЕВЫХ КЛЕТОК Антигенное упрощение – характеризуется уменьшением АГ в злокачественных клетках в сравнении с
- 22. Антигенная дивергенция (лат. divergere –обнаруживать расхождение) – характеризуется синтезом опухолевыми клетками таких АГ, которые не производились
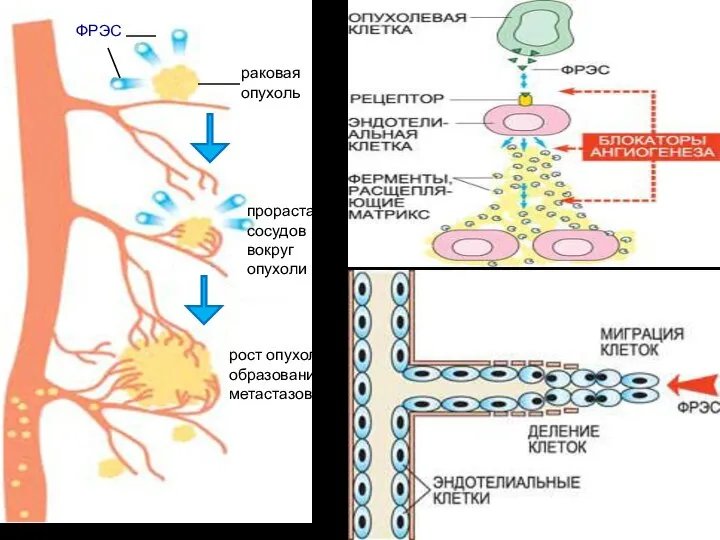
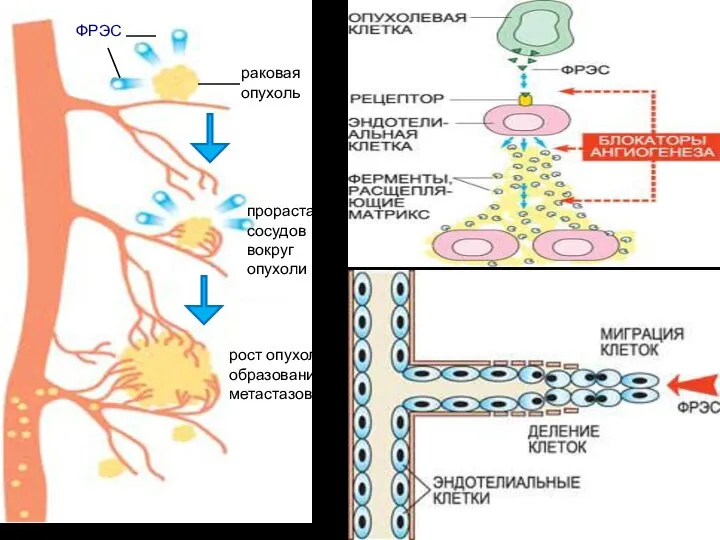
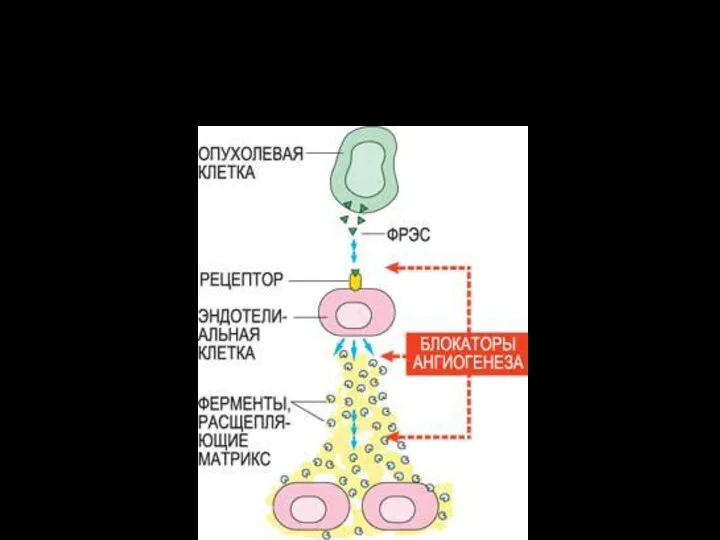
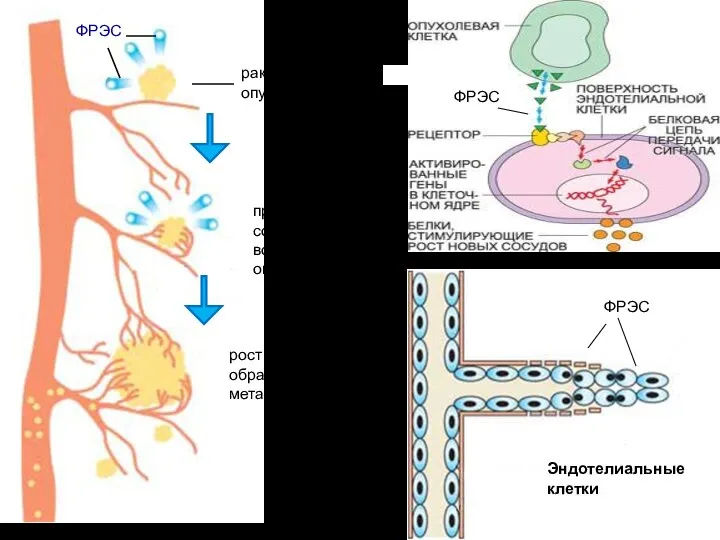
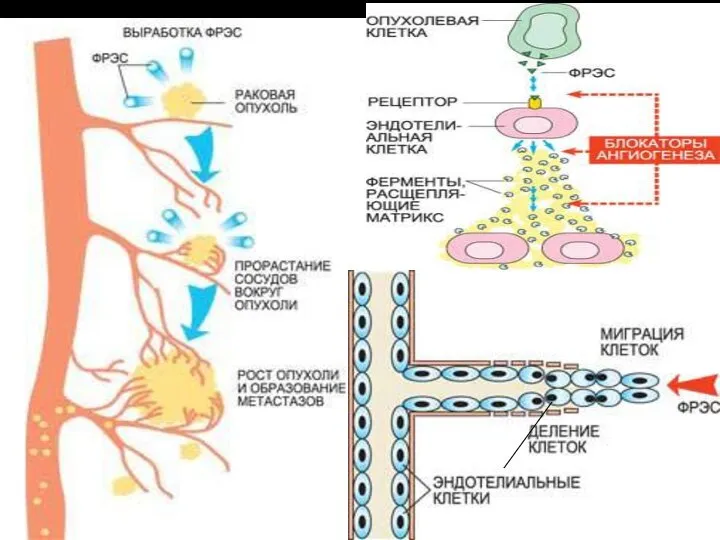
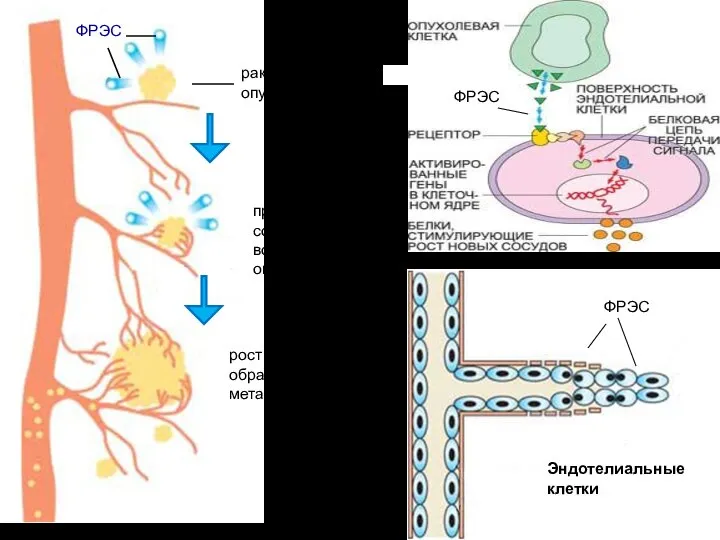
- 23. раковая опухоль ФРЭС прорастание сосудов вокруг опухоли рост опухоли и образование метастазов
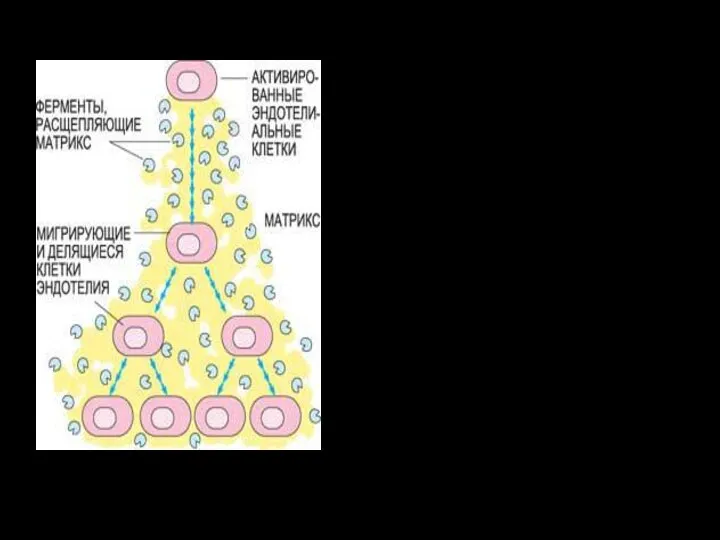
- 24. Активированные ФРЭС эндотелиальные клетки производят специальные ферменты – металлопротеиназы, расщепляющие матрикс оболочки сосуда, «сделанный» из белков
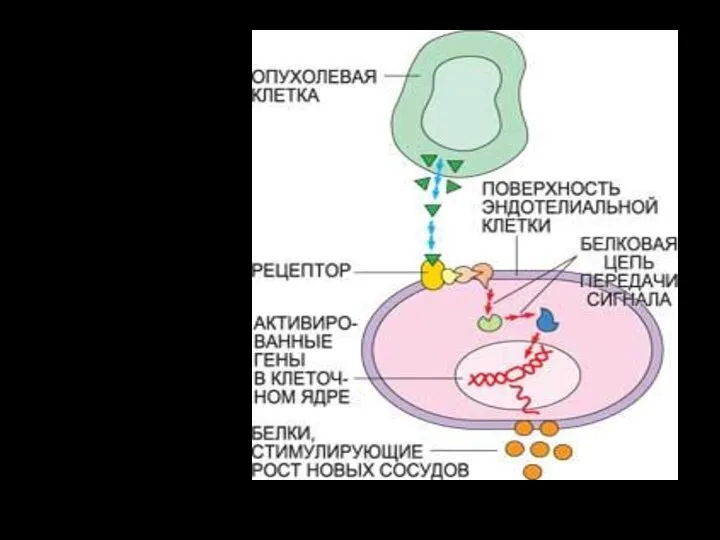
- 25. Фактор роста эндотелия сосудов (ФРЭС) синтезируется в растущей раковой опухоли. На поверхности эндотелиальных клеток, выстилающих кровеносные
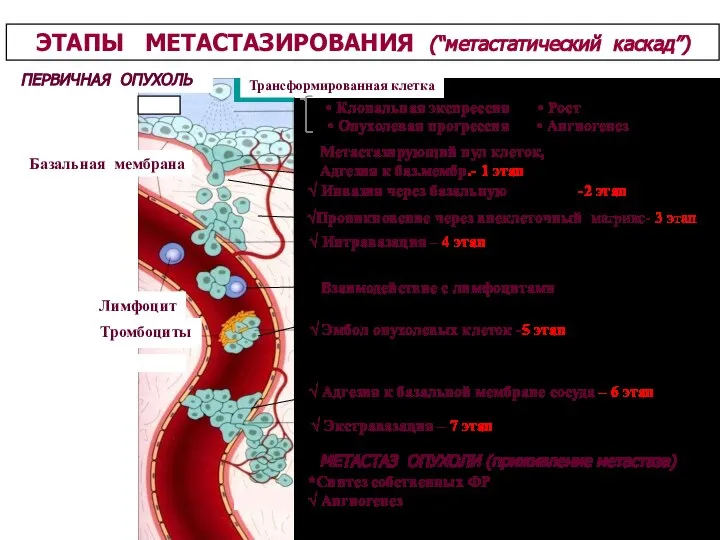
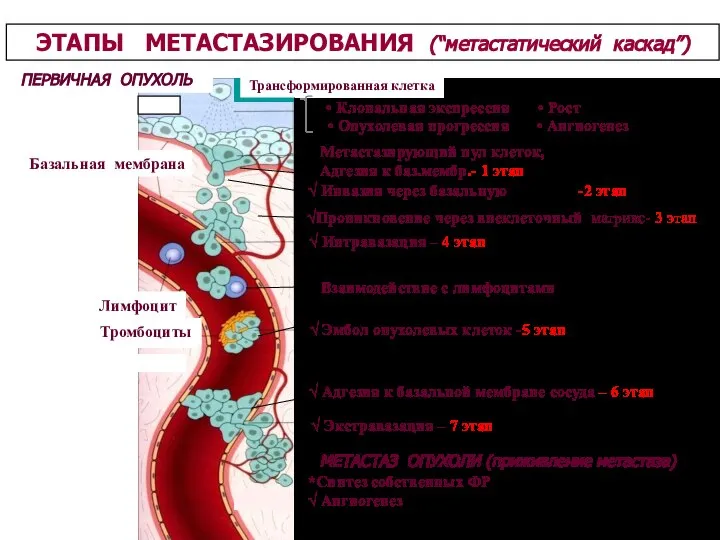
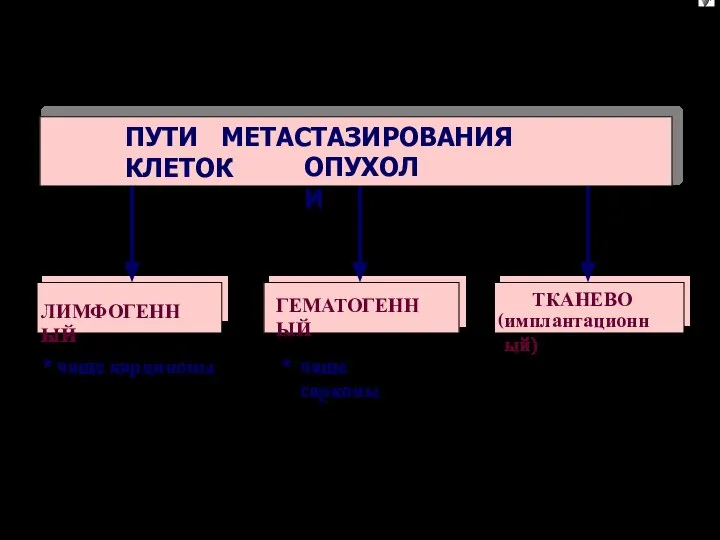
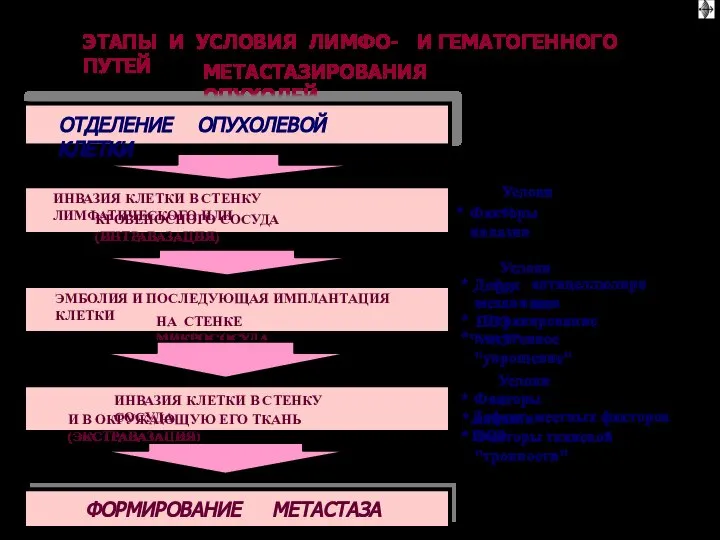
- 26. ПЕРВИЧНАЯ ОПУХОЛЬ Трансформированная клетка Базальная мембрана Лимфоцит Тромбоциты ЭТАПЫ МЕТАСТАЗИРОВАНИЯ (“метастатический каскад”) √ Интравазация – 4
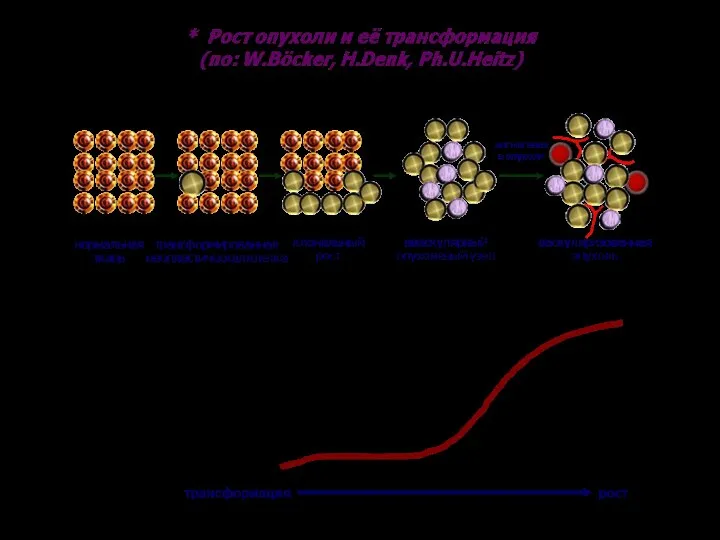
- 29. Опухолевая прогрессия – это генетически закрепленное, наследуемое и необратимо измененное свойство или несколько свойств опухолевой клетки
- 30. Общая характеристика опухолевой прогрессии Фенотипические ее проявления заключаются в изменении биохимических, морфологических, электрофизиологических и функциональных признаков
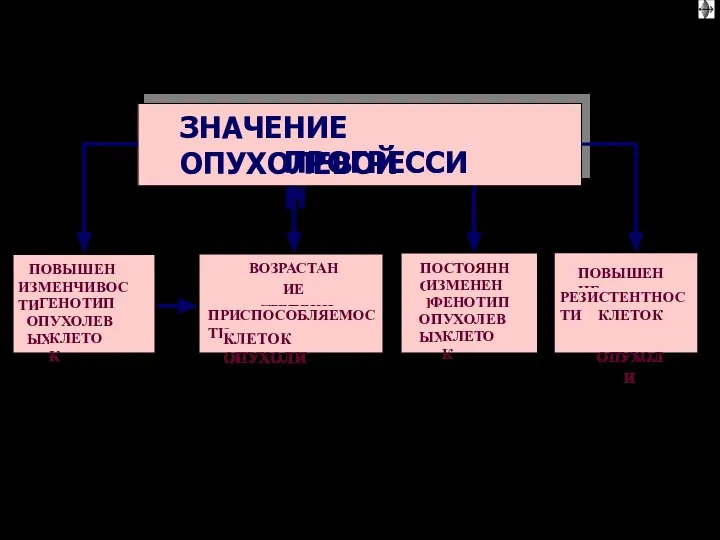
- 31. Значение опухолевой прогрессии Определяет гетерогенность опухолевой болезни Способствует адаптации злокачественных клеток к меняющимся условиям: - недостатку
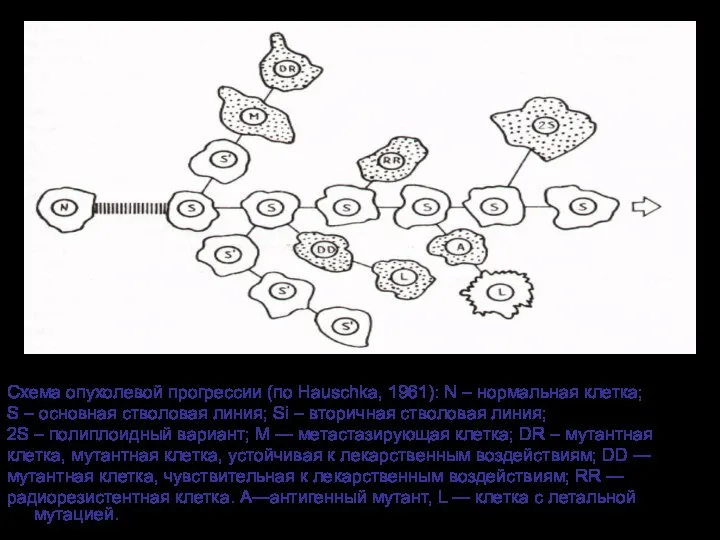
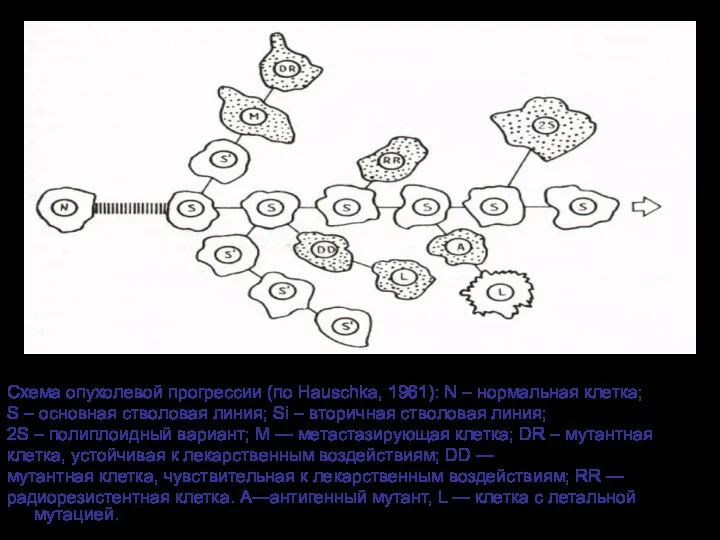
- 33. Схема опухолевой прогрессии (по Hauschka, 1961): N – нормальная клетка; S – основная стволовая линия; Si
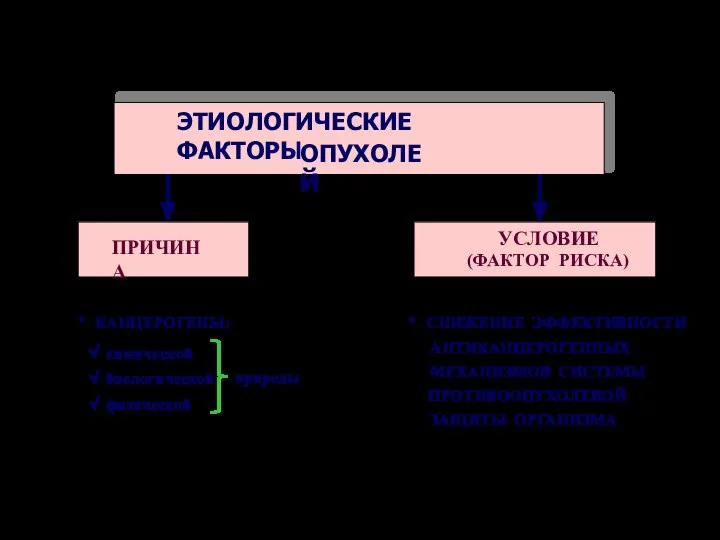
- 35. ЭТИОЛОГИЧЕСКИЕ ФАКТОРЫ ОПУХОЛЕЙ ПРИЧИНА УСЛОВИЕ (ФАКТОР РИСКА)
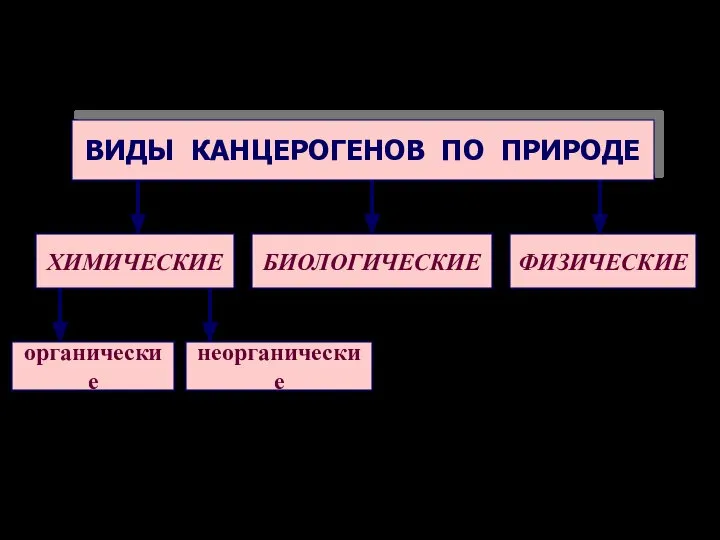
- 36. ВИДЫ КАНЦЕРОГЕНОВ ПО ПРИРОДЕ
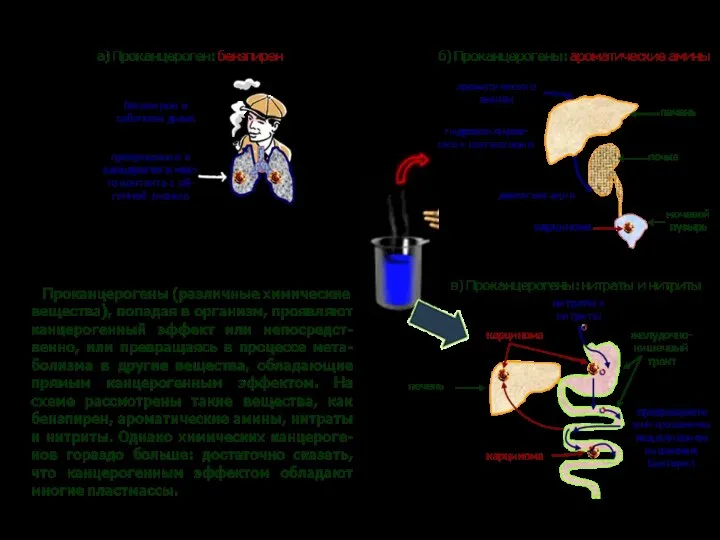
- 37. ТРАНСФОРМАЦИЯ И РЕАЛИЗАЦИЯ КАНЦЕРОГЕННОГО ДЕЙСТВИЯ ХИМИЧЕСКИХ ВЕЩЕСТВ трансформация в организме ∙ алкилирующие агенты ∙ эпоксиды, диолэпоксиды
- 39. Установлено: малигнизация клеток – процесс многостадийный (многошаговый), причем, каждый последующий «шаг» может быть спровоцирован разными факторами;
- 40. Канцерогены обладают следующими свойствами: 1.Мутагенностью, т.е. способностью прямо или косвенно влиять на геном клетки; 2. Проникать
- 41. продолжение 5. Дозированностью действия, что обеспечи- вает незначительные повреждения клетки. Для получения канцерогенного эффекта имеют значение
- 42. продолжение Представление о дозированности действия канцерогена позволило установить следующее: субпороговых доз канцерогена не существует (увеличивается лишь
- 43. продолжение 6. Синканцерогенностью – ускоренной бластной трансформацией клеток при воздействии нескольких канцерогенов; 7. Коканцерогенез, комутогенез –
- 44. Факторы риска (основные группы) Дурные привычки: табакокурение прием алкоголя диетические нарушения многочисленные, случайные половые связи (промискуйтет)
- 46. Основные положения патогенеза бластной трансформации клеток Опухолевая болезнь – полиэтиологическая, но монопатогенетическая патология; Наиболее общие механизмы
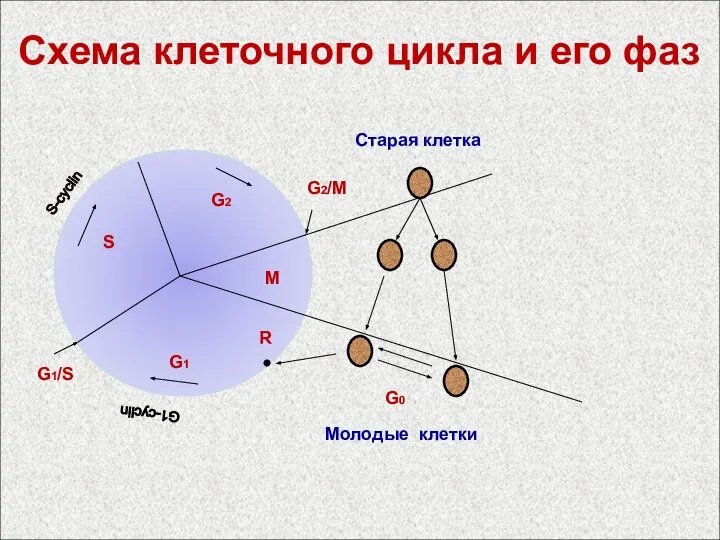
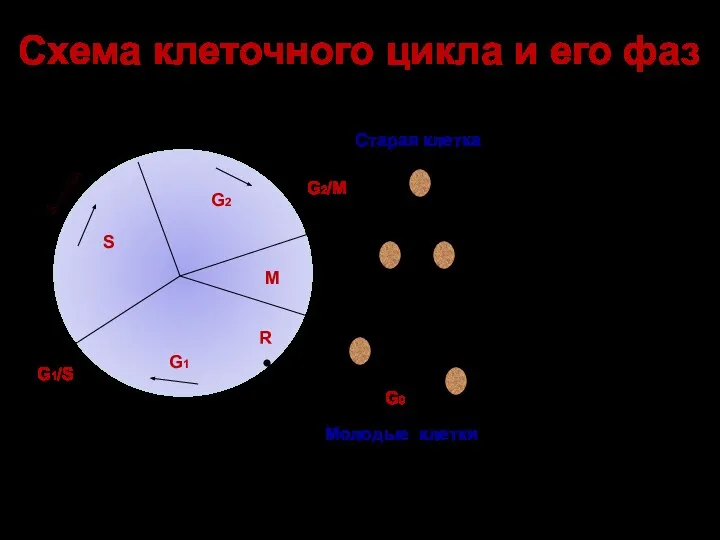
- 50. Схема клеточного цикла и его фаз G1 G2 S M G2-cyclin G1-cyclin S-cyclin G1/S G2/M R
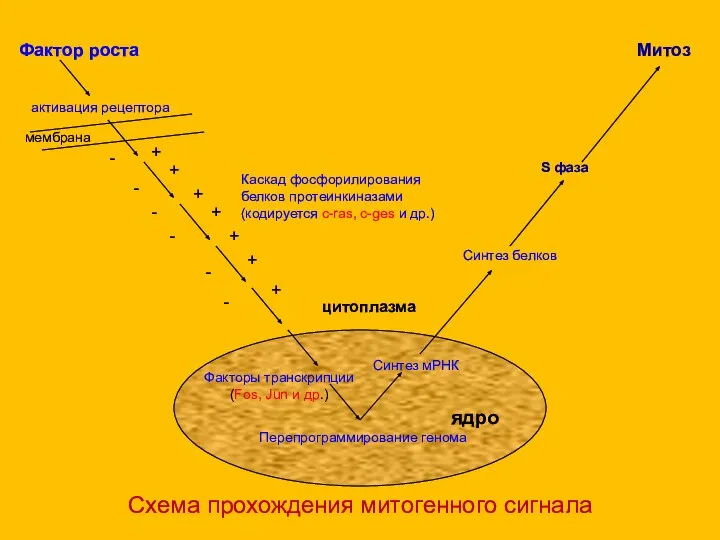
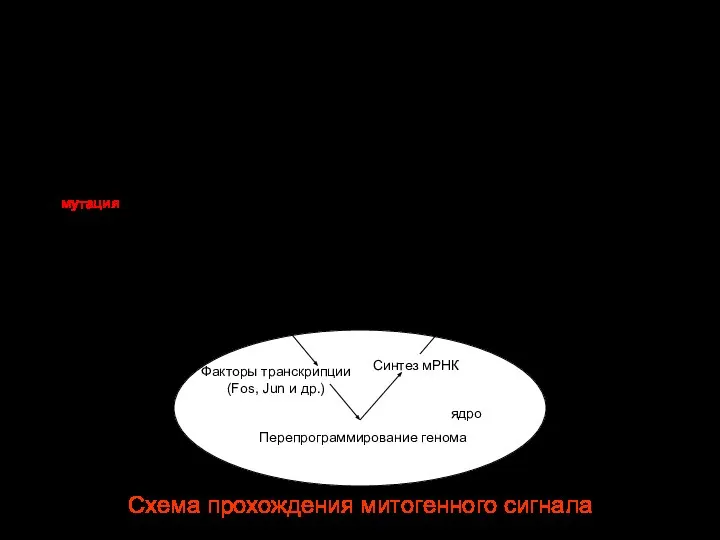
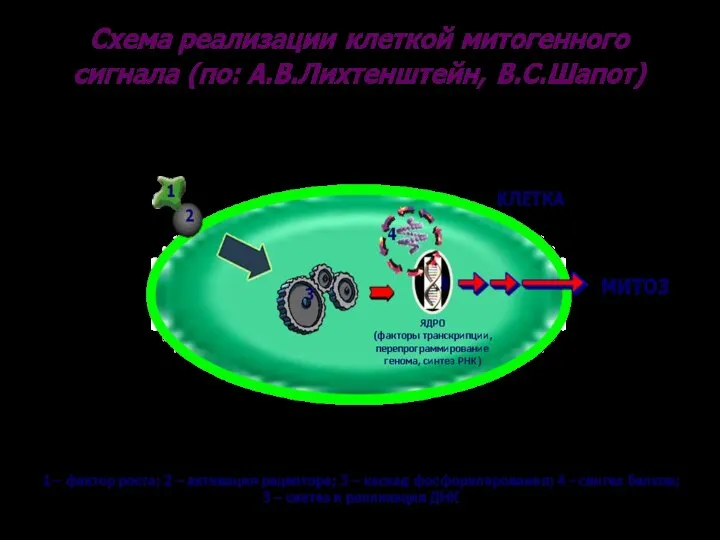
- 51. Схема прохождения митогенного сигнала Фактор роста Митоз Перепрограммирование генома ядро Синтез мРНК Синтез белков S фаза
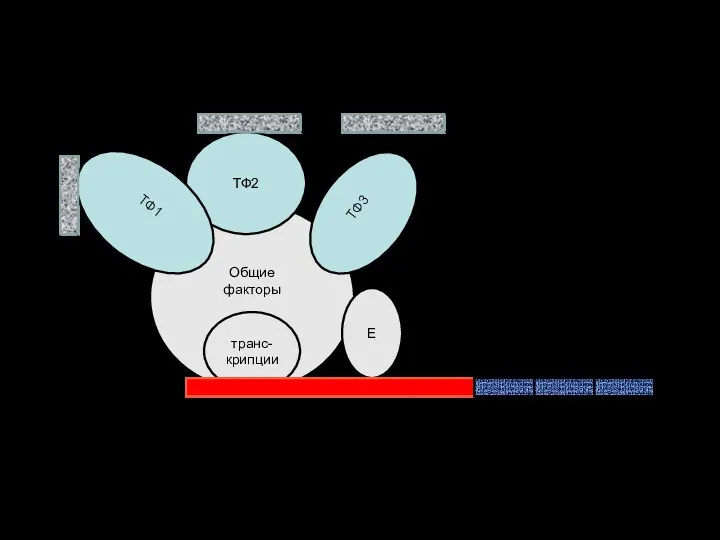
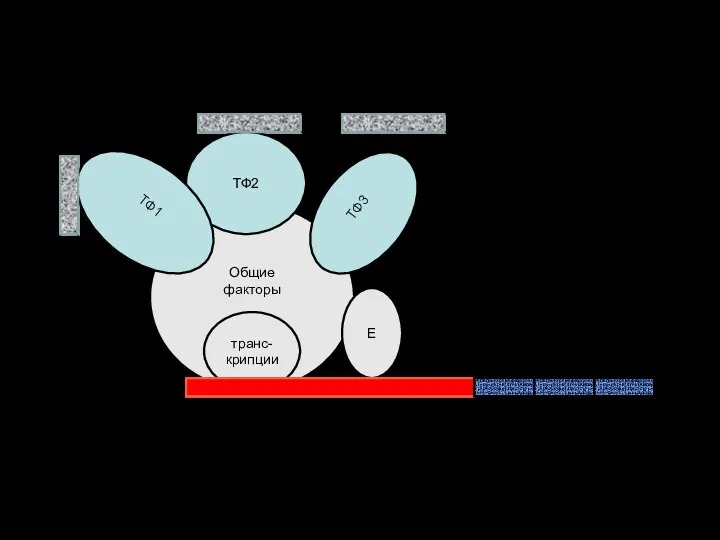
- 52. Функциональные отделы в ДНК эукариот Общие факторы транс-крипции Е ТФ3 ТФ2 ТФ1 ГЕНЫ (протоонкоген) ПРОМОТОР Энхансеры
- 53. Схема клеточного цикла и его фаз G1 G2 S M G2-cyclin G1-cyclin S-cyclin G1/S G2/M R
- 54. Основные группы генов, участвующие в поддержании клеточно-тканевого гомеостаза Гены, стимулирующие деление клеток – протоонкогены (гены роста
- 55. МЕХАНИЗМЫ ПЕРЕХОДА ПРОТООНКОГЕНА В ОНКОГЕН Дефект регуляции транскрипции (инсерция гетеротопного промотора) – включение (вставка) промотора. Промотор
- 56. Функциональные отделы в ДНК эукариот Общие факторы транс-крипции Е ТФ3 ТФ2 ТФ1 ГЕНЫ (протоонкоген) ПРОМОТОР Энхансеры
- 57. 3. Транслокация протоонкогена – перемещение протоонкогена в участок другой хромосомы с функционирующим геном (генами). В данной
- 58. Схема прохождения митогенного сигнала рецептор Митоз Перепрограммирование генома ядро Синтез мРНК Синтез белков S фаза цитоплазма
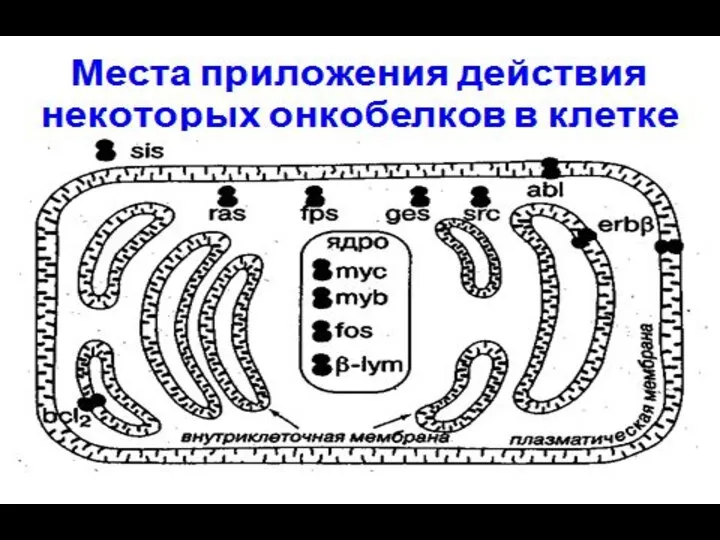
- 60. ПРОТООНКОГЕНЫ (1) Ростовые факторы (РФ) Sis (22) Аналог тромбоцитарного фактора роста Глиомы Аналог ФРФ Карциномы пищевода,
- 61. ПРОТООНКОГЕНЫ (2) Рецепторы РФ Int, hst Erd B (7) Her2/neu Гомолог рецептора ЭФР Карцинома молочной железы,
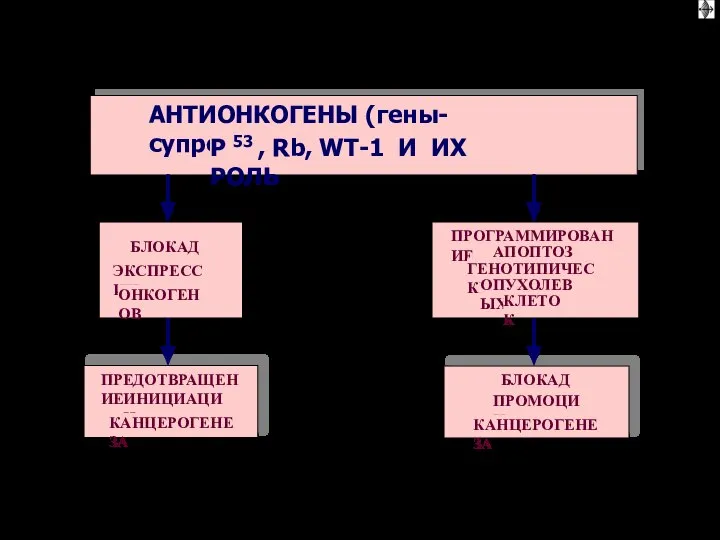
- 62. АНТИОНКОГЕНЫ (гены-супрессоры) P 53 , Rb, WT-1 И ИХ РОЛЬ БЛОКАДА ЭКСПРЕССИИ ОНКОГЕНОВ ПРЕДОТВРАЩЕНИЕ ИНИЦИАЦИИ КАНЦЕРОГЕНЕЗА
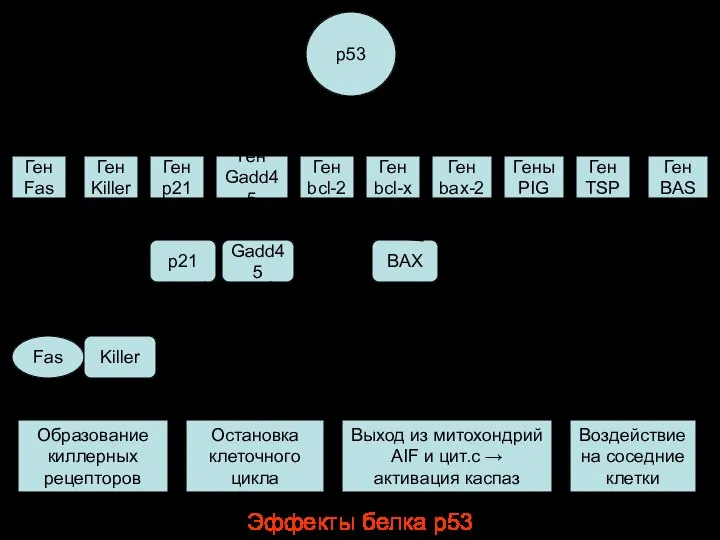
- 63. Эффекты белка р53 р53 Ген Fas Образование киллерных рецепторов Ген BAS Ген TSP Гены PIG Ген
- 64. НЕКОТОРЫЕ АНТИОНКОГЕНЫ (1) Прерыватели клеточного цикла Р53 (17р13) Индуктор апоптоза Многие (например, карцинома мочевого пузыря, легкого,
- 65. НЕКОТОРЫЕ АНТИОНКОГЕНЫ (2) ГТФ-азные активаторы и G-белки NF1 (17g11) Выключатель G-белков, антогонист ras Саркома, глиомы, MEN
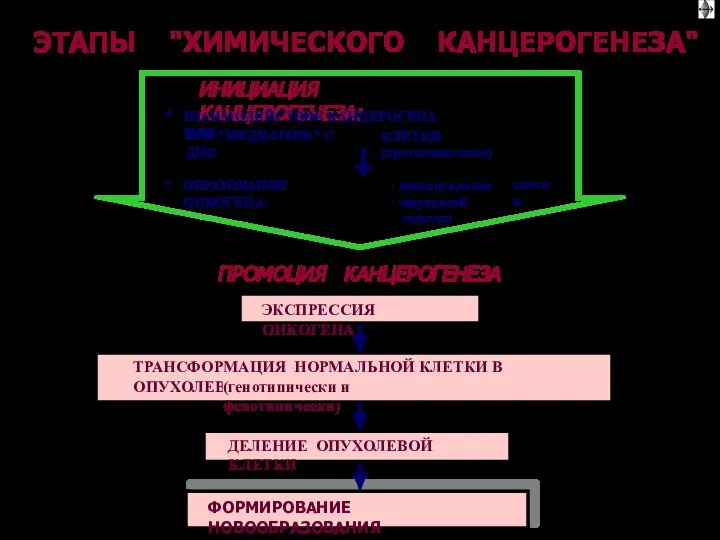
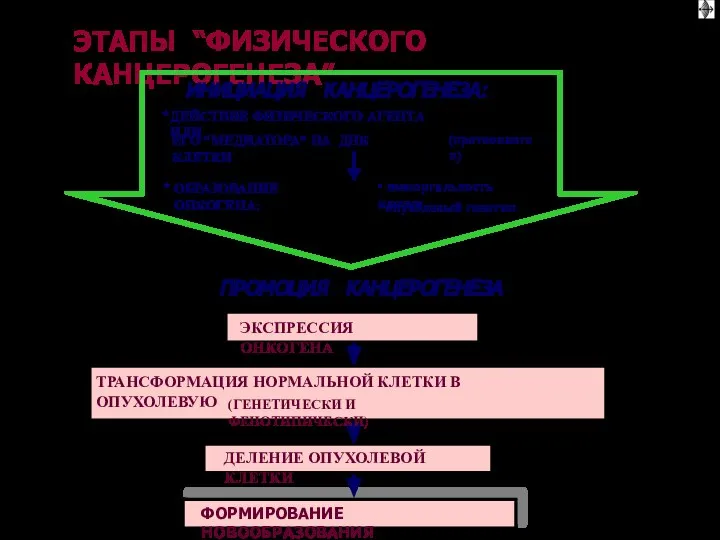
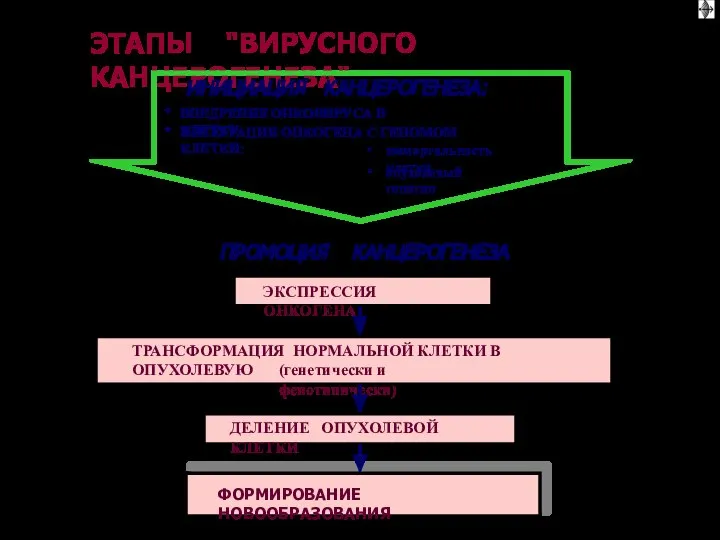
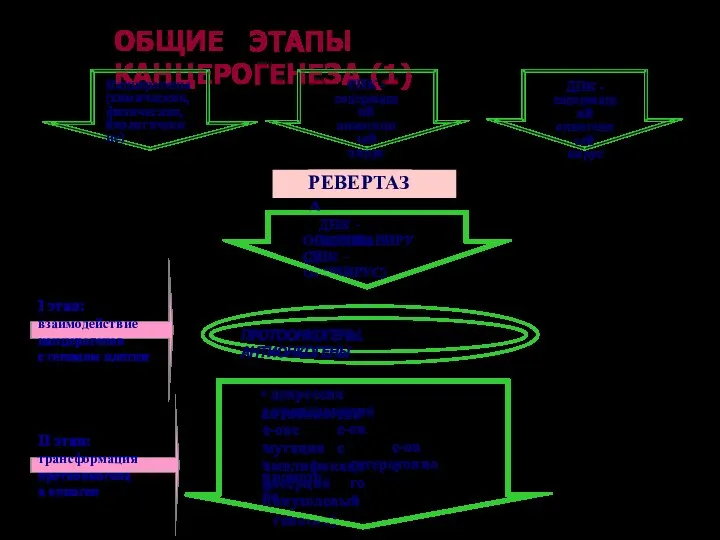
- 66. ОБЩИЕ ЭТАПЫ КАНЦЕРОГЕНЕЗА (1) I этап: взаимодействие канцерогенов с геномом клетки II этап: трансформация протоонкогена в
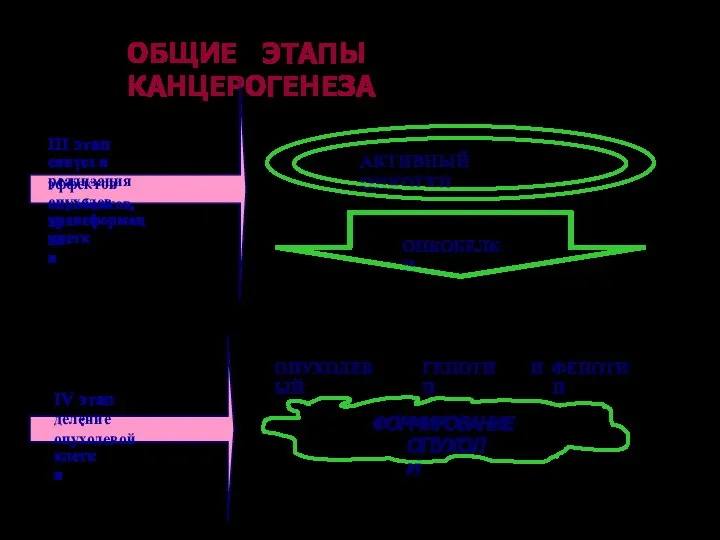
- 67. ОБЩИЕ ЭТАПЫ КАНЦЕРОГЕНЕЗА III этап: синтез и реализация эффектов онкобелков, опухолевая трансформация клетки IV этап: деление
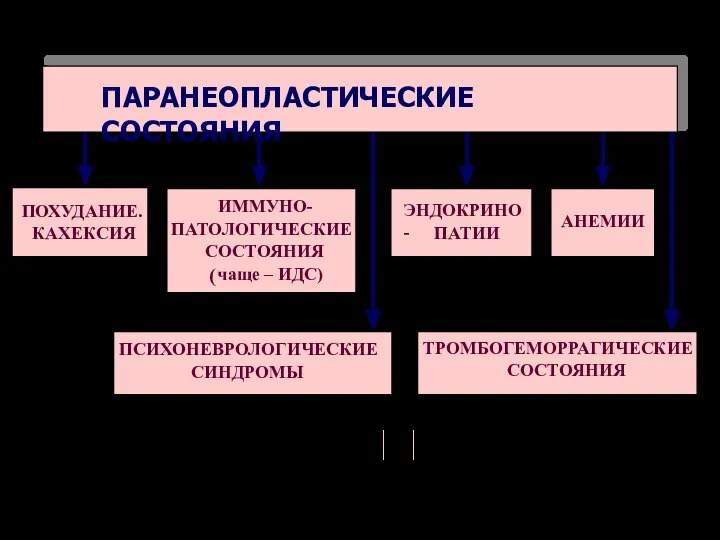
- 68. ПАРАНЕОПЛАСТИЧЕСКИЕ СОСТОЯНИЯ ПОХУДАНИЕ. КАХЕКСИЯ ИММУНО- ПАТОЛОГИЧЕСКИЕ СОСТОЯНИЯ ( чаще – ИДС) ПСИХОНЕВРОЛОГИЧЕСКИЕ СИНДРОМЫ ТРОМБОГЕМОРРАГИЧЕСКИЕ СОСТОЯНИЯ ЭНДОКРИНО-
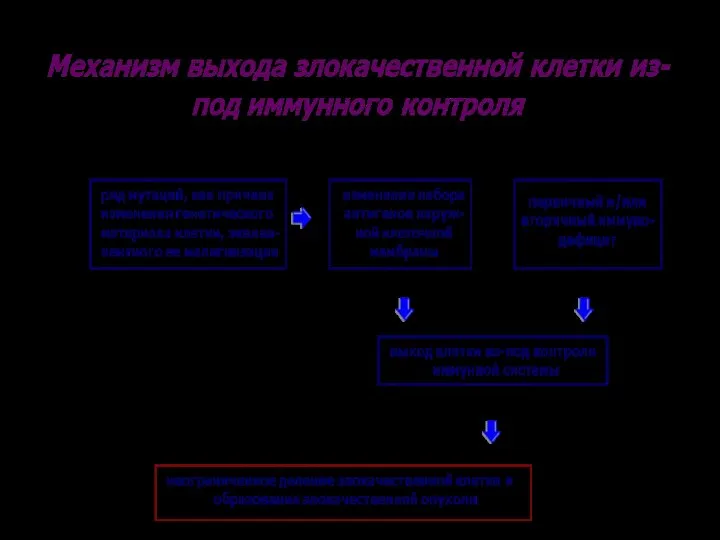
- 70. АНТИБЛАСТОМНАЯ РЕЗИСТЕНТНОСТЬ: * свойство организма * препятствовать проникновению канцерогенных агентов в клетку, её ядро и/или их
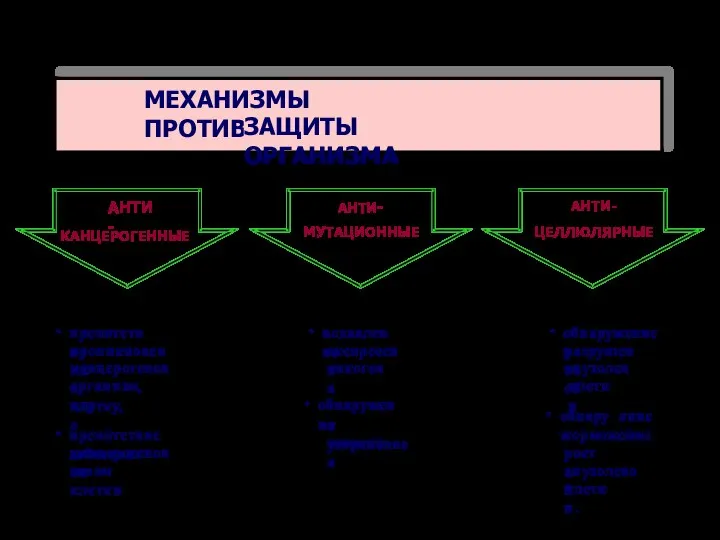
- 72. МЕХАНИЗМЫ ПРОТИВООПУХОЛЕВОЙ ЗАЩИТЫ ОРГАНИЗМА АНТИ- КАНЦЕРОГЕННЫЕ АНТИ- МУТАЦИОННЫЕ АНТИ- ЦЕЛЛЮЛЯРНЫЕ
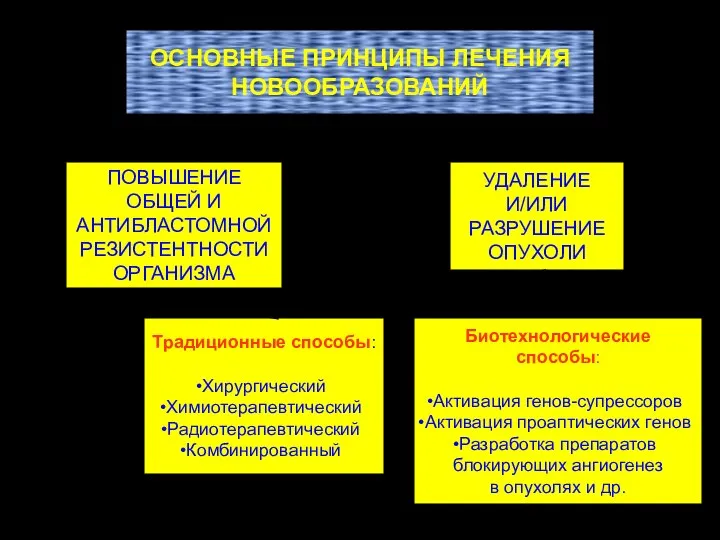
- 73. ОСНОВНЫЕ ПРИНЦИПЫ ЛЕЧЕНИЯ НОВООБРАЗОВАНИЙ ПОВЫШЕНИЕ ОБЩЕЙ И АНТИБЛАСТОМНОЙ РЕЗИСТЕНТНОСТИ ОРГАНИЗМА УДАЛЕНИЕ И/ИЛИ РАЗРУШЕНИЕ ОПУХОЛИ Традиционные способы:
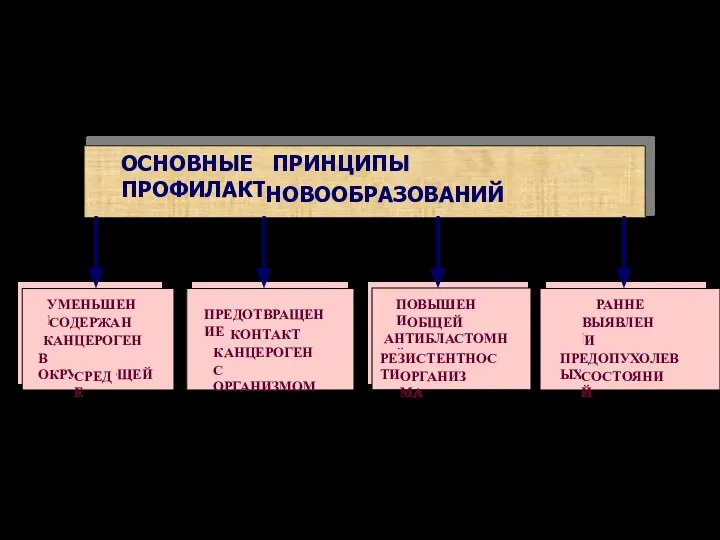
- 74. ОСНОВНЫЕ ПРИНЦИПЫ ПРОФИЛАКТИКИ НОВООБРАЗОВАНИЙ ПРЕДОТВРАЩЕНИЕ КОНТАКТА КАНЦЕРОГЕНОВ С ОРГАНИЗМОМ УМЕНЬШЕНИЕ СОДЕРЖАНИЯ КАНЦЕРОГЕНОВ В ОКРУЖАЮЩЕЙ СРЕДЕ ПОВЫШЕНИЕ
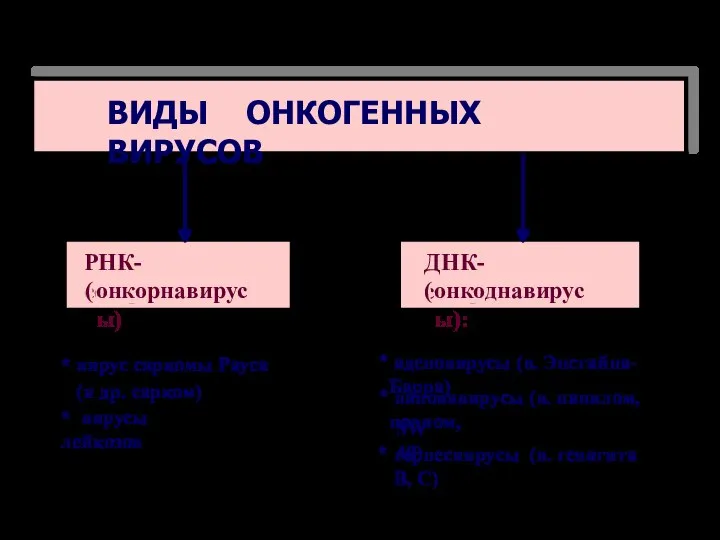
- 76. ВИДЫ ОНКОГЕННЫХ ВИРУСОВ ДНК-содержащие ( онкоднавирусы): РНК-содержащие ( онкорнавирусы) * вирус саркомы Рауса (и др. сарком)
- 77. Общая характеристика опухолевой прогрессии Фенотипические ее проявления заключаются в изменении биохимических, морфологических, электрофизиологических и функциональных признаков
- 78. раковая опухоль ФРЭС прорастание сосудов вокруг опухоли рост опухоли и образование метастазов
- 79. ПЕРВИЧНАЯ ОПУХОЛЬ Трансформированная клетка Базальная мембрана Лимфоцит Тромбоциты ЭТАПЫ МЕТАСТАЗИРОВАНИЯ (“метастатический каскад”) √ Интравазация – 4
- 80. Источники и кругооборот 3,4-бензпирсна в природе (по А. И. Гнатышаку, 1975).
- 82. Значение опухолевой прогрессии Определяет гетерогенность опухолевой болезни Способствует адаптации злокачественных клеток к меняющимся условиям: - недостатку
- 83. Схема опухолевой прогрессии (по Hauschka, 1961): N – нормальная клетка; S – основная стволовая линия; Si
- 88. ФАКТОРЫ, РЕГУЛИРУЮЩИЕ АПОПТОЗ р53 – клеточный фосфопротеин - проапоптотический фактор. Он индуцирует апоптоз путем: 1. Активации
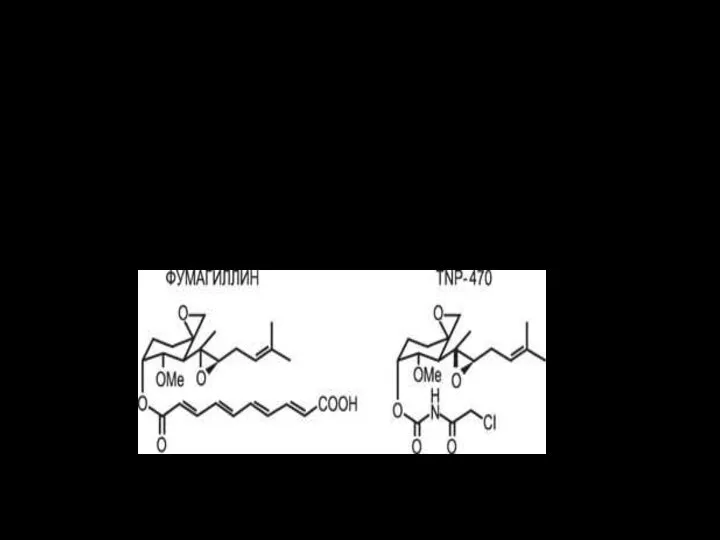
- 94. Продукт метаболизма грибковых микроорганизмов фумагиллин - один из наиболее сильных блокаторов роста сосудов. Его синтетический аналог
- 95. На фотографии показано, как природный ангиостатический препарат фумагиллин предотвращает развитие новых кровеносных сосудов на препарате ткани
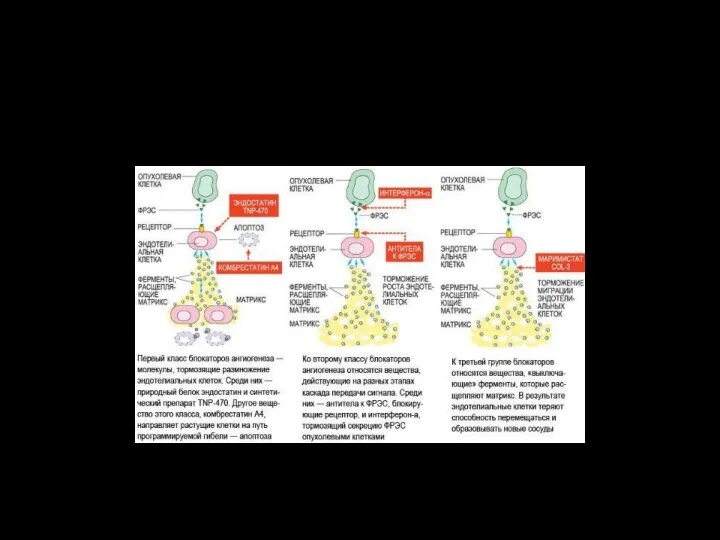
- 96. В настоящее время ученые проверяют возможность применения различных блокаторов ангиогенеза в лечении рака. Блокаторы (ангиостатики) подразделяются
- 97. План лекции (I-II) Определение понятий: опухоль злокачественная, доброкачественная опухоль. Условия, способствующие росту злокачественных новообразований, этиологические факторы
- 98. раковая опухоль ФРЭС прорастание сосудов вокруг опухоли рост опухоли и образование метастазов Эндотелиальные клетки ФРЭС ФРЭС
- 101. раковая опухоль ФРЭС прорастание сосудов вокруг опухоли рост опухоли и образование метастазов Эндотелиальные клетки ФРЭС ФРЭС
- 102. Опухолевая прогрессия – это генетически закрепленное, наследуемое и необратимо измененное свойство, или несколько свойств опухолевой клетки
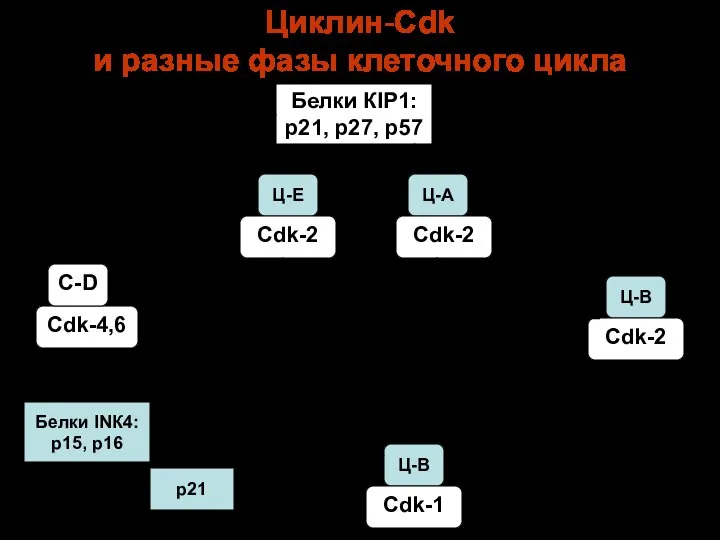
- 103. Циклин-Сdk и разные фазы клеточного цикла Белки КIР1: р21, р27, р57 G1 S G2 М Ц-В
- 104. Инициация пролиферации ЯДРО Транскрипционные факторы генов раннего ответа + + + + – Гены замедленного ответа
- 105. Инвазивно-метастатический процесс имеет свои этапы развития. Каждый из них осуществляется на фоне супрессивных и цитотоксических влияний
- 106. 3. Проникновение через внеклеточный матрикс. Миграция неопластических клеток сквозь соединительную ткань. Проникновение в соединительную ткань и
- 107. 5. Опухолевая эмболия – внутрисосудистый этап метастатического процесс. Здесь важное значение имеет взаимодействие злокачественных клеток с
- 108. Способность собственных факторов аутотрансплантанта отвечать на хемокины и факторы роста местных тканей. например, клетки рака молочной
- 111. Скачать презентацию

























































 Правовой статус несовершеннолетних . Необходимость получения правовых знаний и навыков их применения для реализации прав и ответ
Правовой статус несовершеннолетних . Необходимость получения правовых знаний и навыков их применения для реализации прав и ответ ТЕХНОЛОГИЯ КОРОБОЧКА
ТЕХНОЛОГИЯ КОРОБОЧКА Грибы Растения ли это?
Грибы Растения ли это? Презентация Черный квадрат
Презентация Черный квадрат Тема: Руководитель как субъект организаторской деятельности Теория организации
Тема: Руководитель как субъект организаторской деятельности Теория организации Подземная урбанистика (часть 1). Подборка примеров подземных пререходов
Подземная урбанистика (часть 1). Подборка примеров подземных пререходов Триггерные устройства
Триггерные устройства Муниципальное автономное дошкольное образовательное учреждение детский сад комбинированного вида «Лесная сказка» п. Каменск ПР
Муниципальное автономное дошкольное образовательное учреждение детский сад комбинированного вида «Лесная сказка» п. Каменск ПР Инфраструктурный комплекс
Инфраструктурный комплекс Проанализировать динамику показателей финансовых результатов Аятского бокситового рудника
Проанализировать динамику показателей финансовых результатов Аятского бокситового рудника  Повышение квалификации приходских катехизаторов
Повышение квалификации приходских катехизаторов ВОЛШЕБНИЦА ГЛАЗУНЬЯ Авторы: Сазонова Н. Н. МОУ «СОШ №10» п. Раздольное Котляр Г. В. МОУ «СОШ
ВОЛШЕБНИЦА ГЛАЗУНЬЯ Авторы: Сазонова Н. Н. МОУ «СОШ №10» п. Раздольное Котляр Г. В. МОУ «СОШ НАУКА КАК СИСТЕМА ЗНАНИЙ НАУКА КАК ДЕЯТЕЛЬНОСТЬ.
НАУКА КАК СИСТЕМА ЗНАНИЙ НАУКА КАК ДЕЯТЕЛЬНОСТЬ. Братья Люмьер
Братья Люмьер Le français du début du XXIème siècle: changements dans le système vocalique
Le français du début du XXIème siècle: changements dans le système vocalique Язык программирования PROLOG
Язык программирования PROLOG Проэкт: Дизайнерский скворечник
Проэкт: Дизайнерский скворечник Подъемные механизмы
Подъемные механизмы Регистры
Регистры Фигуристки России Аделина Сотникова Ирина Слуцкая
Фигуристки России Аделина Сотникова Ирина Слуцкая Законодательство конца 1917 - первой половины 1918 года: уголовное право Подготовила: Простакова Вероника Группа Ю-123б
Законодательство конца 1917 - первой половины 1918 года: уголовное право Подготовила: Простакова Вероника Группа Ю-123б ФОРМИРОВАНИЕ ПОТРЕБНОСТИ В ОБУЧЕНИИ И САМОРАЗВИТИИ У МЛАДШИХ ШКОЛЬНИКОВ МО УЧИТЕЛЕЙ НАЧАЛЬНЫХ КЛАССОВ 1 ЧЕТВЕРТЬ 2008Г.
ФОРМИРОВАНИЕ ПОТРЕБНОСТИ В ОБУЧЕНИИ И САМОРАЗВИТИИ У МЛАДШИХ ШКОЛЬНИКОВ МО УЧИТЕЛЕЙ НАЧАЛЬНЫХ КЛАССОВ 1 ЧЕТВЕРТЬ 2008Г. ФСКН РФ по КБР
ФСКН РФ по КБР  Туроператор активного отдыха «Другой Маршрут». Начальная школа инструкторов по туризму. Сезон 2018
Туроператор активного отдыха «Другой Маршрут». Начальная школа инструкторов по туризму. Сезон 2018 Понятие «консервативная революция»: причины и эволюция явления. Взгляды А. Мёллера ван ден Брука
Понятие «консервативная революция»: причины и эволюция явления. Взгляды А. Мёллера ван ден Брука Гайморит
Гайморит Угол (2 класс) - презентация_
Угол (2 класс) - презентация_ 7. Орфограммы корня
7. Орфограммы корня