Содержание
- 2. Теоретические основы органической химии Выявление законов и закономерностей химической формы движения материи (превращений органических молекул). Лекция
- 3. Закон динамической эволюции волновой функции во времени для изолированной системы H – оператор Гамильтона t -время
- 4. «Основная задача теоретической химии обеспечить концептуальную и терминологическую основу, что необходимо для понимания химии» (Walter Thiel,
- 5. 3. Молекула – бесконечно долгоживущая система Стационарное уравнение Шредингера Ψ – собственные волновые функции E –
- 6. Адиабатическое уравнение Шредингера 4. H = Ha + Tя Tя – оператор кинетической энергии ядер
- 7. Приближение Хартри-Фока (X-Ф) (ограниченный Х-Ф, замкнутая оболочка) 5. E = ∫ … ∫ φ(1,2...2n) H φ(1,2…2n)dτ1dτ2…dτn
- 8. Метод ССП МО использует приближение ЛКАО, где в качестве базиса разложения применяют базис атомных орбиталей φi
- 9. Fμν - матричные элементы матрицы Фока: Fμν = Hμν + ΣΣPλσ[μνIλσ] - ½ (μνIνσ] (2) Интеграл
- 10. Полная энергия Е: Орбитальные энергии получают решением: I Fμν - εi Sμν I = 0 (6)
- 11. Базисные АО 9. Слейтеровского типа орбитали χ(r,Θ,Φ) = rn-1 e-εr Ylm(Θ,Φ) ε − эффективный заряд ядра
- 12. 10. Гаусова типа орбитали p,q,s – целые числа внутренняя 1s - 4-мя GTO валентная 2S -
- 13. Поверхность потенциальной энергии - функция от ее полной энергии (за вычетом кинетической энергии ядер). Если система
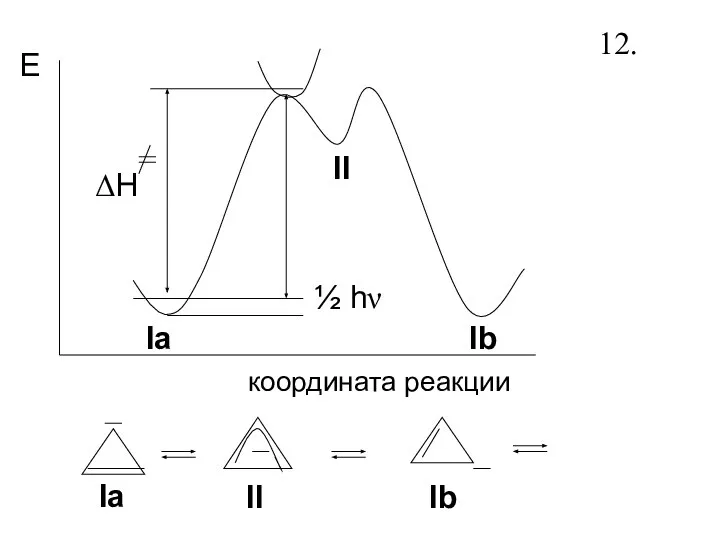
- 14. ½ hν ΔH E координата реакции Ia II Ib Ia II Ib 12.
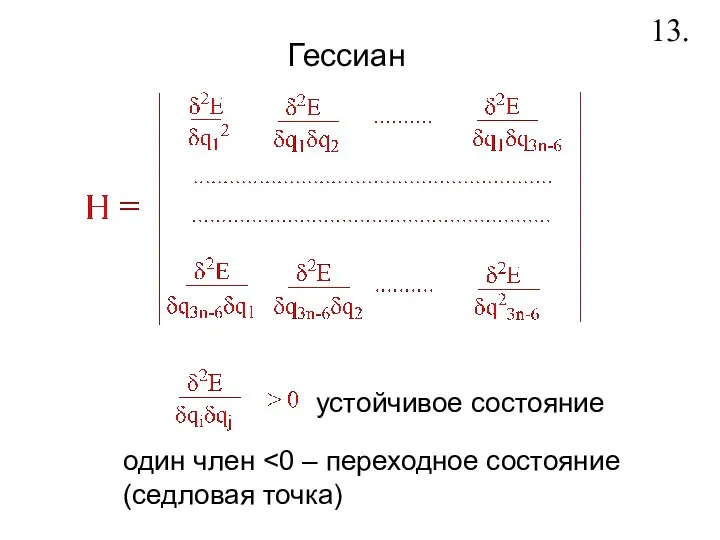
- 15. Гессиан 13. устойчивое состояние один член (седловая точка)
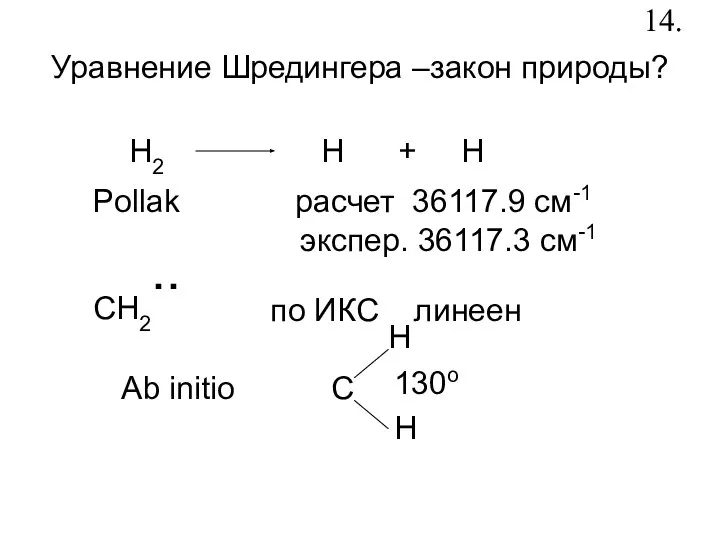
- 16. Уравнение Шредингера –закон природы? H2 H + H Pollak расчет 36117.9 см-1 экспер. 36117.3 см-1 СH2..
- 17. Традиционные методы определения электронной структуры, в частности, метод Хартри — Фока описывают систему с помощью многоэлектронной
- 18. Методы основаны на анализе распределения электронной плотности [ρ = f(координат)]: E = f (r) E =
- 19. Теоремы Хоэнберга — Кона Первая теорема: существует взаимно однозначное соответствие между плотностью основного состояния электронной подсистемы,
- 20. P. Hohenberg, W. Kohn 1964 г. E = E[ρ] Полная энергия (Е) – функция распределения электронной
- 21. F[ρ] = T[ρ] + Vee [ρ] T[r] - функционал кинетической энергии электронов Vee [r] – функционал
- 22. = ν(r) + δF/δρ(r) = const тогда: [-1/2 Δ2 + ν(r) + νxc(r) + ∫ρ(r) /
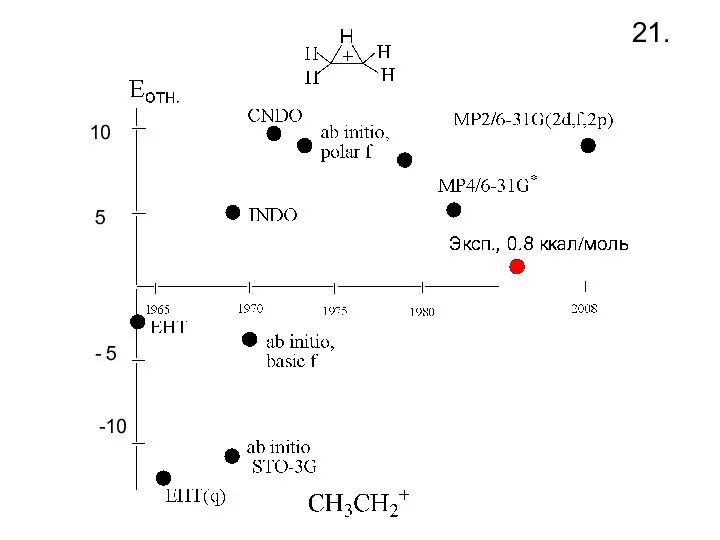
- 23. 21. -10 - 5 5 10
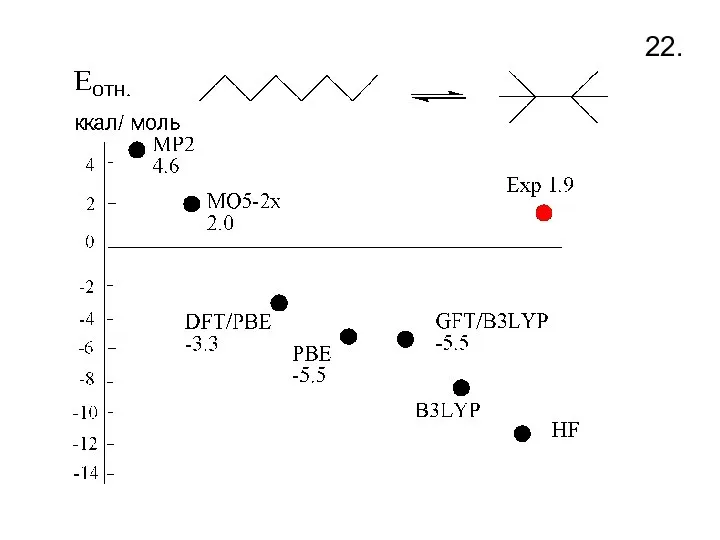
- 24. 22.
- 25. Квантово-химические расчеты J. Phys. Chem. A, 2000, 2054 23.
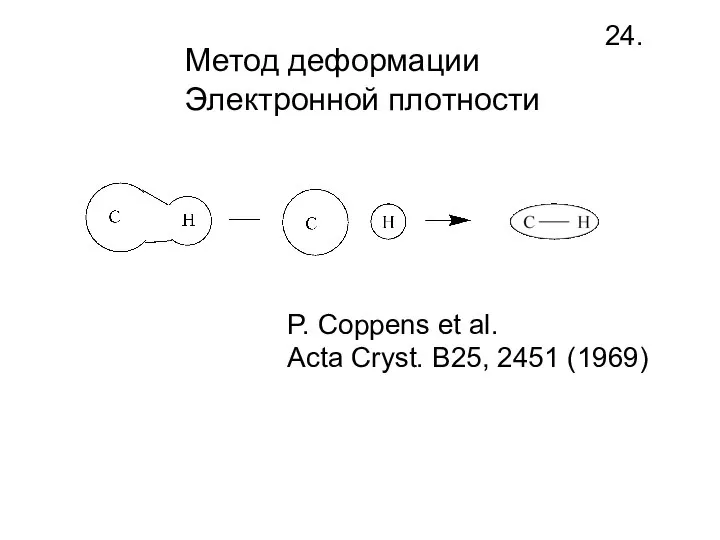
- 26. Метод деформации Электронной плотности 24. P. Coppens et al. Acta Cryst. B25, 2451 (1969)
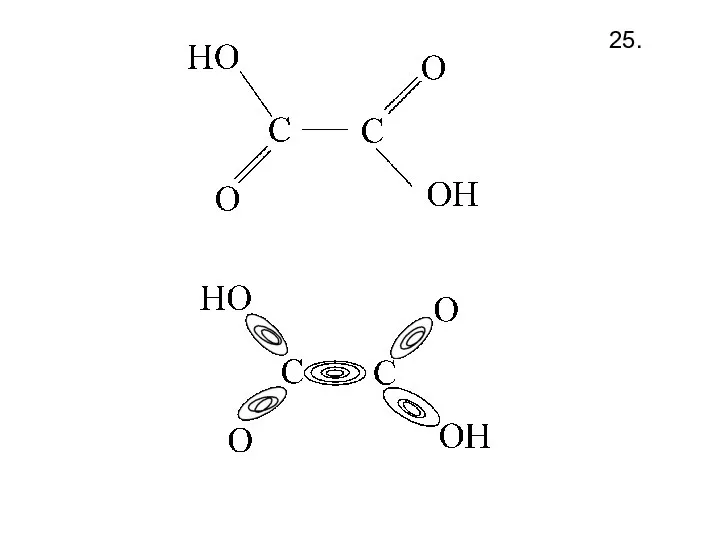
- 27. 25.
- 28. Теория резонанса 26. Последовательность и расположение атомов в резонансных структурах должна быть такой же как и
- 30. Скачать презентацию







![Fμν - матричные элементы матрицы Фока: Fμν = Hμν + ΣΣPλσ[μνIλσ]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304031/slide-8.jpg)





![Методы основаны на анализе распределения электронной плотности [ρ = f(координат)]: E](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304031/slide-17.jpg)

![P. Hohenberg, W. Kohn 1964 г. E = E[ρ] Полная энергия](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304031/slide-19.jpg)
![F[ρ] = T[ρ] + Vee [ρ] T[r] - функционал кинетической энергии](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1304031/slide-20.jpg)



 Исламский фундаментализм
Исламский фундаментализм Правоотношения детей и родителей
Правоотношения детей и родителей Репка. Найди 10 отличий - презентация для начальной школы
Репка. Найди 10 отличий - презентация для начальной школы Исаакиевский собор
Исаакиевский собор  DC sweep Parameter sweep Temperature sweep. Виды автоматического анализа в Multisim
DC sweep Parameter sweep Temperature sweep. Виды автоматического анализа в Multisim Suomen kielen kahdeskymmenesneljäs 24. Oppitunti. Verbit. Глаголы
Suomen kielen kahdeskymmenesneljäs 24. Oppitunti. Verbit. Глаголы 11 класс. Повторение
11 класс. Повторение Блок. «Золотое правило» механики для блока
Блок. «Золотое правило» механики для блока ВЕРИФИКАЦИЯ ПРОГРАММ ДВС
ВЕРИФИКАЦИЯ ПРОГРАММ ДВС Тема 4: Риски в предпринимательской сфере. План: 1.Сущность предпринимательского риска. 2.Классификация предпринимательских риско
Тема 4: Риски в предпринимательской сфере. План: 1.Сущность предпринимательского риска. 2.Классификация предпринимательских риско Правила дорожные знать всем положено Чернева Любовь Иннокентьевна МДОУ детский сад №31
Правила дорожные знать всем положено Чернева Любовь Иннокентьевна МДОУ детский сад №31  Лев Николаевич Толстой. Творчество писателя
Лев Николаевич Толстой. Творчество писателя Презентация на тему "Ожирение" - скачать презентации по Медицине
Презентация на тему "Ожирение" - скачать презентации по Медицине Классификация схем трещин каменного здания. Причины их возникновения. Методы измерения ширины и контроля трещин кладки
Классификация схем трещин каменного здания. Причины их возникновения. Методы измерения ширины и контроля трещин кладки Василиса Премудрая - презентация для начальной школы
Василиса Премудрая - презентация для начальной школы Логические значения. Ветвление (Delphi)
Логические значения. Ветвление (Delphi) Развитие культуры в русских землях во второй половине 13-14 в
Развитие культуры в русских землях во второй половине 13-14 в Презентация Оборотные средства, их состав, классификация, оборачиваемость Оборотные средства, их состав, классификация, оборачив
Презентация Оборотные средства, их состав, классификация, оборачиваемость Оборотные средства, их состав, классификация, оборачив Автошкола Драйв. Новые филиалы
Автошкола Драйв. Новые филиалы Схемы замещения источников электрической энергии
Схемы замещения источников электрической энергии Компоненты отношения власти. Субъект и объект власти
Компоненты отношения власти. Субъект и объект власти Генерация (псевдо) случайных чисел в языке СИ
Генерация (псевдо) случайных чисел в языке СИ Паттерн Builder (строитель)
Паттерн Builder (строитель) Методология системного анализа. Понятие системы
Методология системного анализа. Понятие системы Процедуры и функции. Заголовок и тело процедур и функций, классификация параметров. Вызов процедур и функций
Процедуры и функции. Заголовок и тело процедур и функций, классификация параметров. Вызов процедур и функций Культура России в конце XIX – начале XX века
Культура России в конце XIX – начале XX века Международно-правовые основания криминализации деяний, связанных с посягательством на культурные ценности
Международно-правовые основания криминализации деяний, связанных с посягательством на культурные ценности STP Overview STP
STP Overview STP