Содержание
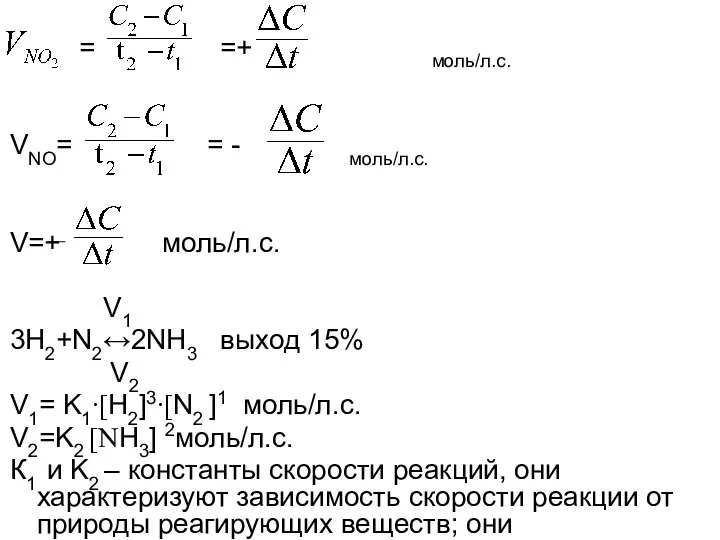
- 2. = =+ моль/л.с. VNO= = - моль/л.с. V=+ моль/л.с. V1 3H2+N2↔2NH3 выход 15% V2 V1= K1∙[H2]3∙[N2
- 3. N≡N Eсв.=940кДж H2→H∙+∙H EH-H432 кДж 9400С N2+3H2↔2 NH3 выход 70% N2↔∙N:+ :N∙ H2↔H∙+ ∙H ↔2 NH3
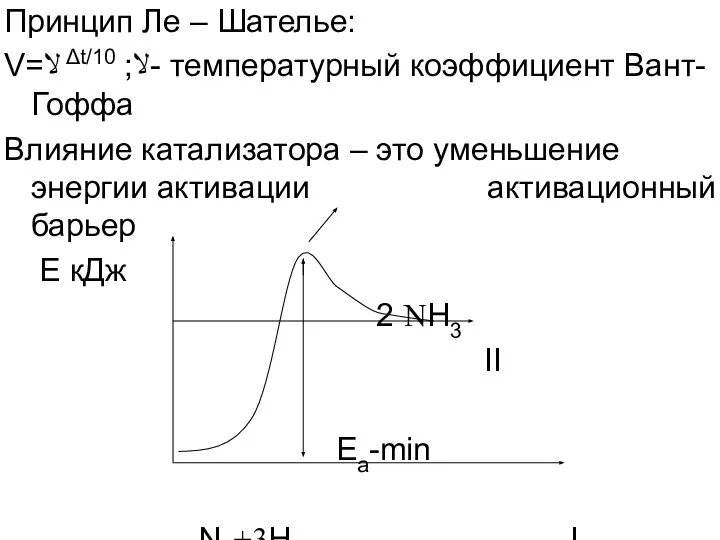
- 4. Принцип Ле – Шателье: V=ﻻ Δt/10 ;ﻻ- температурный коэффициент Вант-Гоффа Влияние катализатора – это уменьшение энергии
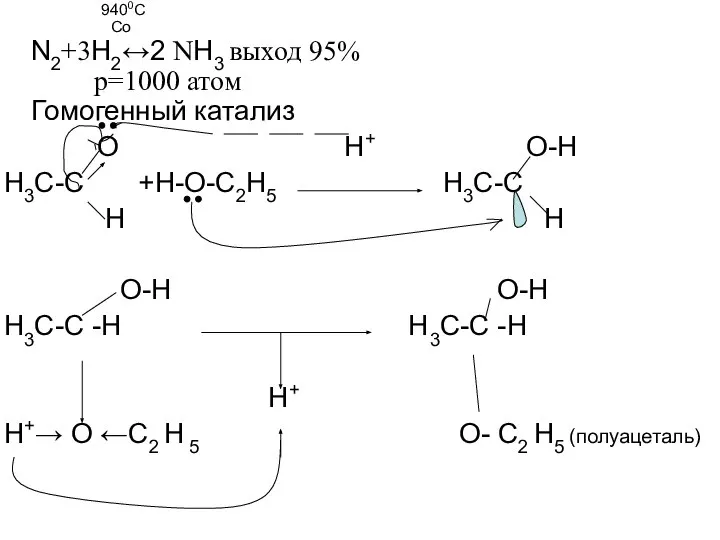
- 5. 9400С Co N2+3H2↔2 NH3 выход 95% р=1000 атом Гомогенный катализ O H+ O-H H3C-C +H-O-C2H5 H3C-C
- 6. Особенности ферментативного катализа: Специфичность ферментов Мягкие условия (36,60С, р0=7,8атом) 3. Значительные уменьшение Еа. Уравнение Михаэлиса –
- 8. Скачать презентацию


 исследование 4 кл. - презентация для начальной школы
исследование 4 кл. - презентация для начальной школы Изгибаемые элементы
Изгибаемые элементы Методы экспертных оценок в стратегическом государственном управлении
Методы экспертных оценок в стратегическом государственном управлении Презентация Интеллектуальная игра умники и умницы
Презентация Интеллектуальная игра умники и умницы Тема №6. Аппаратура управления и защиты бортовых систем электроснабжения. Занятие 1. Общие сведения о защите СЭС
Тема №6. Аппаратура управления и защиты бортовых систем электроснабжения. Занятие 1. Общие сведения о защите СЭС Дарвинский заповедник
Дарвинский заповедник  Презентация Статья 181 УК РФ. Нарушение правил изготовления и использования государственных пробирных клейм
Презентация Статья 181 УК РФ. Нарушение правил изготовления и использования государственных пробирных клейм Страйкбол. 6 класс
Страйкбол. 6 класс РЕШАЮЩАЯ РОЛЬ КУЛЬТУРЫ В СТАНОВЛЕНИИ И РАЗВИТИИ НООСФЕРЫ Джура С.Г. dzhura@roerich.com (062) 337-32-66; www.roerich.com
РЕШАЮЩАЯ РОЛЬ КУЛЬТУРЫ В СТАНОВЛЕНИИ И РАЗВИТИИ НООСФЕРЫ Джура С.Г. dzhura@roerich.com (062) 337-32-66; www.roerich.com Безопасность человека в ЧС природного характера
Безопасность человека в ЧС природного характера  Нові медіа – нові потреби аудиторії Ніна Кур’ята
Нові медіа – нові потреби аудиторії Ніна Кур’ята Каталог Лето 2016
Каталог Лето 2016 Особистість підприємця та його ділові якості
Особистість підприємця та його ділові якості Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092
Особенности экономического районирования России Подготовила: Клеутина С.А. Группа МЭ-092  Порядок слов
Порядок слов  Презентация по МХК Художественная культура Среднего Востока
Презентация по МХК Художественная культура Среднего Востока  Средства инструментального программирования
Средства инструментального программирования  Инструкция по вносу накладных
Инструкция по вносу накладных Управление таможенной деятельностью
Управление таможенной деятельностью  Организационные структуры систем государственного управления
Организационные структуры систем государственного управления Влияние аутогенных тренировок в предсоревновательный и соревновательный периоды в подготовке легкой атлетике
Влияние аутогенных тренировок в предсоревновательный и соревновательный периоды в подготовке легкой атлетике The definition of management
The definition of management Архитектура Китая
Архитектура Китая Художник и мир животных презентация к уроку изобразительного искусства 2 класс УМК «Гармония»
Художник и мир животных презентация к уроку изобразительного искусства 2 класс УМК «Гармония»  Презентация Привлечение иностранных инвестиций
Презентация Привлечение иностранных инвестиций  Структуры в Visual
Структуры в Visual География древних путешествий
География древних путешествий Языковая ситуация в Казахстане
Языковая ситуация в Казахстане