Содержание
Слайд 2
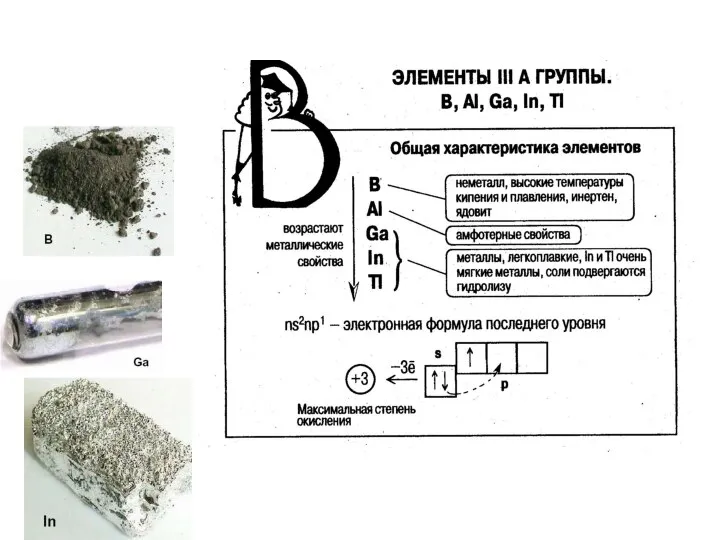
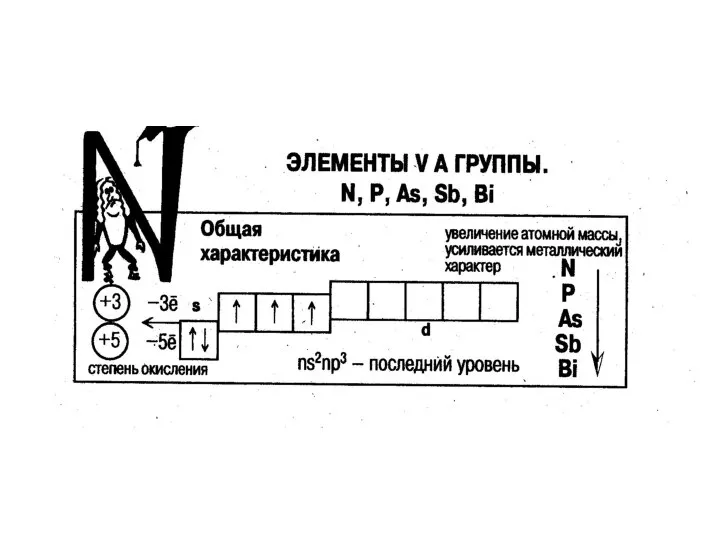
Общая электронная формула:
[…] ns 2(n–2)f 14(n–1)d 10np 1÷6
Степени окисления (от –IV
Общая электронная формула:
[…] ns 2(n–2)f 14(n–1)d 10np 1÷6
Степени окисления (от –IV
до +VII).
Слайд 3
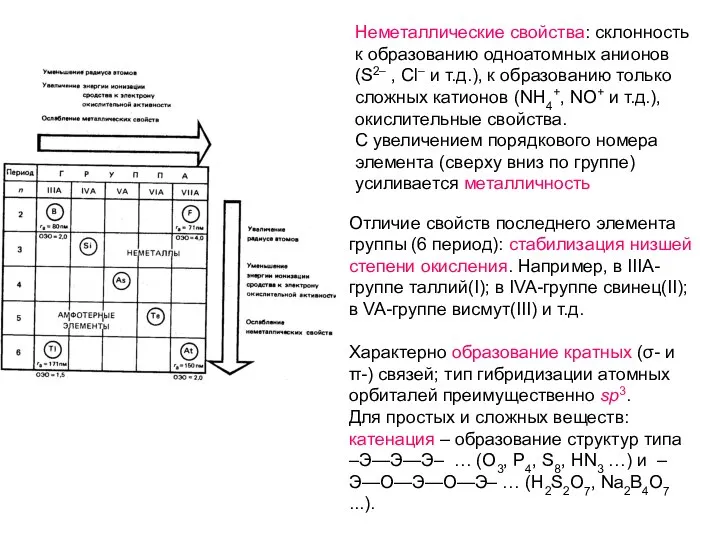
Отличие свойств последнего элемента группы (6 период): стабилизация низшей степени окисления.
Отличие свойств последнего элемента группы (6 период): стабилизация низшей степени окисления.
Например, в IIIA-группе таллий(I); в IVA-группе свинец(II); в VA-группе висмут(III) и т.д.
Характерно образование кратных (σ- и π-) связей; тип гибридизации атомных орбиталей преимущественно sp3.
Для простых и сложных веществ: катенация – образование структур типа –Э—Э—Э– … (O3, P4, S8, HN3 …) и –Э—О—Э—О—Э– … (H2S2O7, Na2B4O7 ...).
Характерно образование кратных (σ- и π-) связей; тип гибридизации атомных орбиталей преимущественно sp3.
Для простых и сложных веществ: катенация – образование структур типа –Э—Э—Э– … (O3, P4, S8, HN3 …) и –Э—О—Э—О—Э– … (H2S2O7, Na2B4O7 ...).
Неметаллические свойства: склонность к образованию одноатомных анионов (S2– , Cl– и т.д.), к образованию только сложных катионов (NH4+, NO+ и т.д.), окислительные свойства.
С увеличением порядкового номера элемента (сверху вниз по группе) усиливается металличность
Слайд 4
Слайд 5
Слайд 6
Слайд 7
Слайд 8
Слайд 9
Слайд 10
Слайд 11
Слайд 12
Слайд 13
Слайд 14
Слайд 15
Слайд 16
Слайд 17
Слайд 18
Слайд 19
Слайд 20
Слайд 21
Слайд 22
Слайд 23
Слайд 24
Слайд 25
Слайд 26
Слайд 27
Слайд 28
Слайд 29
Слайд 30
Слайд 31
Слайд 32
Слайд 33
Слайд 34
Слайд 35
![Общая электронная формула: […] ns 2(n–2)f 14(n–1)d 10np 1÷6 Степени окисления (от –IV до +VII).](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1291552/slide-1.jpg)










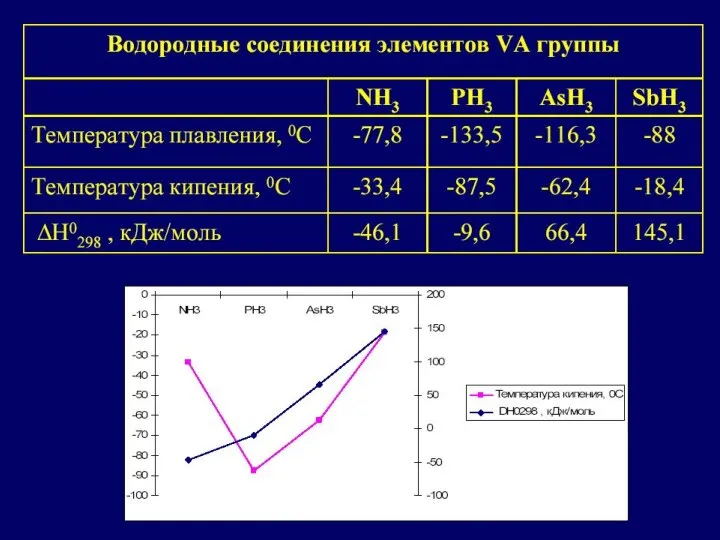





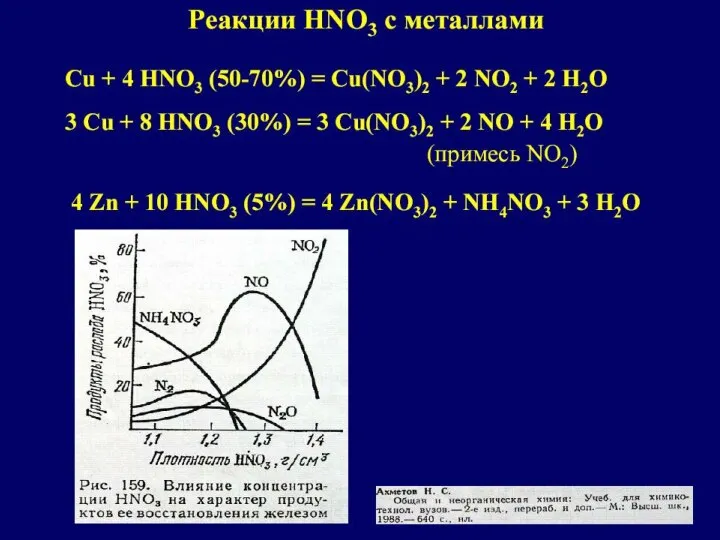
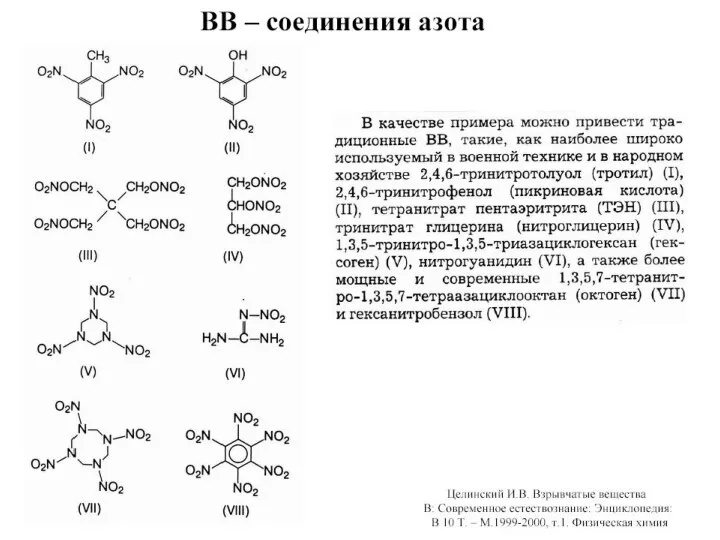


 Сегментация рынка Компания «Coca-cola»
Сегментация рынка Компания «Coca-cola» Ранения(повреждения) черепа, головного мозга, позвоночника и спинного мозга.
Ранения(повреждения) черепа, головного мозга, позвоночника и спинного мозга. КОНВЕРГЕНЦИЯ ИНТЕРНЕТА И ТЕЛЕВИДЕНИЯ КАК НОВЫЙ МЕДИЙНЫЙ СУПЕРГЕРОЙ
КОНВЕРГЕНЦИЯ ИНТЕРНЕТА И ТЕЛЕВИДЕНИЯ КАК НОВЫЙ МЕДИЙНЫЙ СУПЕРГЕРОЙ ФЕНОМЕНЫ ГРУППОВОЙ ЖИЗНЕДЕЯТЕЛЬНОСТИ
ФЕНОМЕНЫ ГРУППОВОЙ ЖИЗНЕДЕЯТЕЛЬНОСТИ Теоретические основы дисциплины "Территориальное планирование". Лекция 1
Теоретические основы дисциплины "Территориальное планирование". Лекция 1 Состояние и перспективы развития малой гидроэнергетики в России
Состояние и перспективы развития малой гидроэнергетики в России Разговорник. Турецкий язык
Разговорник. Турецкий язык Эксплуатационные характеристики (Э.Х.) энергоустановок
Эксплуатационные характеристики (Э.Х.) энергоустановок Цветущая сакура. Урок ИЗО в 4 классе
Цветущая сакура. Урок ИЗО в 4 классе Норийные ковши, скребки, ролики (пластиковые) для цепных транспортеров
Норийные ковши, скребки, ролики (пластиковые) для цепных транспортеров Программирование на Python
Программирование на Python Валютный курс рубля
Валютный курс рубля Orifleym. Менеджер 9%
Orifleym. Менеджер 9% Презентация "Экономическая сфера общества" - скачать презентации по Экономике
Презентация "Экономическая сфера общества" - скачать презентации по Экономике ОРГАНЫ УПРАВЛЕНИЯ И КОНТРОЛЯ УСТРОЙСТВА УПРАВЛЕНИЯ (УУС) СТАНЦИИ. ПОРЯДОК ПРОВЕРКИ РАБОТОСПОСОБНОСТИ УУС
ОРГАНЫ УПРАВЛЕНИЯ И КОНТРОЛЯ УСТРОЙСТВА УПРАВЛЕНИЯ (УУС) СТАНЦИИ. ПОРЯДОК ПРОВЕРКИ РАБОТОСПОСОБНОСТИ УУС Леонард Эйлер (1707-1783)
Леонард Эйлер (1707-1783) ПРИНЦИПЫ И ВИДЫ ПРИРОДОПОЛЬЗОВАНИЯ Выполнили: студенты группы Ю-101 Меженько Юлия Шевцова Екатерина
ПРИНЦИПЫ И ВИДЫ ПРИРОДОПОЛЬЗОВАНИЯ Выполнили: студенты группы Ю-101 Меженько Юлия Шевцова Екатерина Политические партии
Политические партии Проектирование двухэтажного коттеджа с гаражом
Проектирование двухэтажного коттеджа с гаражом Путешествие в страну дробных чисел Урок математики в 6 классе Автор: учитель математики МОУ «СОШ №4» Шарова Валентина Степ
Путешествие в страну дробных чисел Урок математики в 6 классе Автор: учитель математики МОУ «СОШ №4» Шарова Валентина Степ Дом из дров и глины по технологии Cordwood
Дом из дров и глины по технологии Cordwood Антифосфолипидный синдром
Антифосфолипидный синдром Ключ к тесту
Ключ к тесту Адаптация детей и их родителей в д/у ЛЯПУНОВА М.В. ВОСПИТАТЕЛЬ ГРУППЫ №12 МАДОУ №95 «БАЛКЫШ» Г. НАБЕРЕЖНЫЕ ЧЕЛНЫ ТАТАРСТАН
Адаптация детей и их родителей в д/у ЛЯПУНОВА М.В. ВОСПИТАТЕЛЬ ГРУППЫ №12 МАДОУ №95 «БАЛКЫШ» Г. НАБЕРЕЖНЫЕ ЧЕЛНЫ ТАТАРСТАН  Базовые движения
Базовые движения Строительство универсальной спортивной площадки
Строительство универсальной спортивной площадки Презентация на тему Сказка Колобок Мультфильм
Презентация на тему Сказка Колобок Мультфильм  Пожар - презентация для начальной школы_
Пожар - презентация для начальной школы_