Содержание
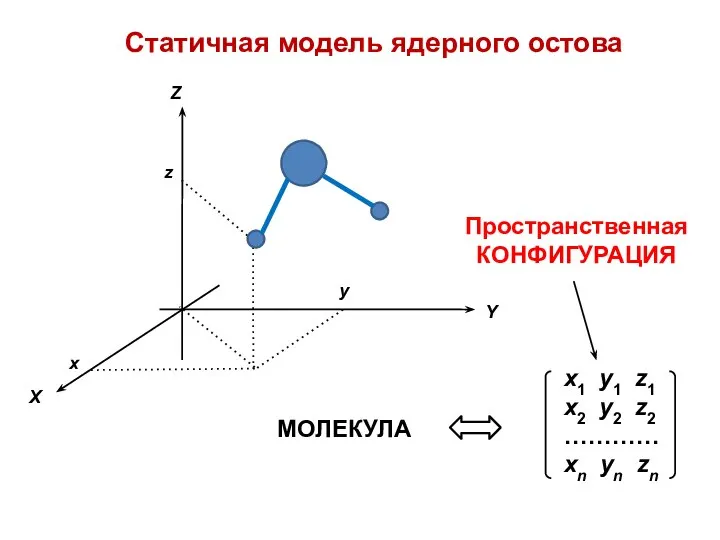
- 3. Статичная модель ядерного остова
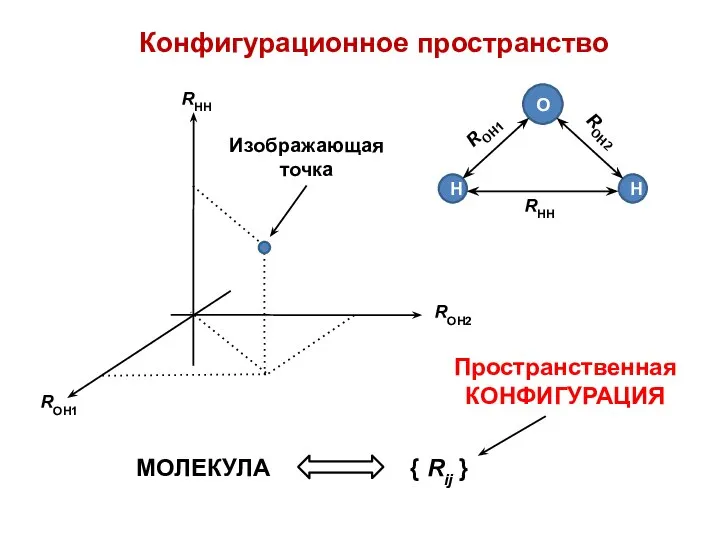
- 4. Конфигурационное пространство
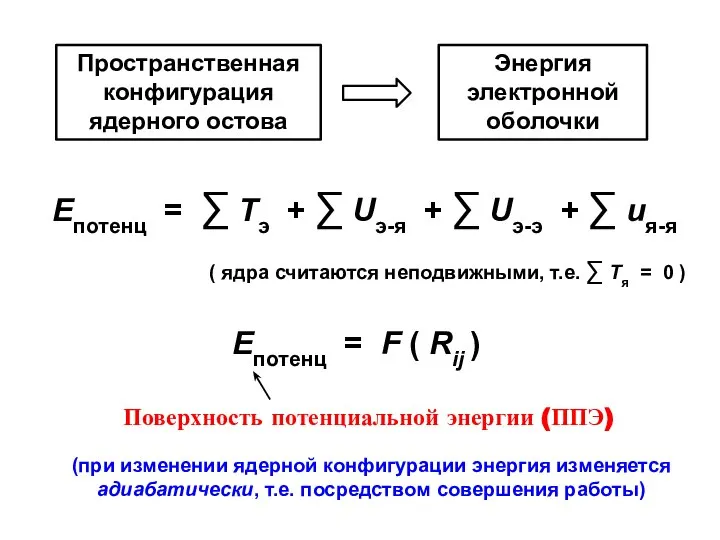
- 5. Епотенц = F ( Rij ) (при изменении ядерной конфигурации энергия изменяется адиабатически, т.е. посредством совершения
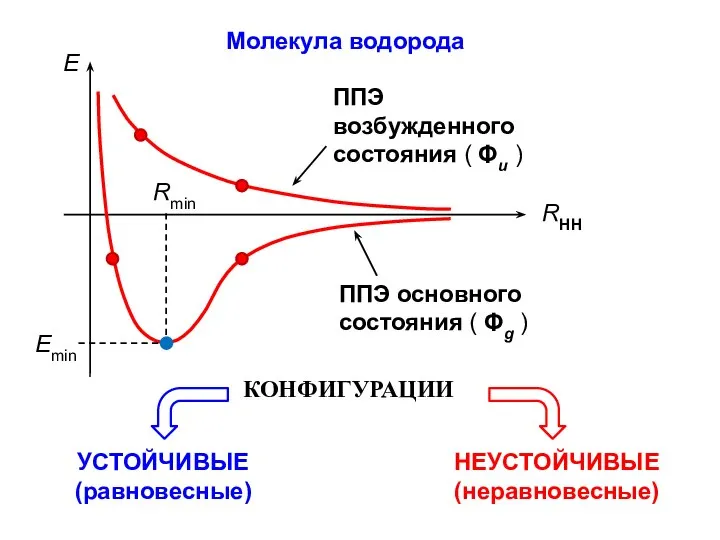
- 6. Молекула водорода
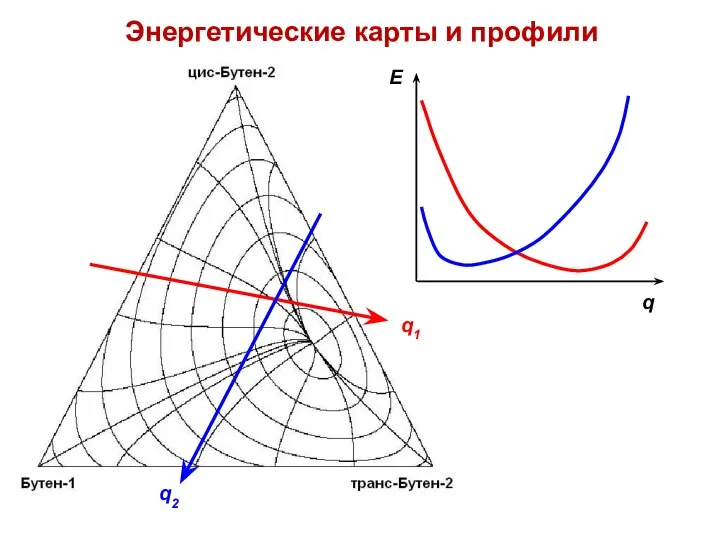
- 7. Энергетические карты и профили
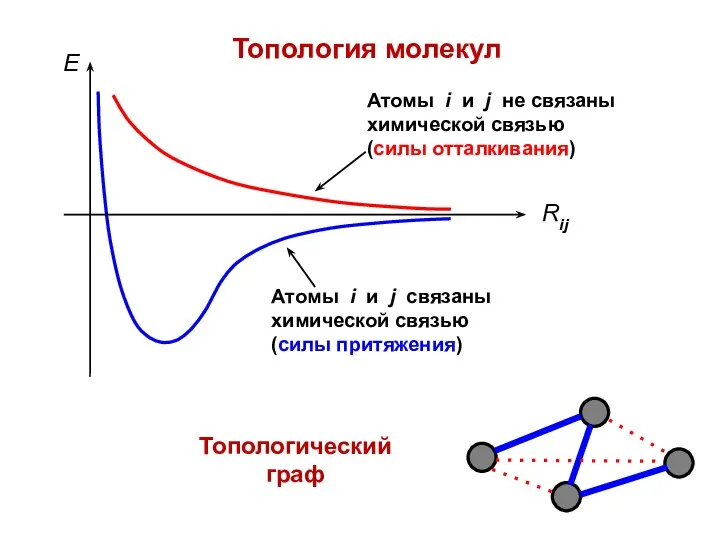
- 8. Топология молекул Топологический граф
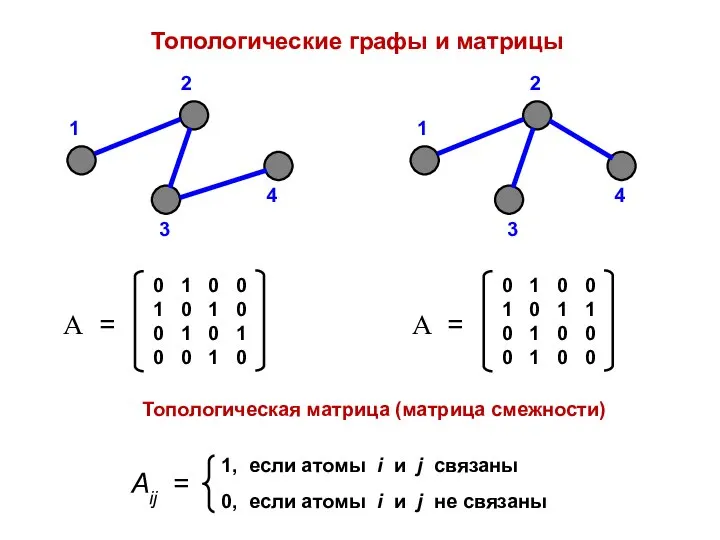
- 10. Топологические графы и матрицы Топологическая матрица (матрица смежности)
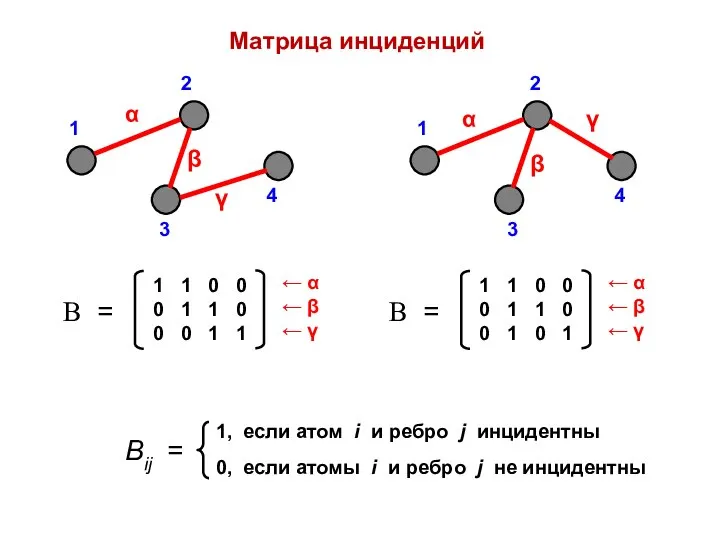
- 11. Матрица инциденций
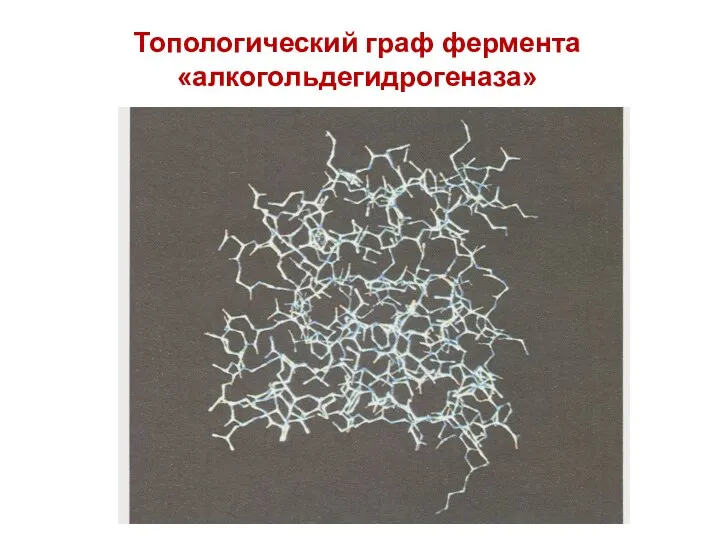
- 12. Топологический граф фермента «алкогольдегидрогеназа»
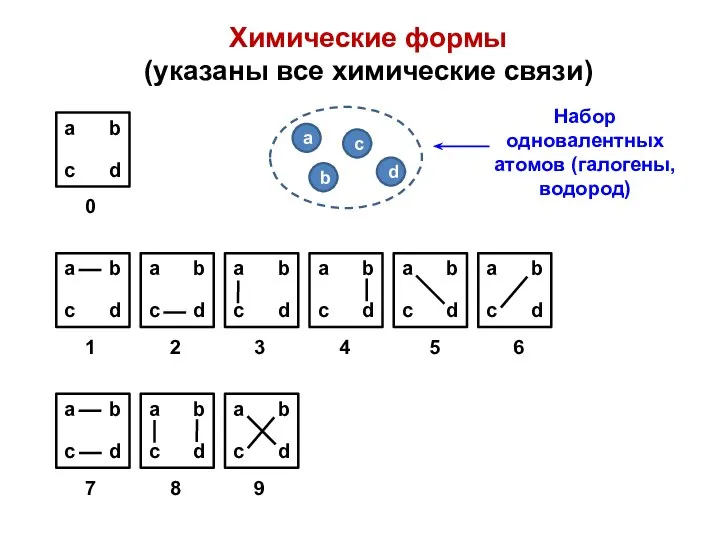
- 13. Химические формы (указаны все химические связи)
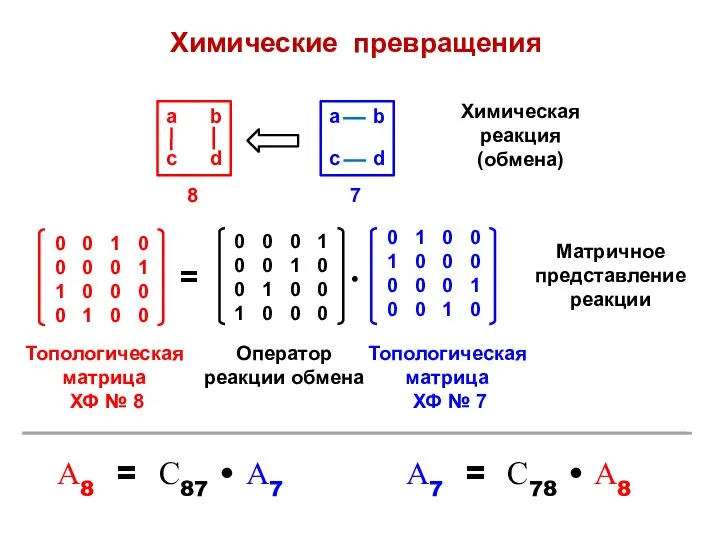
- 14. Химические превращения Химическая реакция (обмена) Матричное представление реакции Оператор реакции обмена А7 = С78 • А8
- 15. В совокупности из 10 химических форм возможно 90 химических реакций (или 45 двусторонних) Для записи этих
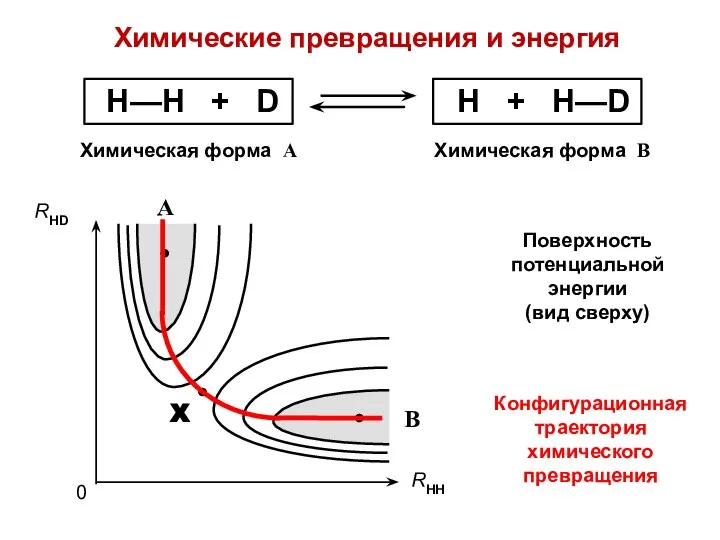
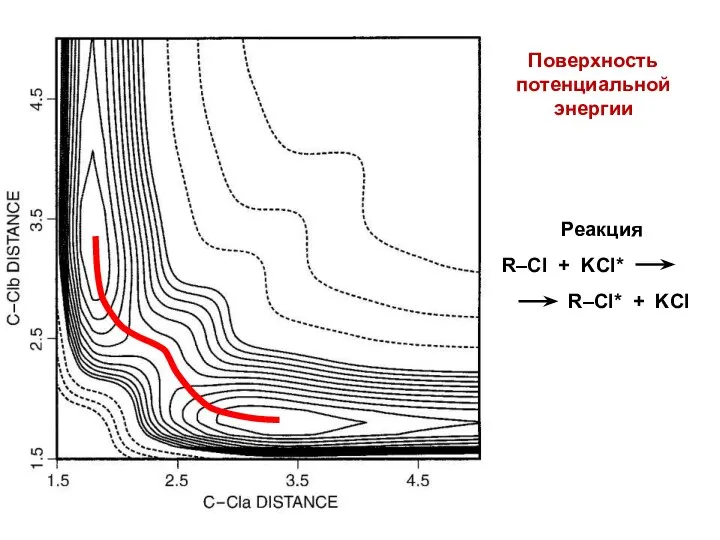
- 18. Химические превращения и энергия Конфигурационная траектория химического превращения Поверхность потенциальной энергии (вид сверху)
- 19. Поверхность потенциальной энергии
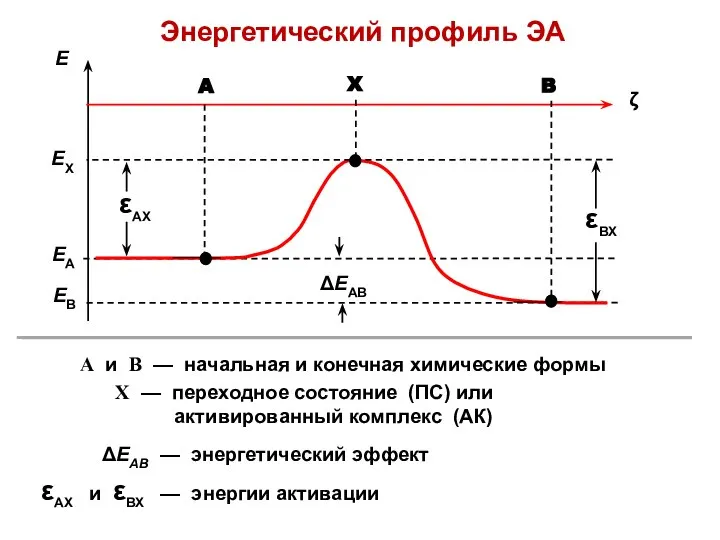
- 21. Энергетический профиль ЭА А и В — начальная и конечная химические формы ΔЕАВ — энергетический эффект
- 22. Константа равновесия Константы скорости
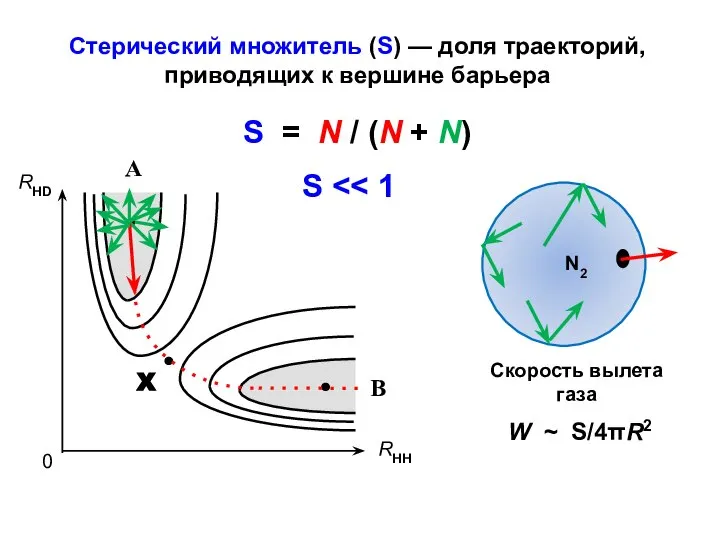
- 23. Стерический множитель (S) — доля траекторий, приводящих к вершине барьера S = N / (N +
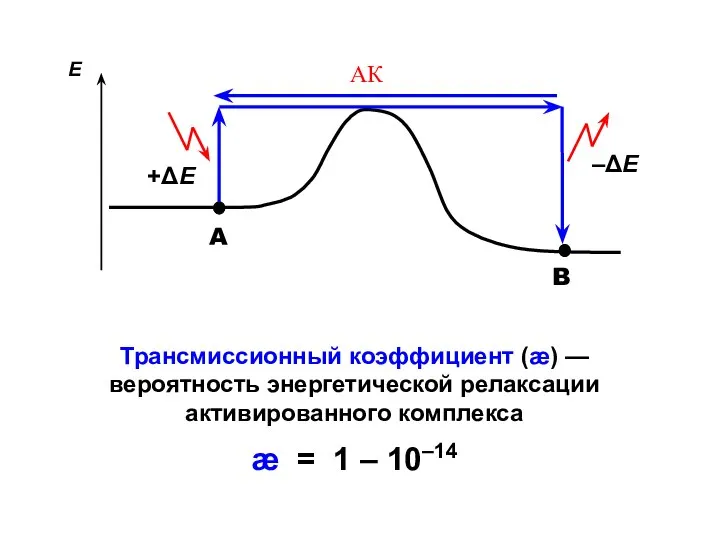
- 24. Трансмиссионный коэффициент (æ) — вероятность энергетической релаксации активированного комплекса æ = 1 – 10–14
- 25. Цель: оценка высоты потенциального барьера, разделяющего исходную и конечую химические формы (энергии АК). Два типа задач:
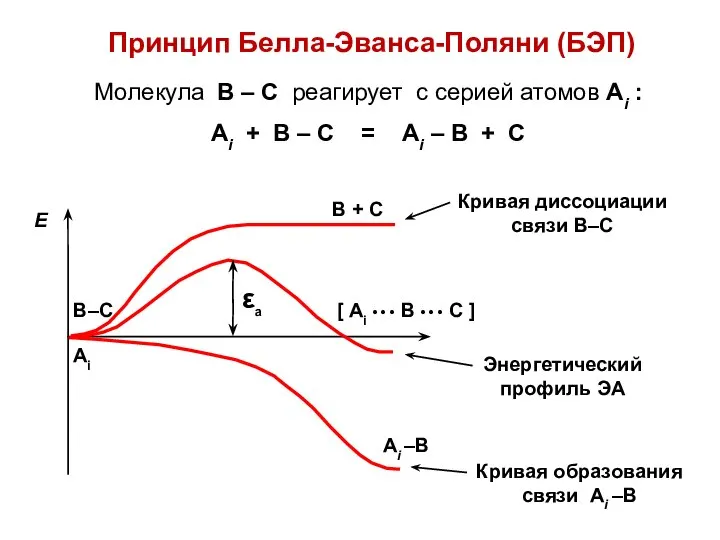
- 26. Принцип Белла-Эванса-Поляни (БЭП) Молекула В – С реагирует с серией атомов Аi : Аi + В
- 27. При постоянной верхней кривой, описывающей разрывающуюся связь, величина энергии активации будет тем меньше, чем ниже проходит
- 28. Для газофазных реакций присоединения-элиминирования имеют место соотношения: εа = 48 + 0,25 ΔH (элиминирование) εа =
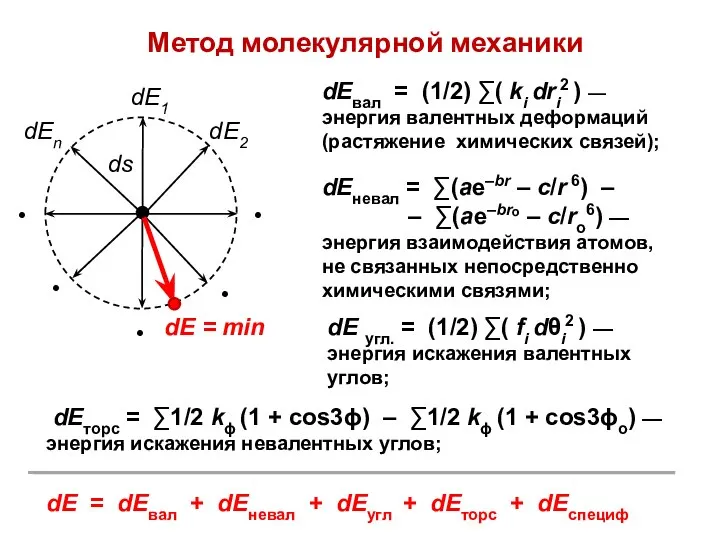
- 29. Метод молекулярной механики dЕвал = (1/2) ∑( ki dri2 ) — энергия валентных деформаций (растяжение химических
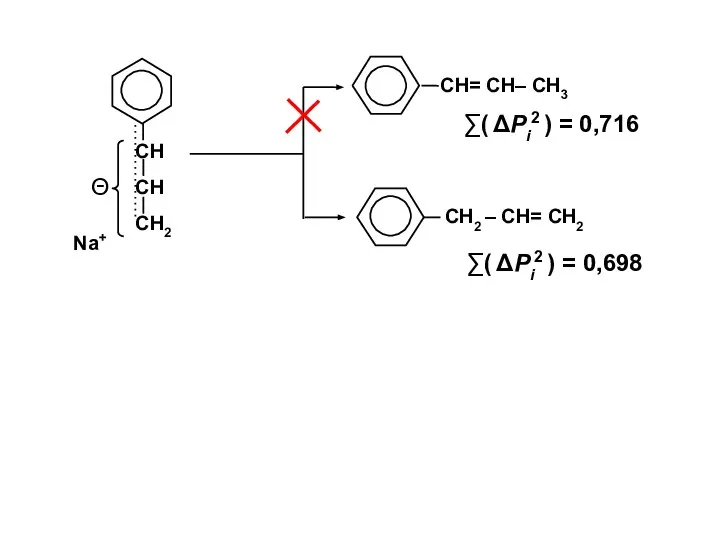
- 30. R–Br + Br*– ⎯⎯→ RBr* + Br– Энергия активации для реакции замещения ∑( ΔPi2 ) =
- 31. Θ
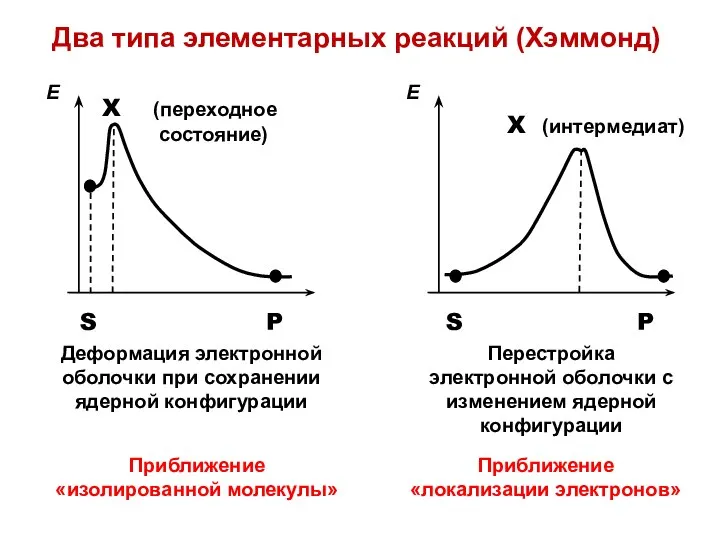
- 32. Два типа элементарных реакций (Хэммонд)
- 33. Приближение «изолированной молекулы» δEэл ~ 〈ni 〉 δαi + (1/2) πii (δαi)2 〈ni 〉 — средняя
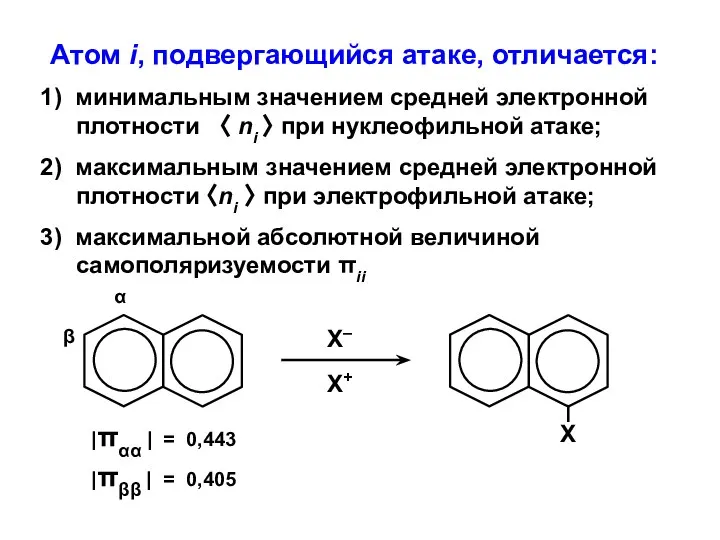
- 34. Атом i, подвергающийся атаке, отличается: 1) минимальным значением средней электронной плотности 〈 ni 〉 при нуклеофильной
- 36. δEэл ~ 2 (1,73 – Fi ) δβ δβ — изменение резонансного интеграла для связей атакуемого
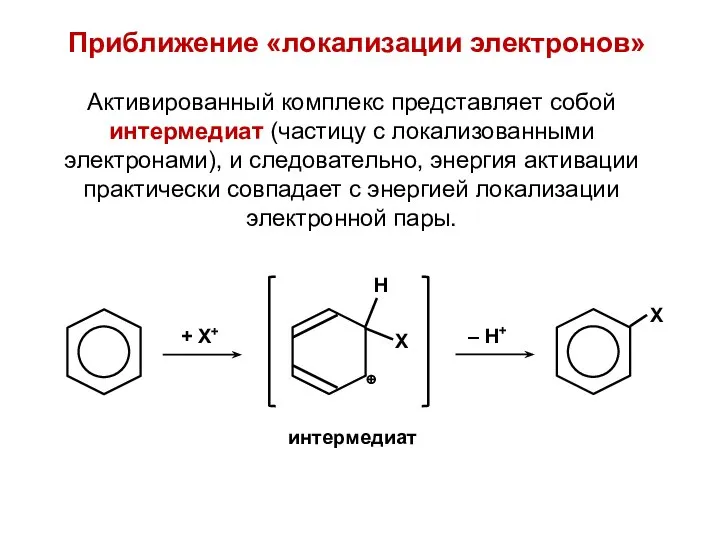
- 38. Приближение «локализации электронов» Активированный комплекс представляет собой интермедиат (частицу с локализованными электронами), и следовательно, энергия активации
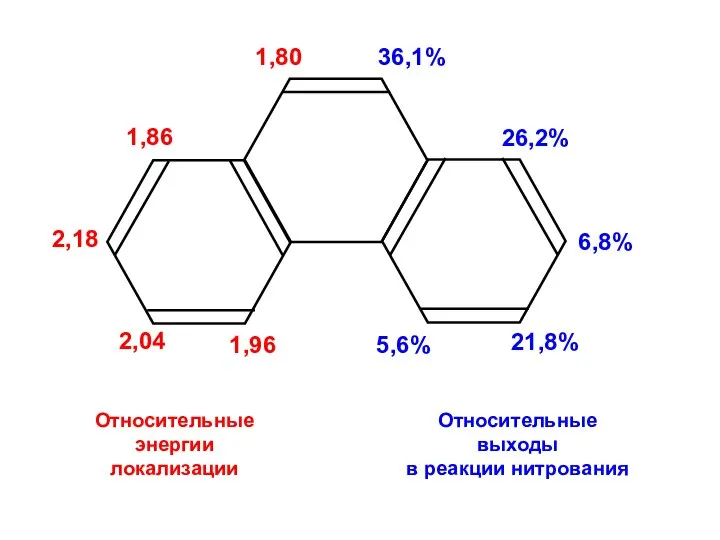
- 39. Относительные энергии локализации Относительные выходы в реакции нитрования
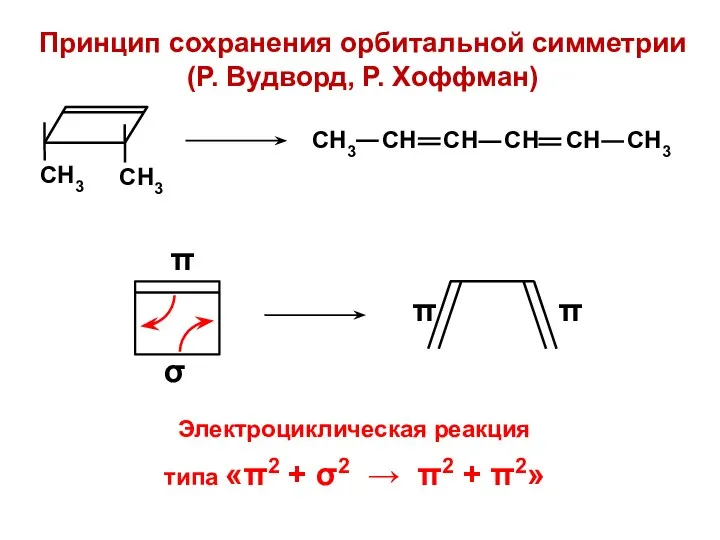
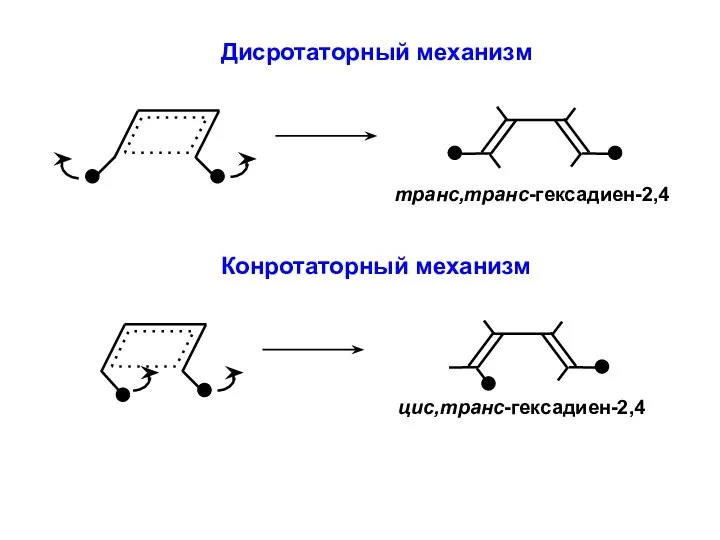
- 40. Принцип сохранения орбитальной симметрии (Р. Вудворд, Р. Хоффман) Электроциклическая реакция типа «π2 + σ2 → π2
- 41. Дисротаторный механизм
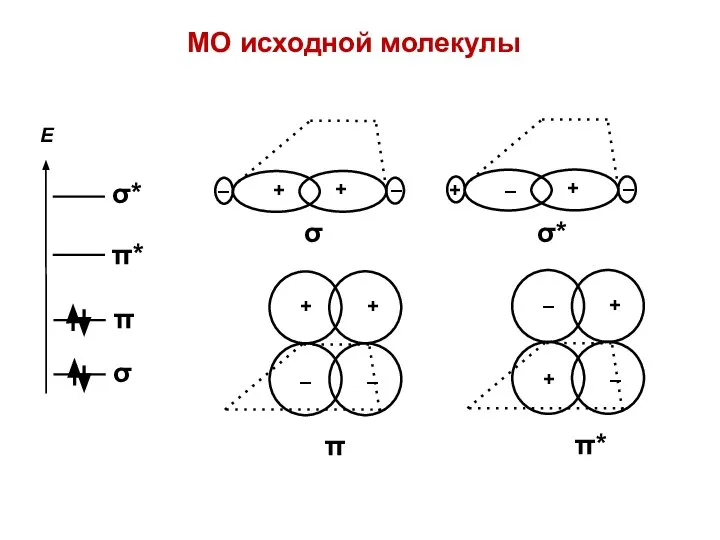
- 42. + – σ МО исходной молекулы
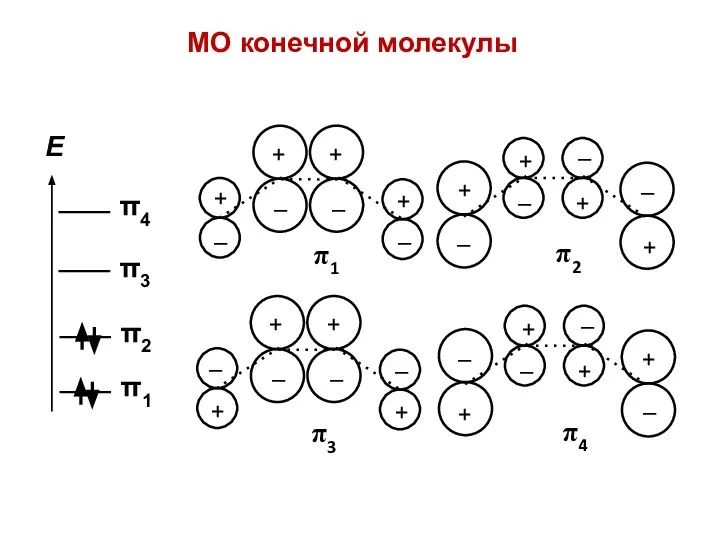
- 43. МО конечной молекулы
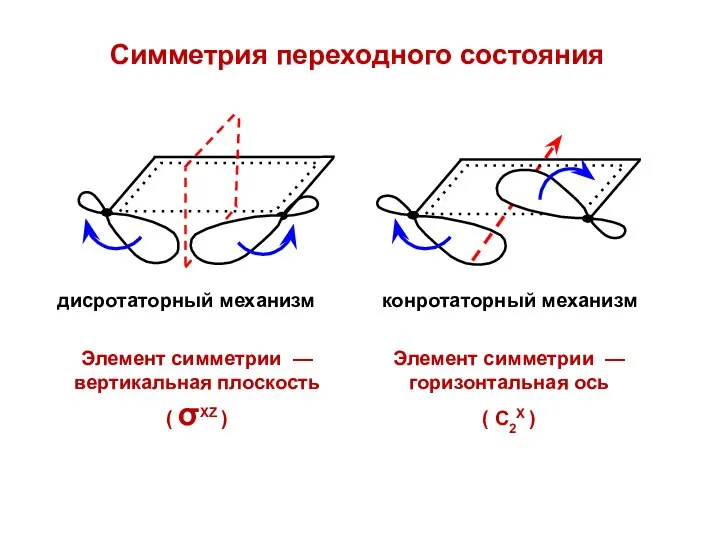
- 44. Симметрия переходного состояния
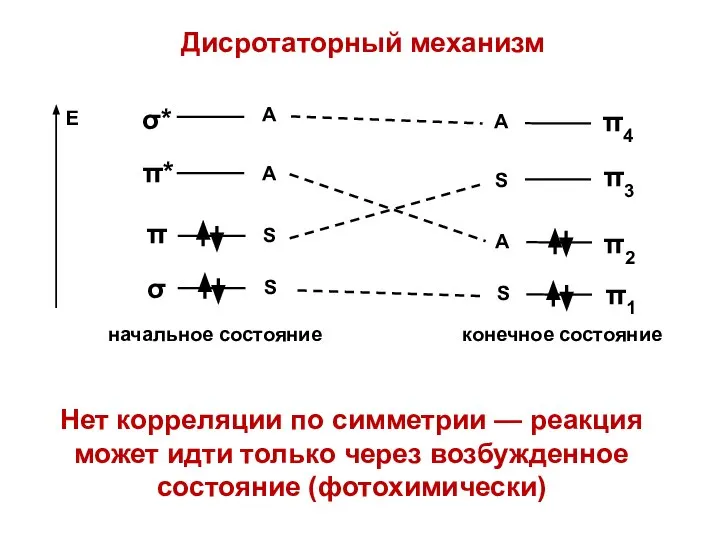
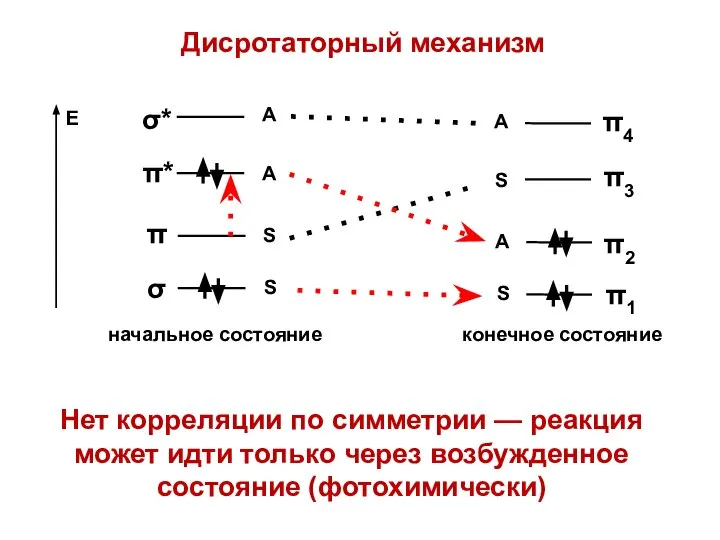
- 45. Дисротаторный механизм Нет корреляции по симметрии — реакция может идти только через возбужденное состояние (фотохимически)
- 46. Дисротаторный механизм Нет корреляции по симметрии — реакция может идти только через возбужденное состояние (фотохимически)
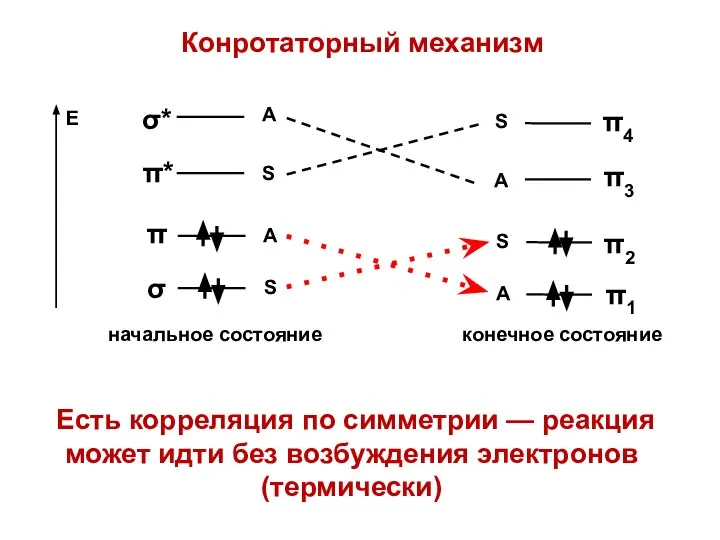
- 47. Конротаторный механизм Есть корреляция по симметрии — реакция может идти без возбуждения электронов (термически)
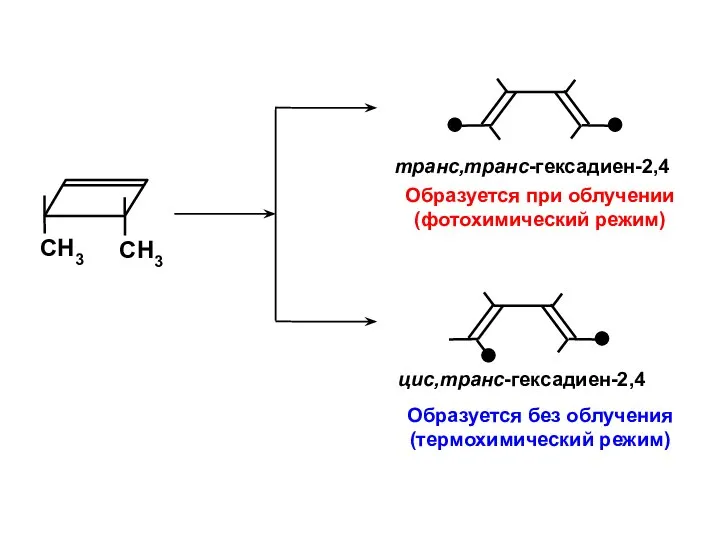
- 48. Образуется при облучении (фотохимический режим) Образуется без облучения (термохимический режим)
- 50. Скачать презентацию















 Політологія як наука. Макс Вебер (1864-1920 рр.)
Політологія як наука. Макс Вебер (1864-1920 рр.) Формы организации физкультурной деятельности дошкольников
Формы организации физкультурной деятельности дошкольников Стилі плавання
Стилі плавання Ишморатова Венера
Ишморатова Венера Виктор Николаевич Сорока-Россинский
Виктор Николаевич Сорока-Россинский Элементы программы на языке С
Элементы программы на языке С Internet and Java Foundations, Programming and Practice
Internet and Java Foundations, Programming and Practice Электронно – лучевая трубка Работу выполнили: Ученики 10«А» класса МБОУ СОШ №1 Г. Оханска Владислав Аликин и Тимошков Михаил 2014
Электронно – лучевая трубка Работу выполнили: Ученики 10«А» класса МБОУ СОШ №1 Г. Оханска Владислав Аликин и Тимошков Михаил 2014 Черта сверху над соответствующей микроскопической величиной означает ее среднее значение.
Черта сверху над соответствующей микроскопической величиной означает ее среднее значение. Реляционная модель данных
Реляционная модель данных
 Использование текстовых файлов в Паскале
Использование текстовых файлов в Паскале Государство древних майя
Государство древних майя МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ЭКОНОМИЧЕСКИХ СИСТЕМ член-корр. РАН И.Г. Поспелов, ВЦ РАН, отдел математического моделирования э
МАТЕМАТИЧЕСКОЕ МОДЕЛИРОВАНИЕ ЭКОНОМИЧЕСКИХ СИСТЕМ член-корр. РАН И.Г. Поспелов, ВЦ РАН, отдел математического моделирования э Режимы работы и требования к устойчивости энергосистем
Режимы работы и требования к устойчивости энергосистем Анна Степановна Демидова
Анна Степановна Демидова Найбільша студентська програма у світі, що охоплює понад 38,000 студентів з 1,500 університетів Students In Free Enterprise (SIFE) Підтримується підпр
Найбільша студентська програма у світі, що охоплює понад 38,000 студентів з 1,500 університетів Students In Free Enterprise (SIFE) Підтримується підпр Презентация "Кристоф Виллибальд Глюк" - скачать презентации по МХК
Презентация "Кристоф Виллибальд Глюк" - скачать презентации по МХК Storytelling – искусство рассказывать истории
Storytelling – искусство рассказывать истории В бескрайнем море книг и журналов. 8 класс
В бескрайнем море книг и журналов. 8 класс Трудовое право
Трудовое право Техника продаж
Техника продаж Презентация "Кляксография и Монотипия" - скачать презентации по МХК
Презентация "Кляксография и Монотипия" - скачать презентации по МХК Презентация Методы воспитательной работы
Презентация Методы воспитательной работы Георгий Яковлевич Седов - уроженец земли донецкой
Георгий Яковлевич Седов - уроженец земли донецкой Александр Мень
Александр Мень Конституція України – Основний Закон держави
Конституція України – Основний Закон держави Маркировка куриных яиц
Маркировка куриных яиц  Работа командира идв после получения задачи
Работа командира идв после получения задачи