Содержание
- 2. План изучения нового материала: 1.Состав и строение белковой молекулы. 2.Прстранственная структура белка. 3.Теория Эмиля Фишера. 4
- 5. Немецкий химик Эмиль Фишер создал пептидную теорию, во многом подтвердившуюся практически и получившую всеобщее признание еще
- 6. Молекула белка – макромолекула ( греч. «Макрос» - большой, гигантский), обладает большой молекулярной массой Сравните: молекулярная
- 7. В клетке бактерий кишечной палочки - 5 тыс. молекул органических соединений, из них – 3 тыс.
- 8. Белки – это нерегулярные полимеры, мономерами которых являются аминокислоты в природе существует около 100 α-аминокислот, в
- 9. Состав и классификация белков По составу различают: протеины, состоящие только аминокислот, протеиды – содержащие небелковую часть,
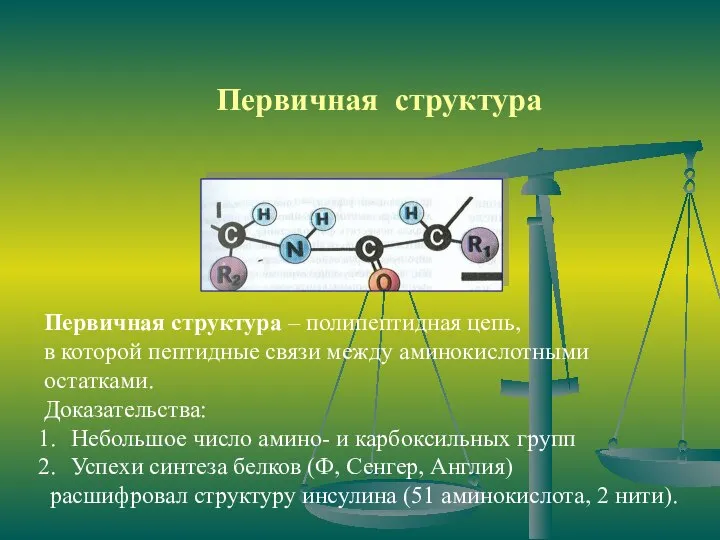
- 10. Первичная структура Первичная структура – полипептидная цепь, в которой пептидные связи между аминокислотными остатками. Доказательства: Небольшое
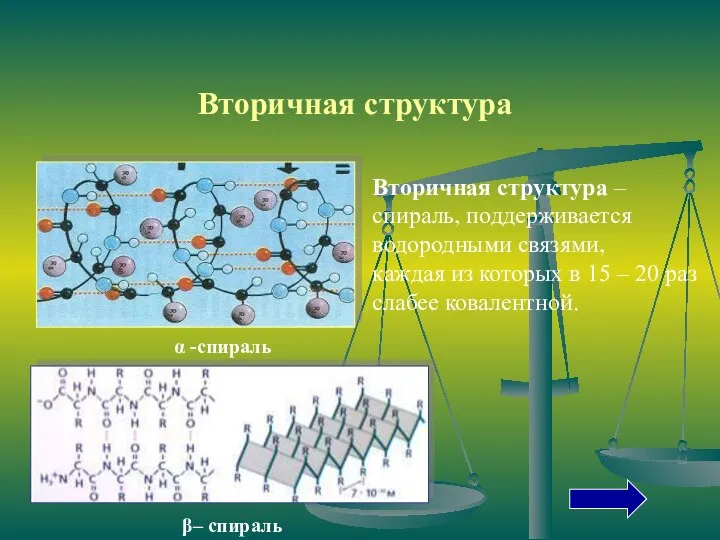
- 11. Вторичная структура – спираль, поддерживается водородными связями, каждая из которых в 15 – 20 раз слабее
- 12. В образовании третичной структуры большая роль принадлежит радикалам. За счёт которых образуются дисульфидные мостики, сложноэфирные связи,
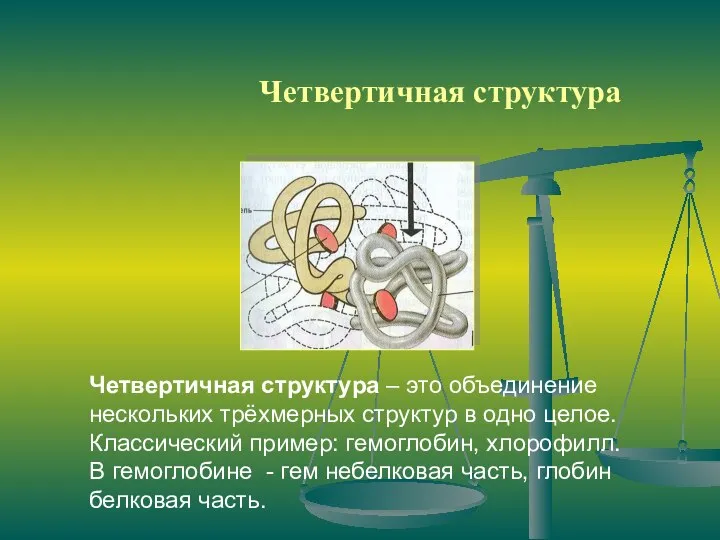
- 13. Четвертичная структура Четвертичная структура – это объединение нескольких трёхмерных структур в одно целое. Классический пример: гемоглобин,
- 20. Скачать презентацию














 Законодательная база в области семеноводства. Посевные качества семян. Требования стандарта к посевному материалу
Законодательная база в области семеноводства. Посевные качества семян. Требования стандарта к посевному материалу Семейство злаков Составитель Большаков С. В.
Семейство злаков Составитель Большаков С. В. ЧТО? ГДЕ? КОГДА? Викторина по биологии и географии
ЧТО? ГДЕ? КОГДА? Викторина по биологии и географии Органоиды клетки
Органоиды клетки Витамины
Витамины Тема урока Способы размножения животных. Оплодотворение.
Тема урока Способы размножения животных. Оплодотворение. Животные из Красной книги
Животные из Красной книги Презентация на тему Чешуекрылые насекомые
Презентация на тему Чешуекрылые насекомые  Молекулярная организация гена
Молекулярная организация гена Вирусы – неклеточная форма жизни
Вирусы – неклеточная форма жизни Презентация на тему "Тип Пластинчатые, тип Губки" - скачать презентации по Биологии
Презентация на тему "Тип Пластинчатые, тип Губки" - скачать презентации по Биологии Надкласс рыбы. Общая характеристика. Внешнее строение рыб
Надкласс рыбы. Общая характеристика. Внешнее строение рыб Среда обитания животных и растений
Среда обитания животных и растений «КОШКИ» пособие для учащихся по предмету «Окружающий мир»
«КОШКИ» пособие для учащихся по предмету «Окружающий мир»  ЕСТЬ ЛИ ЖИЗНЬ НА ПЛАНЕТАХ В СОЛНЕЧНОЙ СИСТЕМЕ?
ЕСТЬ ЛИ ЖИЗНЬ НА ПЛАНЕТАХ В СОЛНЕЧНОЙ СИСТЕМЕ?  Анализаторы. Органы чувств.
Анализаторы. Органы чувств.  Чёрный аист
Чёрный аист Паразитические черви
Паразитические черви  Презентація з Медицини на тему: “кровотеча та надання першої допомоги при кровотечі”
Презентація з Медицини на тему: “кровотеча та надання першої допомоги при кровотечі”  Общая вирусология. Бактериофаги
Общая вирусология. Бактериофаги Класс птицы
Класс птицы Урок по биологии «Шляпочные грибы» 6 класс Модульная технология Автор Бабинова О.В. учитель биологии сш № 16 г. Асбеста
Урок по биологии «Шляпочные грибы» 6 класс Модульная технология Автор Бабинова О.В. учитель биологии сш № 16 г. Асбеста Особенности клеточного строения организмов
Особенности клеточного строения организмов Укусы животных
Укусы животных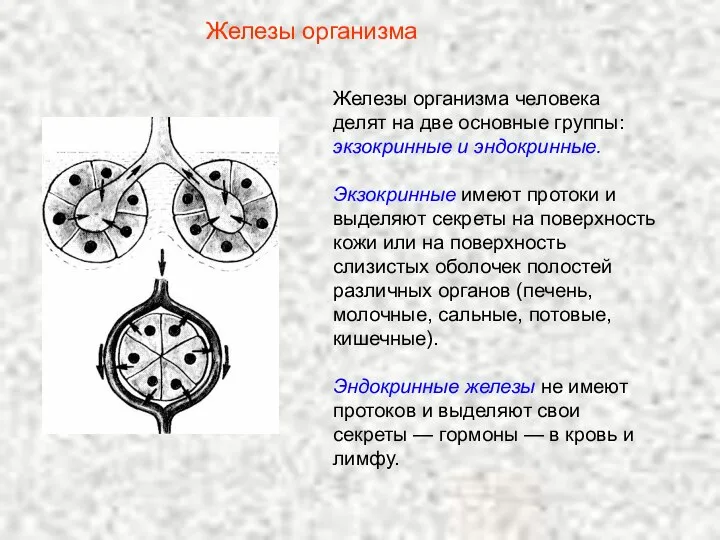 Железы организма
Железы организма Клещи. Основные виды
Клещи. Основные виды Общие вопросы анатомии и физиологии сердечно-сосудистой системы
Общие вопросы анатомии и физиологии сердечно-сосудистой системы Круглые черви
Круглые черви