Биологическое окисление 2. Оксигеназные, пероксидазные и радикальные пути использования кислорода. (Лекция 5)
Содержание
- 2. план Оксигеназные реакции Монооксигеназные реакции Диоксигеназные реакции. Радикальные и пероксидазные реакции
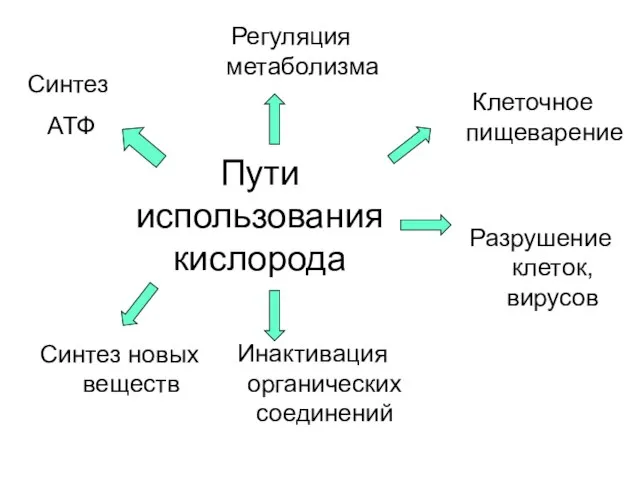
- 3. Пути использования кислорода Синтез АТФ Синтез новых веществ Инактивация органических соединений Разрушение клеток, вирусов Клеточное пищеварение
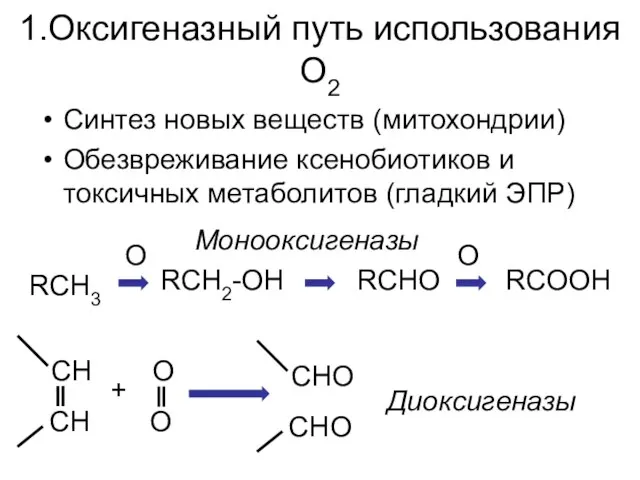
- 4. 1.Оксигеназный путь использования О2 Синтез новых веществ (митохондрии) Обезвреживание ксенобиотиков и токсичных метаболитов (гладкий ЭПР) RCH3
- 5. Ксенобиотики – чужеродные для организма вещества, которые он не может использовать для собственных нужд. Полезные –
- 6. химические элементы (ртуть, свинец, кадмий, др.); радионуклиды; Пестициды; нитраты, нитриты и нитрозосоединения; вещества, применяемые в животноводстве;
- 7. Биотрансформация Биотрансформация (Bios - жизнь, transformatio - превращение, видоизменение) - совокупность химических превращений ксенобиотиков (xenos -
- 8. Локализация биотрансформации 90-95% всех чужеродных липофильных веществ подвергается биотрансформации в гладком эндоплазматическом ретикулуме клеток печени. 5-10%
- 9. Виды биотрансформации Метаболическая трансформация Реакции - окисления - восстановления - гидролиза образуются функциональные группы -ОН, -СООН,
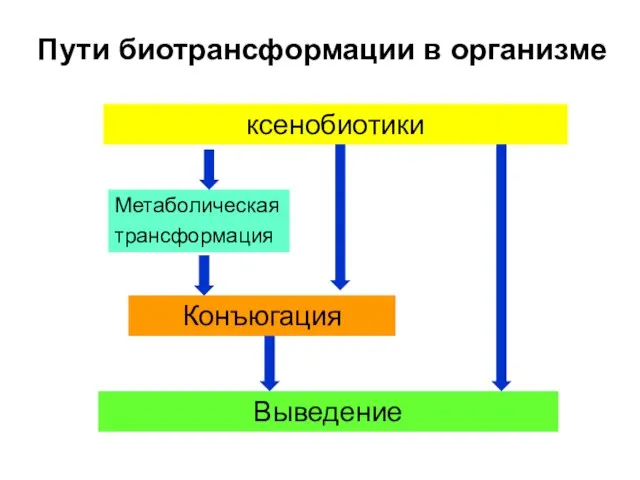
- 10. Пути биотрансформации в организме Метаболическая трансформация ксенобиотики Конъюгация Выведение
- 11. Монооксигеназные реакции: включение в молекулу одного атома кислорода
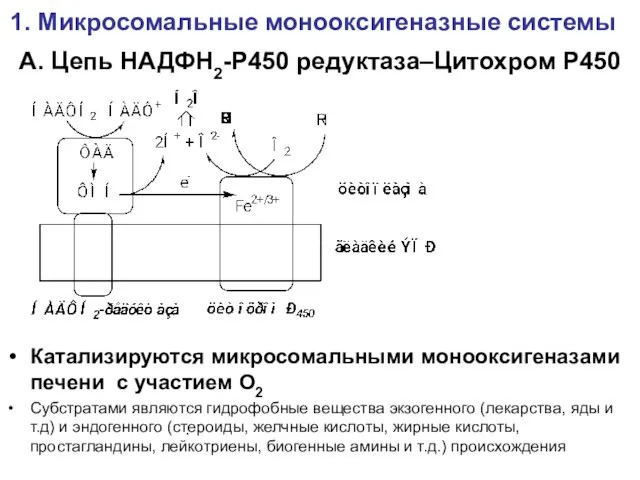
- 12. А. Цепь НАДФН2-Р450 редуктаза–Цитохром Р450 Катализируются микросомальными монооксигеназами печени с участием О2 Субстратами являются гидрофобные вещества
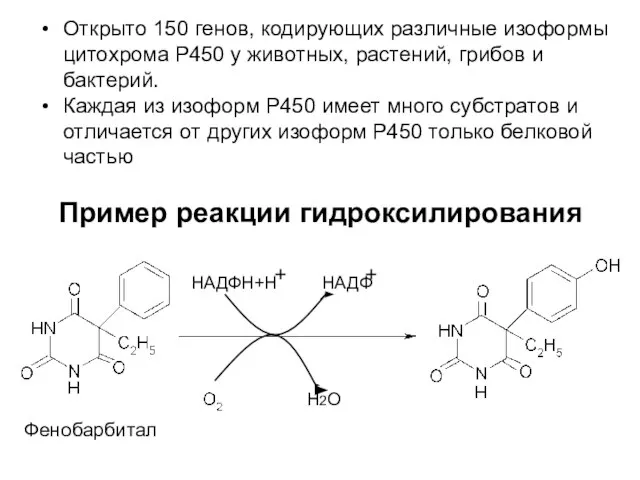
- 13. Пример реакции гидроксилирования Фенобарбитал Н2О НАДФН+Н НАДФ Открыто 150 генов, кодирующих различные изоформы цитохрома Р450 у
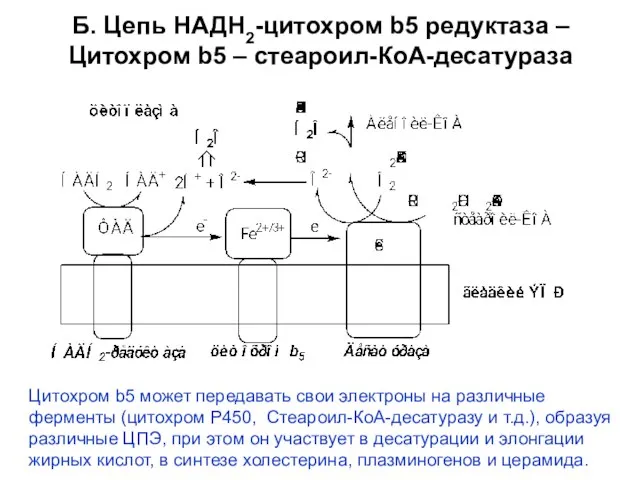
- 14. Б. Цепь НАДН2-цитохром b5 редуктаза – Цитохром b5 – стеароил-КоА-десатураза Цитохром b5 может передавать свои электроны
- 15. Биологическая роль микросомального окисления: Инактивация ксенобиотиков, т.е. уменьшение их фармакологической активности и токсичности. Повышение активности ксенобиотиков
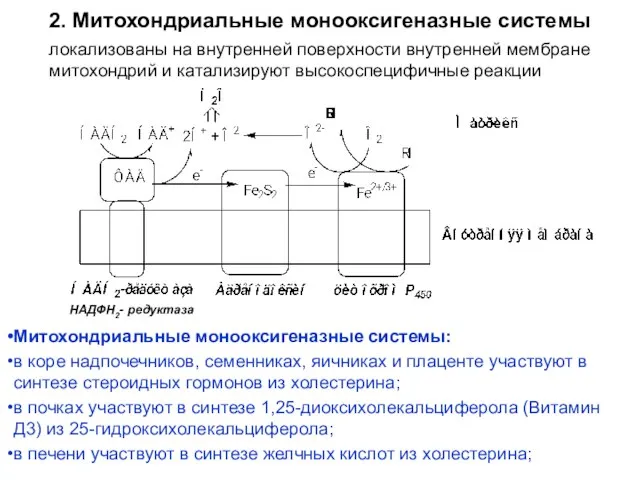
- 16. 2. Митохондриальные монооксигеназные системы локализованы на внутренней поверхности внутренней мембране митохондрий и катализируют высокоспецифичные реакции Митохондриальные
- 17. Факторы, влияющие на активность ферментов биотрансформации Есть соединения, которые индуцируют скорость синтеза микросомальных ферментов – барбитураты,
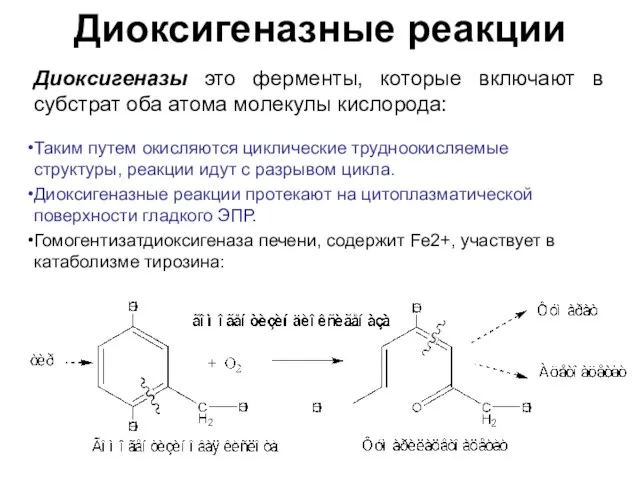
- 18. Диоксигеназные реакции Диоксигеназы это ферменты, которые включают в субстрат оба атома молекулы кислорода: Таким путем окисляются
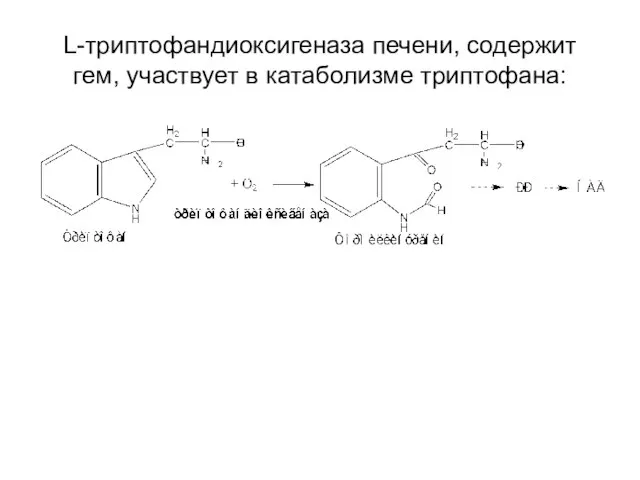
- 19. L-триптофандиоксигеназа печени, содержит гем, участвует в катаболизме триптофана:
- 20. ПЕРОКСИДАЗНЫЙ И РАДИКАЛЬНЫЙ ПУТИ ИСПОЛЬЗОВАНИЯ КИСЛОРОДА Химические соединения, в составе которых кислород имеет промежуточную степень окисления,
- 21. Образование АФК Соединения О + высокая энергия АФК Рентген УФИ Температура Гомолитический разрыв связей под действием
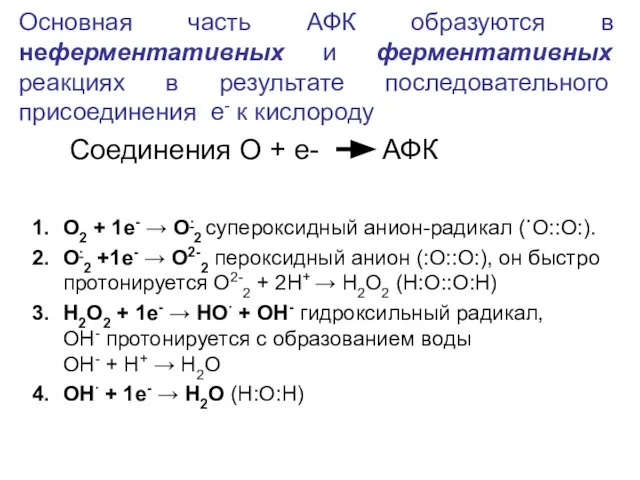
- 22. Основная часть АФК образуются в неферментативных и ферментативных реакциях в результате последовательного присоединения е- к кислороду
- 23. Неферментативные реакции образования АФК Электроны, необходимые для образования АФК могут давать: 1). Металлы переменной валентности. Hb(Fe2+)
- 24. Ферментативные реакции образования АФК В ЦОФ: Q + 1е- → НQ∙ (семихинон), при реоксигенации ишемических тканей
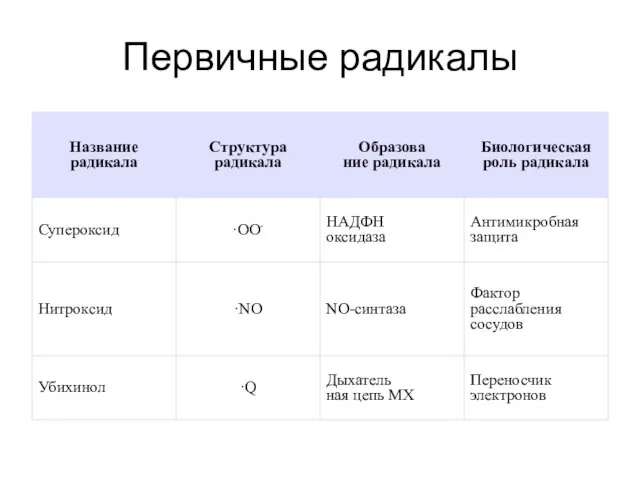
- 25. Первичные радикалы
- 26. Вторичные радикалы
- 27. Использование АФК в организме 1. Иммунная система. АФК используются фагоцитами - тканевыми макрофагами, моноцитами и гранулоцитами
- 28. Повреждающее действие АФК в организме Радикалы гидроксила химически исключительно активны и вызывают повреждение белков, нуклеиновых кислот
- 29. Субстраты ПОЛ – полиненасыщенные ЖК Линоленовая кислота — CH3(CH2CH=CH)3(CH2)7COOH. Арахидоновая кислота, витамин F, CH3(CH2)4(CH=CHCH2)4(CH2)2COOH и др.
- 32. Антиоксидантная защита В нормальных условиях процесс СРО находится под строгим контролем ферментативных и неферментативных систем клетки,
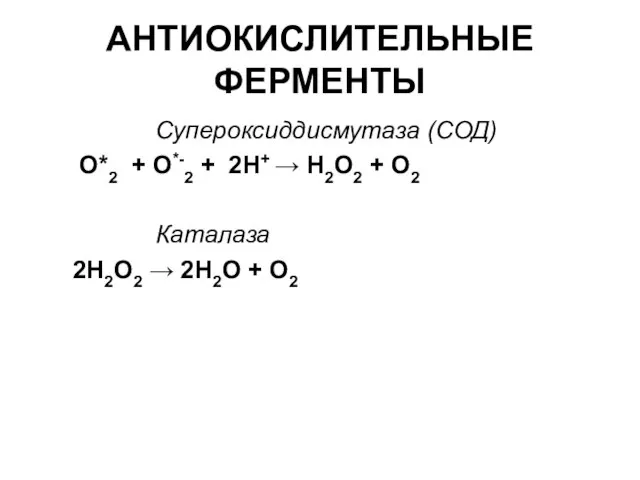
- 33. АНТИОКИСЛИТЕЛЬНЫЕ ФЕРМЕНТЫ Супероксиддисмутаза (СОД) О*2 + О*-2 + 2Н+ → Н2О2 + О2 Каталаза 2Н2О2 →
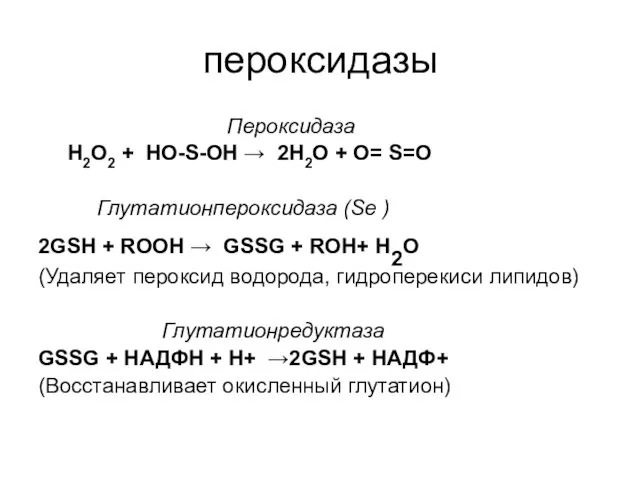
- 34. пероксидазы Пероксидаза Н2О2 + НО-S-ОН → 2Н2О + О= S=О Глутатионпероксидаза (Se ) 2GSH + ROOH
- 35. Фосфолипаза в мембране отщепляет от фосфолипидов окисленные жирные кислоты, содержащие гидроперекисную группу (ROOH), тем самым разрушаются
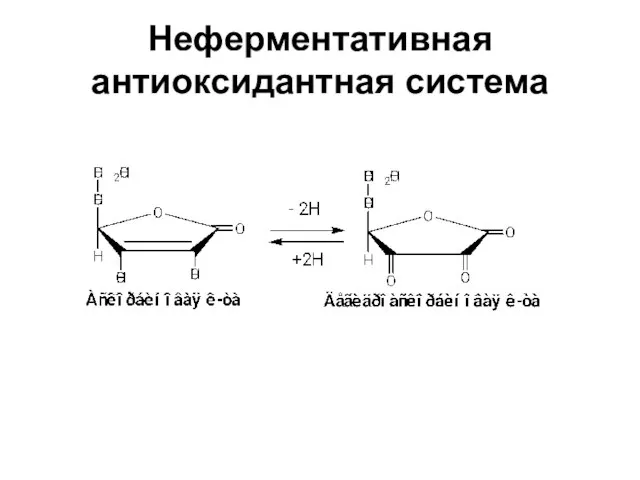
- 36. Неферментативная антиоксидантная система
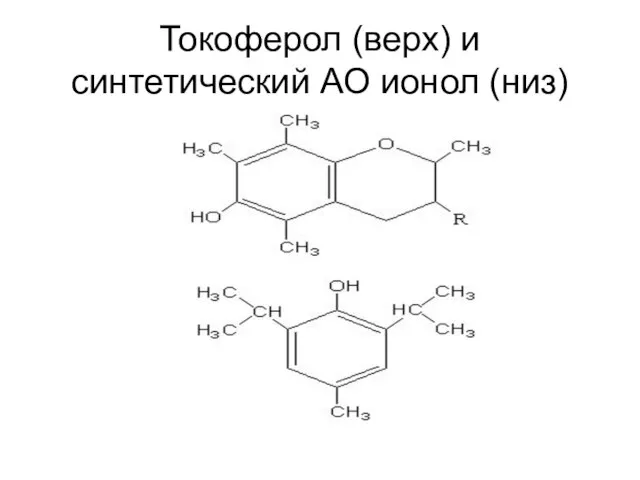
- 37. Токоферол (верх) и синтетический АО ионол (низ)
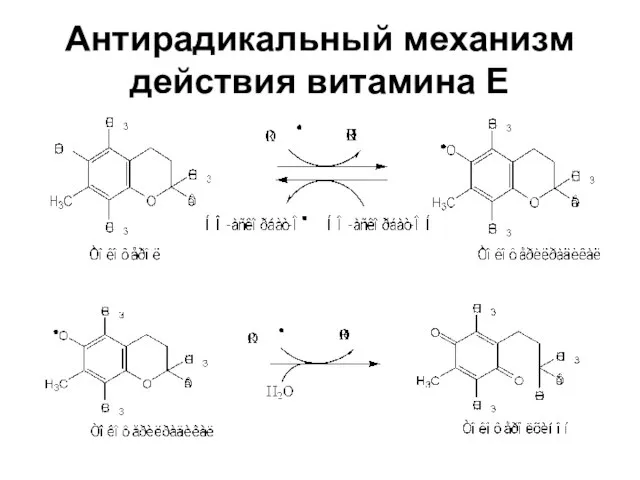
- 38. Антирадикальный механизм действия витамина Е
- 39. Антиоксиданты крови и цитоплазмы Церулоплазмин (плазма крови) -окисляет Fe2+ до Fe3+ молекулярным кислородом Апо-белок трансферрина (плазма
- 40. Глутатион- восстановает пероксиды Аскорбиновая кислота - регенерирует окисленные токоферол и убихинон Глутатионредуктаза - восстанавливает окисленный глутатион
- 42. Скачать презентацию























 Контрольные микропрепараты. Пищеварительная система 1
Контрольные микропрепараты. Пищеварительная система 1 Презентация на тему "Как долгое время просидеть за компьютером, не ухудшая зрение" - скачать презентации по Биологии
Презентация на тему "Как долгое время просидеть за компьютером, не ухудшая зрение" - скачать презентации по Биологии Профілактика інфекційних захворювань Бартош Наталії 11-А клас
Профілактика інфекційних захворювань Бартош Наталії 11-А клас  Классификация экосистем
Классификация экосистем Форми поведінки тварин
Форми поведінки тварин Кафедра нормальной физиологии КрасГМУ ЭРИТРОЦИТЫ
Кафедра нормальной физиологии КрасГМУ ЭРИТРОЦИТЫ  Газообмен в легких и тканях. Дыхательные движения и их регуляция
Газообмен в легких и тканях. Дыхательные движения и их регуляция Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс Презентация по биологии
Роль гормонов в обмене веществ, росте и развитии организма биология 8 класс Презентация по биологии  Плоды - яблоко, костянка, сборная семянка, сборная костянка. Плоды - яблоко, костянка, сборная семянка, сборная костянка. В это семей
Плоды - яблоко, костянка, сборная семянка, сборная костянка. Плоды - яблоко, костянка, сборная семянка, сборная костянка. В это семей Динозавры
Динозавры Сверх организм: муравьи
Сверх организм: муравьи Функции белков. Тема 5
Функции белков. Тема 5 Презентация на тему "Путешествие в мир Простейших" - скачать презентации по Биологии
Презентация на тему "Путешествие в мир Простейших" - скачать презентации по Биологии Презентация на тему "Вид- эволюционная единица, его критерии и структура" - скачать презентации по Биологии
Презентация на тему "Вид- эволюционная единица, его критерии и структура" - скачать презентации по Биологии Клонирование
Клонирование Прокаріоти. Роль прокаріотів в біосфері. Підготувала Учениця 10 класу Сердюк Яна
Прокаріоти. Роль прокаріотів в біосфері. Підготувала Учениця 10 класу Сердюк Яна  Эмбриональное развитие ланцетника (Branchiostoma)
Эмбриональное развитие ланцетника (Branchiostoma) Весенние явления в природе Подмосковья
Весенние явления в природе Подмосковья Животные РА
Животные РА Изучение токсичности тяжелых металлов (на примере медного купороса) с использование флуоресценции микроводорослей
Изучение токсичности тяжелых металлов (на примере медного купороса) с использование флуоресценции микроводорослей Химические элементы в клетках живых организмов
Химические элементы в клетках живых организмов Ведение в курс физиологии. Возбудимые ткани. Биопотенциалы. (Лекция № 1)
Ведение в курс физиологии. Возбудимые ткани. Биопотенциалы. (Лекция № 1) Тестовое задание по теме: «Отдел Цветковые растения (Покрытосеменные)» биология 7 класс Журавлева Люци
Тестовое задание по теме: «Отдел Цветковые растения (Покрытосеменные)» биология 7 класс Журавлева Люци Строение организмов
Строение организмов Genetics. Genotype
Genetics. Genotype Многообразие и значение насекомых в биоценозах
Многообразие и значение насекомых в биоценозах  Новосибирский зоопарк (10 класс)
Новосибирский зоопарк (10 класс) Нуклеиновые кислоты
Нуклеиновые кислоты