Содержание
- 2. Биосинтез белка Сложный многостадийный процесс синтеза полипептидной цепи из аминокислот, происходящий на рибосомах с участием молекул
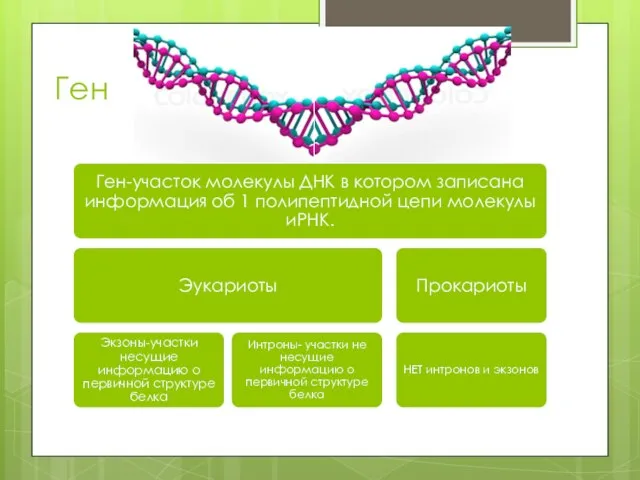
- 3. Ген
- 4. Генетический код Последовательность трёх нуклеотидов, входящих в состав ДНК и кодирующих аминокислоту- триплет. Каждый триплет кодирует
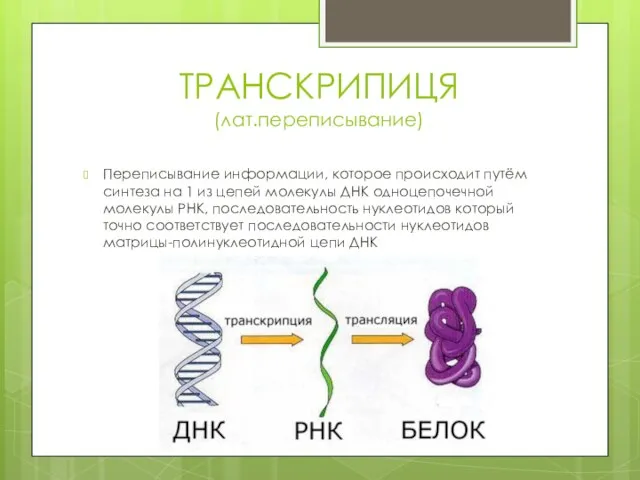
- 5. ТРАНСКРИПИЦЯ (лат.переписывание) Переписывание информации, которое происходит путём синтеза на 1 из цепей молекулы ДНК одноцепочечной молекулы
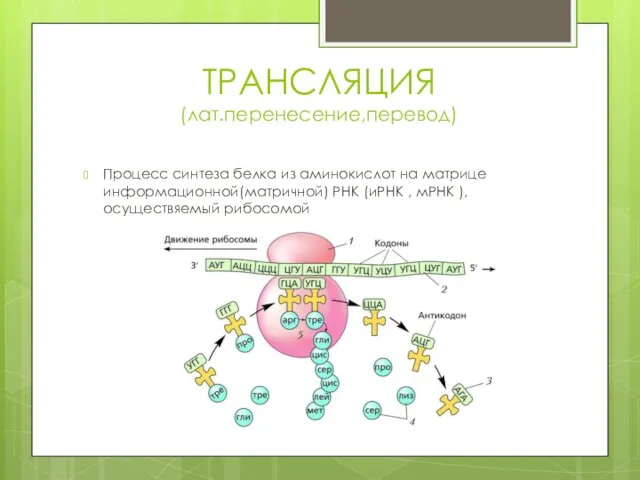
- 7. ТРАНСЛЯЦИЯ (лат.перенесение,перевод) Процесс синтеза белка из аминокислот на матрице информационной(матричной) РНК (иРНК , мРНК ), осуществяемый
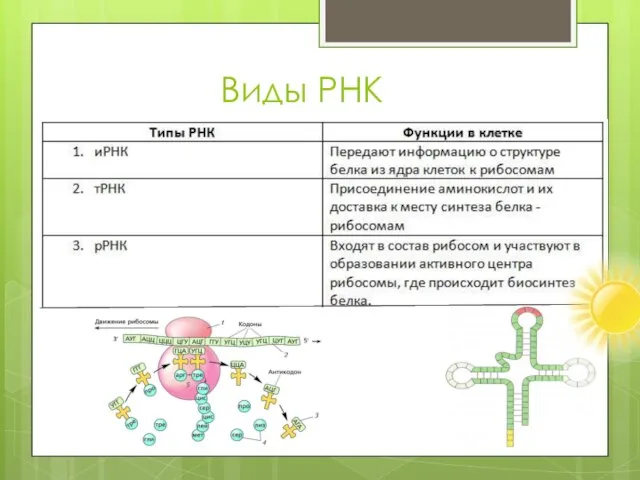
- 8. Виды РНК
- 9. Инициация – начало процесса Это начальная стадия трансляции, в которой малая субъединица рибосомы соединяется с самой
- 10. Элонгация – середина синтеза На этом этапе происходит постепенное наращивание белковой цепочки. Продолжительность элонгации зависит от
- 11. Терминация В дело вступают факторы терминации, которые отделяют готовый белок от рибосомы. Сама органелла может либо
- 12. Белок высокомолекулярные органические вещества, состоящие из альфа-аминокислот, соединённых в цепочку пептидной связью.
- 13. Первичная структура Образуется при последовательности амк и полипептидной цепи Важными особенностями первичной структуры являются консервативные мотивы
- 14. Вторичная структура Образуется при взаимодействии амк с помощью водородных связей и гидрофобных взаимодействий локальное упорядочивание фрагмента
- 15. Третичная структура Образуется при взаимодействий вторичных структур , стабилизируется ковалентными ионными водородными связями и гидрофобными взаимодействиями
- 16. Четвертичная структура Образуется взаимное расположение нескольких полипептидных цепей в составе единого белкового комплекса Надмолекулярные белковые комплексы
- 18. Скачать презентацию











 The nature of life. Cell structure and function
The nature of life. Cell structure and function Биогеоценоз структура - презентации по Биологии
Биогеоценоз структура - презентации по Биологии Видоизменения побегов
Видоизменения побегов Ч. Дарвин и происхождение видов
Ч. Дарвин и происхождение видов КРАСНАЯ КНИГА РЕСПУБЛИКИ КОМИ
КРАСНАЯ КНИГА РЕСПУБЛИКИ КОМИ  Склад крові
Склад крові Домашнее задание Изучить §39 Письменно выполнить задание на стр.189 (таблица)
Домашнее задание Изучить §39 Письменно выполнить задание на стр.189 (таблица)  Презентация на тему Распространенные заболевания человека
Презентация на тему Распространенные заболевания человека Презентация на тему "Про кошек" - скачать презентации по Биологии
Презентация на тему "Про кошек" - скачать презентации по Биологии Презентация на тему Сердечно-сосудистая система
Презентация на тему Сердечно-сосудистая система ВЛИЯНИЕ ПОДКОРМКИ НА РОСТ И РАЗВИТИЕ ЛУКА РЕПЧАТОГО Выполнила: Творогова Елизавета Руководитель: Анисимова Светлан
ВЛИЯНИЕ ПОДКОРМКИ НА РОСТ И РАЗВИТИЕ ЛУКА РЕПЧАТОГО Выполнила: Творогова Елизавета Руководитель: Анисимова Светлан Жасушаның құрылысы
Жасушаның құрылысы Презентация на тему Как живут растения
Презентация на тему Как живут растения  Біологія в ХХІ столітті. Генетика. Штучний геном
Біологія в ХХІ столітті. Генетика. Штучний геном  Жизнедеятельность клетки. Урок биологии в 6 классе
Жизнедеятельность клетки. Урок биологии в 6 классе Интеллектуальный биологический марафон
Интеллектуальный биологический марафон Подготовили: Анастасия Вайтехович, Анастасия Фатина, Светлана Лебедева Ученицы 9 «А» Руководитель: Пашутина Г.А. школы №63
Подготовили: Анастасия Вайтехович, Анастасия Фатина, Светлана Лебедева Ученицы 9 «А» Руководитель: Пашутина Г.А. школы №63 Презентация на тему Различные виды растений
Презентация на тему Различные виды растений Живая и неживая природа зимой
Живая и неживая природа зимой Класс Ракообразные
Класс Ракообразные Презентация на тему "Мхи" - скачать бесплатно презентации по Биологии
Презентация на тему "Мхи" - скачать бесплатно презентации по Биологии Внутреннее строение, размножение и развитие рыб
Внутреннее строение, размножение и развитие рыб Разнообразие животных
Разнообразие животных Паук крестовик – строение и особенности поведения
Паук крестовик – строение и особенности поведения Роль насекомых в природе
Роль насекомых в природе Систематический обзор животного мира. Какие бывают животные?
Систематический обзор животного мира. Какие бывают животные? Віруси: неклітинні форми життя
Віруси: неклітинні форми життя Презентация на тему "Зачёт по теме «Пищеварение»" - скачать презентации по Биологии
Презентация на тему "Зачёт по теме «Пищеварение»" - скачать презентации по Биологии