Содержание
- 2. План лекції 2 Біотехнологія in silico – 2016, 4 курс 1. Базові поняття 2. Історичні, економічні
- 3. Базові поняття 3 Біотехнологія in silico – 2016, 4 курс Генетично модифіковані рослини (ГМР) – це
- 4. Історичні аспекти (1) 4 Біотехнологія in silico – 2016, 4 курс 1982 р. – створено першу
- 5. Історичні аспекти (2) 5 Біотехнологія in silico – 2016, 4 курс Субгенні модифікації Трансгенні модифікації Ген
- 6. Історичні аспекти (3): золотий рис 6 Біотехнологія in silico – 2016, 4 курс 2000 р. –
- 7. 7 Біотехнологія in silico – 2016, 4 курс Історичні аспекти (4): золотий рис 2013 р. –
- 8. 8 Біотехнологія in silico – 2016, 4 курс ГМР у сучасному світі На сьогодні ГМР вирощуються
- 9. 9 Біотехнологія in silico – 2016, 4 курс Вражаючі приклади ГМР Капуста, що виробляє скорпіонову отруту
- 10. Юридичні аспекти питання 10 Біотехнологія in silico – 2016, 4 курс Юридичний статус ГМР істотно відрізняється
- 11. Юридичні аспекти питання: Україна Біотехнологія in silico – 2016, 4 курс 2009 – в Україні введено
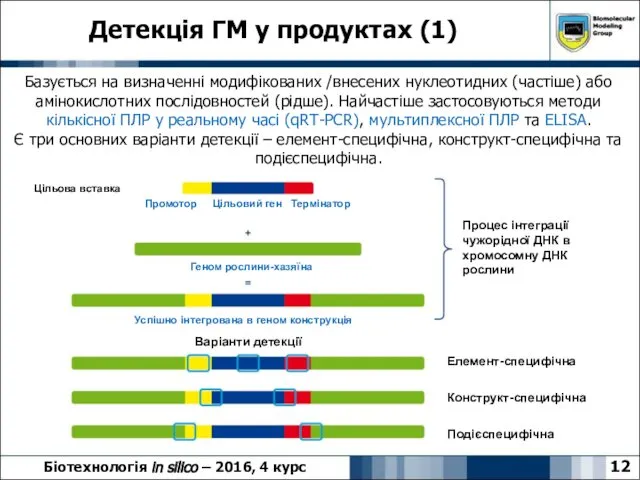
- 12. Детекція ГМ у продуктах (1) Біотехнологія in silico – 2016, 4 курс Елемент-специфічна Конструкт-специфічна Подієспецифічна Процес
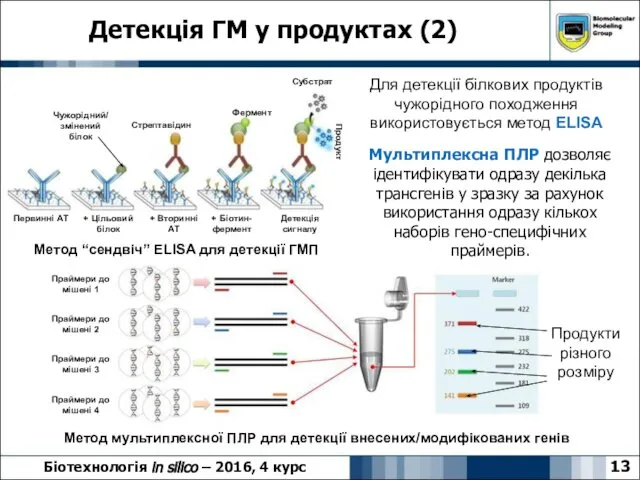
- 13. Детекція ГМ у продуктах (2) 13 Біотехнологія in silico – 2016, 4 курс Мультиплексна ПЛР дозволяє
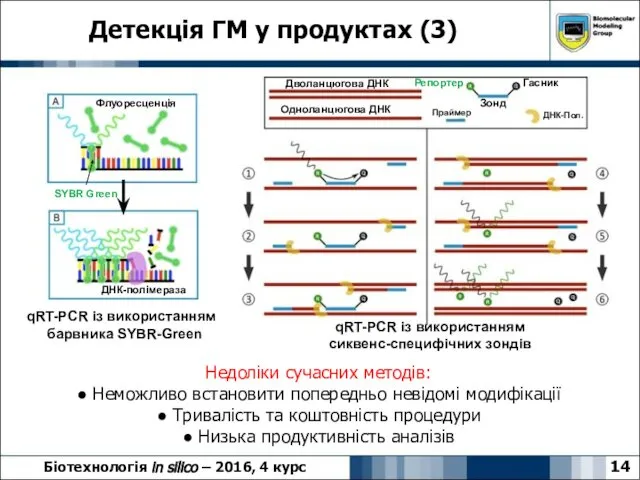
- 14. Детекція ГМ у продуктах (3) 14 Біотехнологія in silico – 2016, 4 курс ДНК-полімераза Флуоресценція SYBR
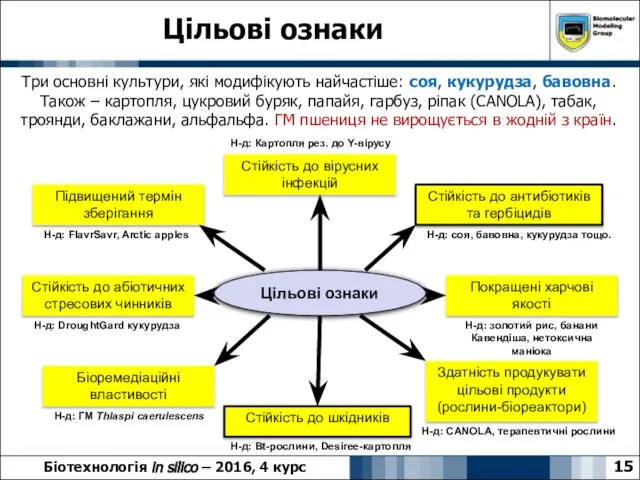
- 15. Цільові ознаки 15 Біотехнологія in silico – 2016, 4 курс Три основні культури, які модифікують найчастіше:
- 16. Чи несуть ГМ продукти загрозу здоров’ю людини? 16 Біотехнологія in silico – 2016, 4 курс За
- 17. Особливості рослин як об’єкта модифікації 17 Біотехнологія in silico – 2016, 4 курс На сьогодні існують
- 18. 18 Методи переносу генів у рослини Біотехнологія in silico – 2016, 4 курс Клітинна стінка слугує
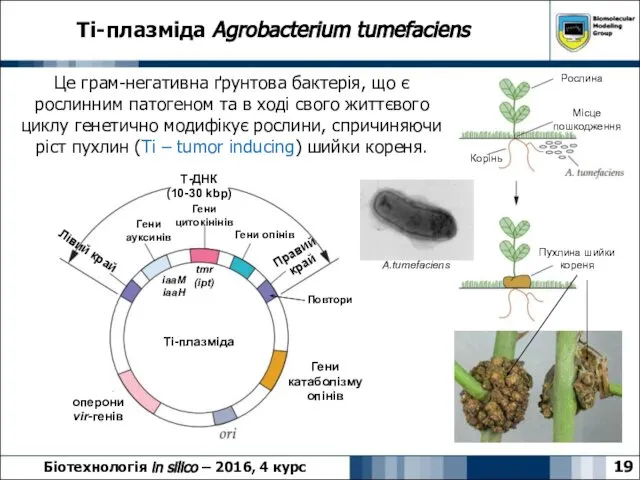
- 19. Ti-плазміда Agrobacterium tumefaciens 19 Біотехнологія in silico – 2016, 4 курс Це грам-негативна ґрунтова бактерія, що
- 20. Механізм трансформації рослинних клітин 20 Біотехнологія in silico – 2016, 4 курс
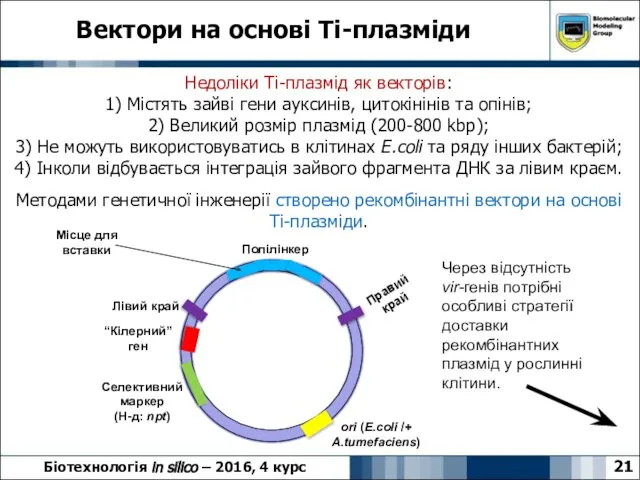
- 21. Вектори на основі Ti-плазміди 21 Біотехнологія in silico – 2016, 4 курс Недоліки Ті-плазмід як векторів:
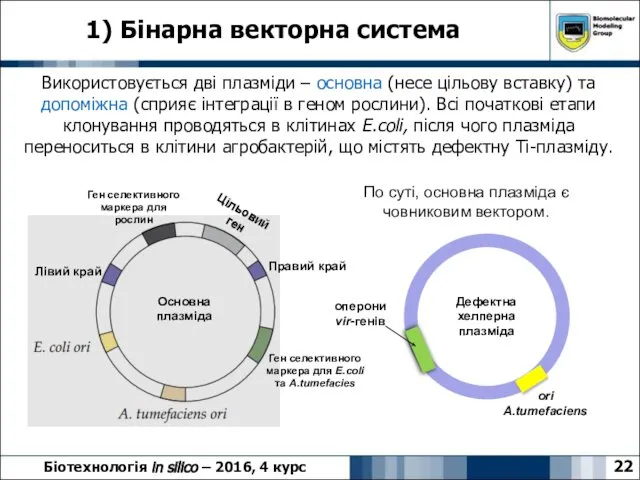
- 22. 1) Бінарна векторна система 22 Біотехнологія in silico – 2016, 4 курс Використовується дві плазміди –
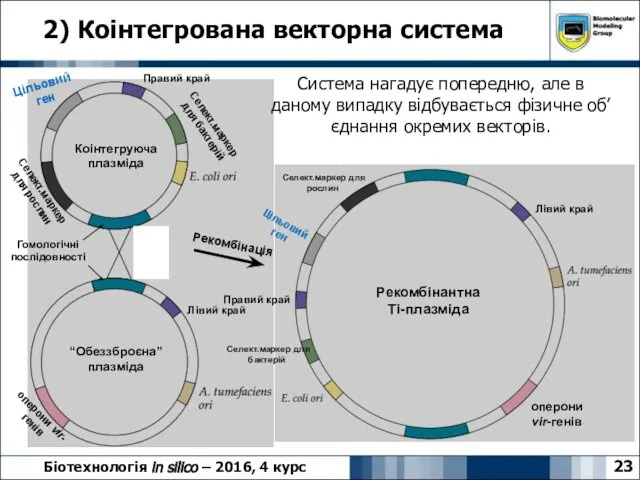
- 23. 2) Коінтегрована векторна система 23 Біотехнологія in silico – 2016, 4 курс Система нагадує попередню, але
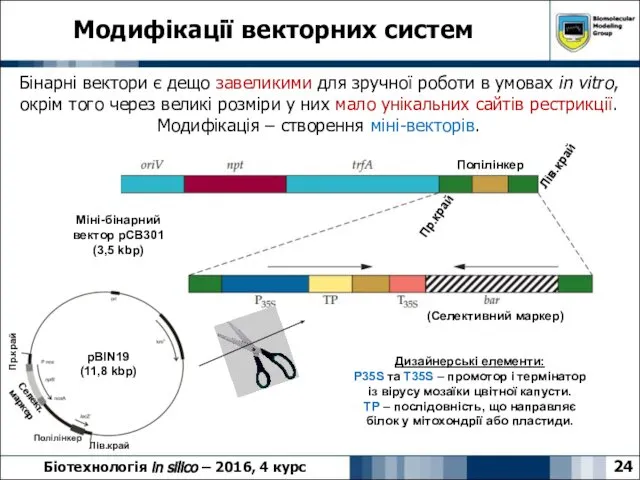
- 24. 24 Модифікації векторних систем Біотехнологія in silico – 2016, 4 курс Бінарні вектори є дещо завеликими
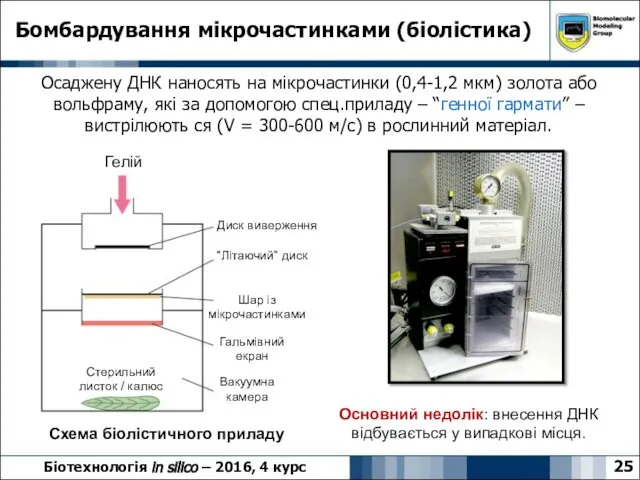
- 25. 25 Бомбардування мікрочастинками (біолістика) Біотехнологія in silico – 2016, 4 курс Осаджену ДНК наносять на мікрочастинки
- 26. Бомбардування мікрочастинками (біолістика) 26 Біотехнологія in silico – 2016, 4 курс Метод дозволяє бомбардувати суспензії клітин,
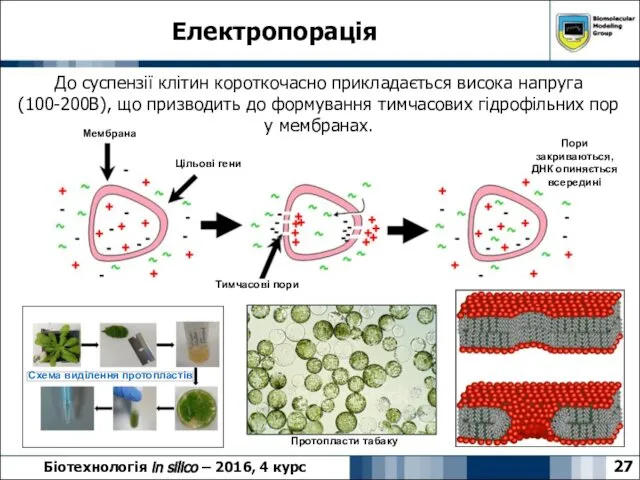
- 27. Електропорація 27 Біотехнологія in silico – 2016, 4 курс До суспензії клітин короткочасно прикладається висока напруга
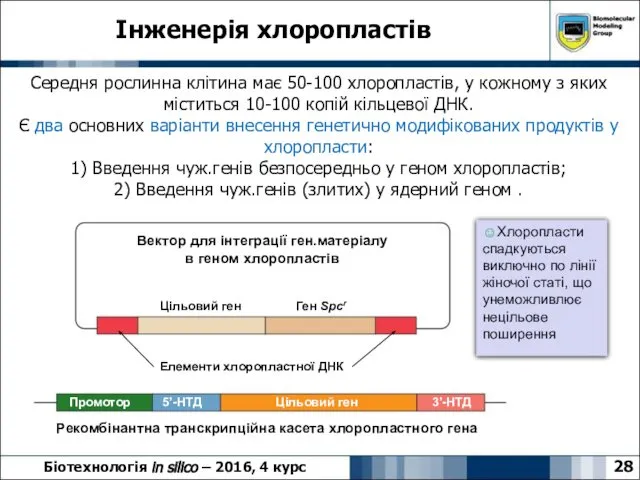
- 28. Інженерія хлоропластів 28 Біотехнологія in silico – 2016, 4 курс Середня рослинна клітина має 50-100 хлоропластів,
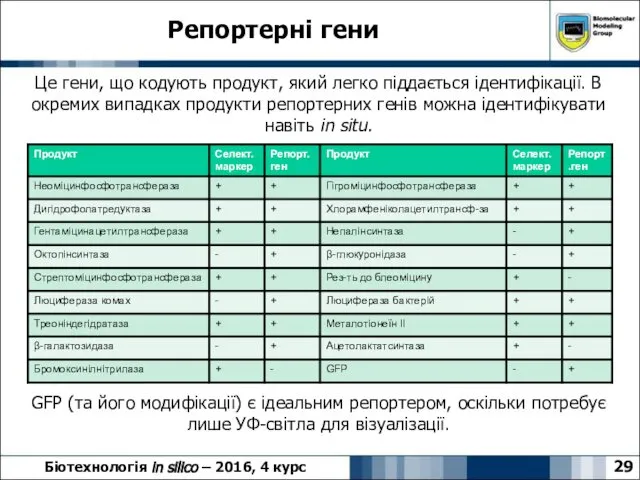
- 29. 29 Біотехнологія in silico – 2016, 4 курс Репортерні гени Це гени, що кодують продукт, який
- 30. Рослинні промотори 30 Біотехнологія in silico – 2016, 4 курс Оригінальні дослідження проводились із конститутивними слабкими
- 31. Модифікація рослинних генів 31 Біотехнологія in silico – 2016, 4 курс У рослин гомологічна рекомбінація відбувається
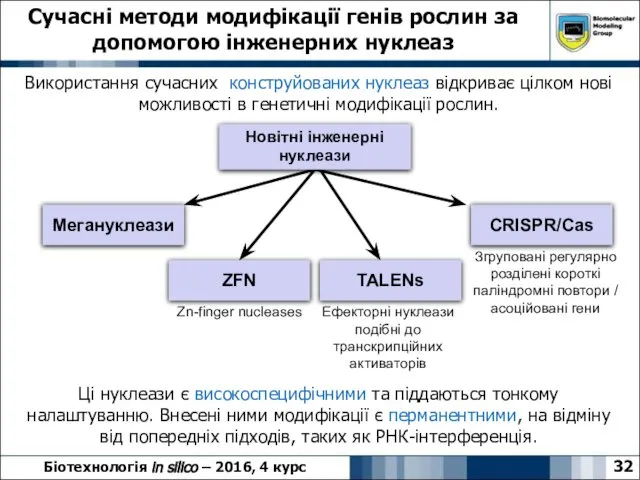
- 32. Сучасні методи модифікації генів рослин за допомогою інженерних нуклеаз 32 Біотехнологія in silico – 2016, 4
- 33. Мегануклеази 33 Біотехнологія in silico – 2016, 4 курс Це найбільш специфічні рестрикційні ендонуклеази в природі,
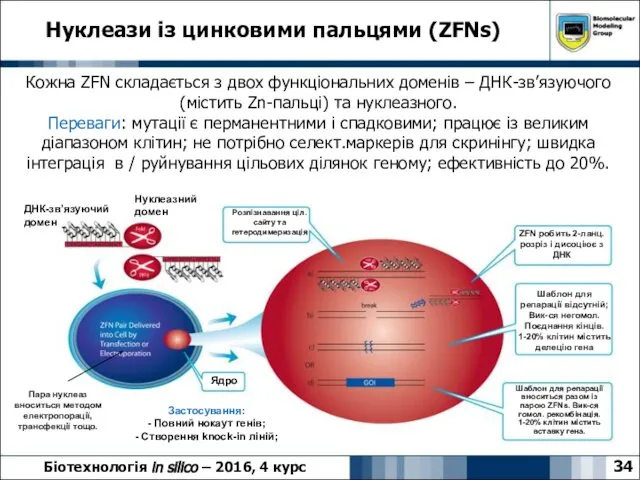
- 34. Нуклеази із цинковими пальцями (ZFNs) 34 Біотехнологія in silico – 2016, 4 курс Кожна ZFN складається
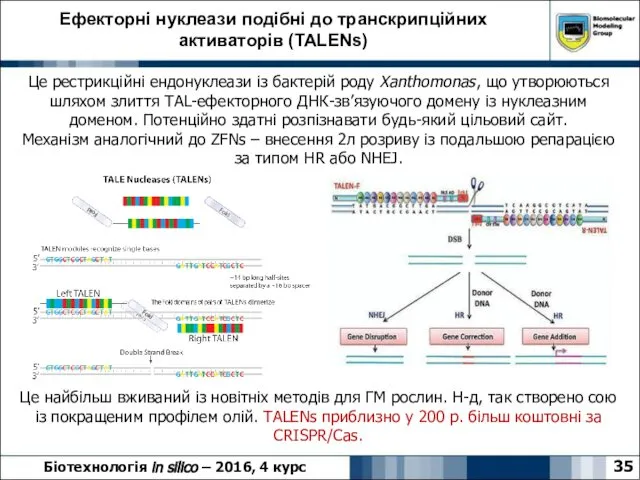
- 35. Ефекторні нуклеази подібні до транскрипційних активаторів (TALENs) 35 Біотехнологія in silico – 2016, 4 курс Це
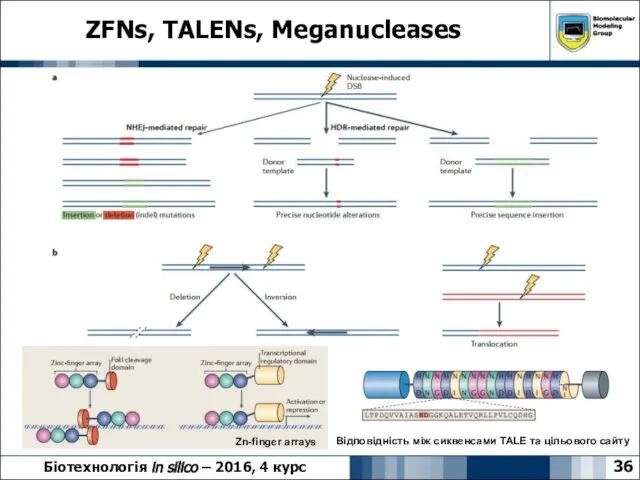
- 36. ZFNs, TALENs, Meganucleases 36 Біотехнологія in silico – 2016, 4 курс Відповідність між сиквенсами TALE та
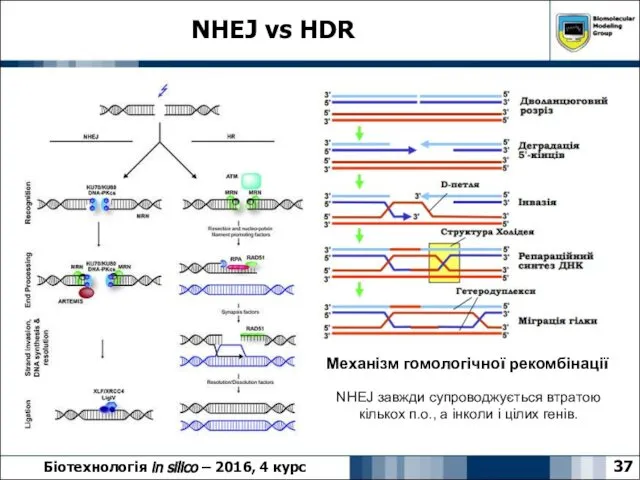
- 37. NHEJ vs HDR 37 Біотехнологія in silico – 2016, 4 курс Механізм гомологічної рекомбінації NHEJ завжди
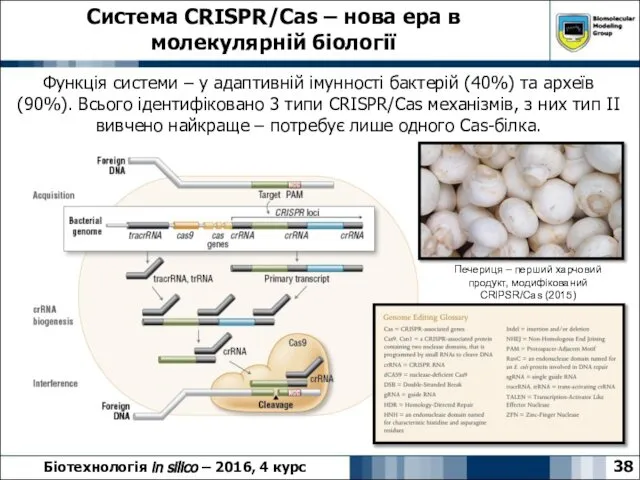
- 38. Система CRISPR/Cas – нова ера в молекулярній біології 38 Біотехнологія in silico – 2016, 4 курс
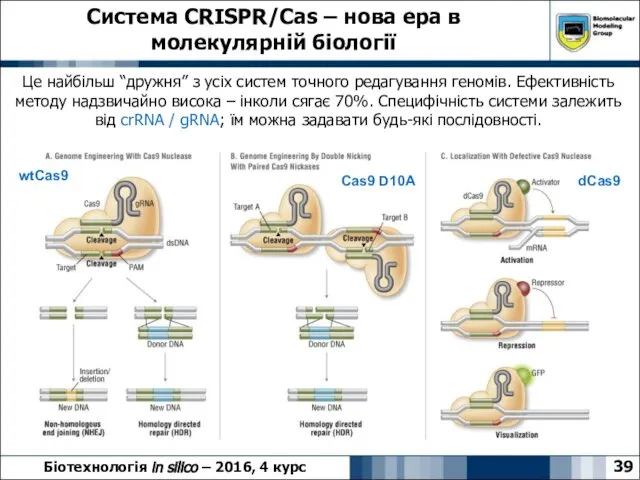
- 39. Система CRISPR/Cas – нова ера в молекулярній біології 39 Біотехнологія in silico – 2016, 4 курс
- 41. Скачать презентацию


















 Листок
Листок Презентация на тему "Наркотичні речовини" - скачать бесплатно презентации по Биологии
Презентация на тему "Наркотичні речовини" - скачать бесплатно презентации по Биологии Презентация к уроку по теме : Презентация к уроку по теме : Класс Паукообразные работу выполнила учитель Авдеевской СОШ
Презентация к уроку по теме : Презентация к уроку по теме : Класс Паукообразные работу выполнила учитель Авдеевской СОШ Отделы Плауновидные и Хвощевидные
Отделы Плауновидные и Хвощевидные About plants
About plants Цитология – наука, изучающая клетку. Многообразие клеток Подготовила учитель биологии МБОУ СОШ с. Виляйки Свищева Л.А.
Цитология – наука, изучающая клетку. Многообразие клеток Подготовила учитель биологии МБОУ СОШ с. Виляйки Свищева Л.А.  Вчення про біосферу Підготувала учениця 11-Ф класу Семененко Анна
Вчення про біосферу Підготувала учениця 11-Ф класу Семененко Анна  Презентация по биологии ОСНОВНЫЕ ЭТАПЫ АНТРОПОГЕНЕЗА
Презентация по биологии ОСНОВНЫЕ ЭТАПЫ АНТРОПОГЕНЕЗА  Презентация на тему "образ жизни стариков в разных странах" - скачать презентации по Биологии
Презентация на тему "образ жизни стариков в разных странах" - скачать презентации по Биологии Своя игра. Ракообразные, паукообразные, насекомые
Своя игра. Ракообразные, паукообразные, насекомые Ядро клетки
Ядро клетки Валентность и степень окисления Автор: Соболев Илья ученик 11МИ класса МОУ лицея №6 Руководитель: Дробот Светлана Сергеевна, учите
Валентность и степень окисления Автор: Соболев Илья ученик 11МИ класса МОУ лицея №6 Руководитель: Дробот Светлана Сергеевна, учите Ашыту өндірістерінде микроорганизмдерден практикалық бағалы өнім алуға пайдалану және олардың биохимиялық іс әрекеттері
Ашыту өндірістерінде микроорганизмдерден практикалық бағалы өнім алуға пайдалану және олардың биохимиялық іс әрекеттері Сон. Стадии сна
Сон. Стадии сна Презентация на тему "Бобовые" - скачать презентации по Биологии
Презентация на тему "Бобовые" - скачать презентации по Биологии Терморегуляция
Терморегуляция  систематика бактерии
систематика бактерии Природній та штучний добір
Природній та штучний добір Отряды птиц: Страусообразные, Казуарообразные, Нандуобразные, Гусеобразные
Отряды птиц: Страусообразные, Казуарообразные, Нандуобразные, Гусеобразные Оценка влияние гумата Плодородия на урожайность овса в условиях северного Казахстана
Оценка влияние гумата Плодородия на урожайность овса в условиях северного Казахстана GM-foods. Would you like to eat GM tomato?
GM-foods. Would you like to eat GM tomato? Сцепленное наследование генов. Генетические карты хромосом
Сцепленное наследование генов. Генетические карты хромосом Ехінококоз тварин та поширення його на території України
Ехінококоз тварин та поширення його на території України Мир РНК. (Лекция 8)
Мир РНК. (Лекция 8) Царство Растения
Царство Растения Томаты
Томаты Класс Паукообразные, особенности строения и жизнедеятельности
Класс Паукообразные, особенности строения и жизнедеятельности Головний мозок
Головний мозок