Содержание
- 2. Предмет эпигенетики В 1942 г. эмбриологом Конрадом Уоддингтоном был введен термин "эпигенетика", произошедший от объединения терминов
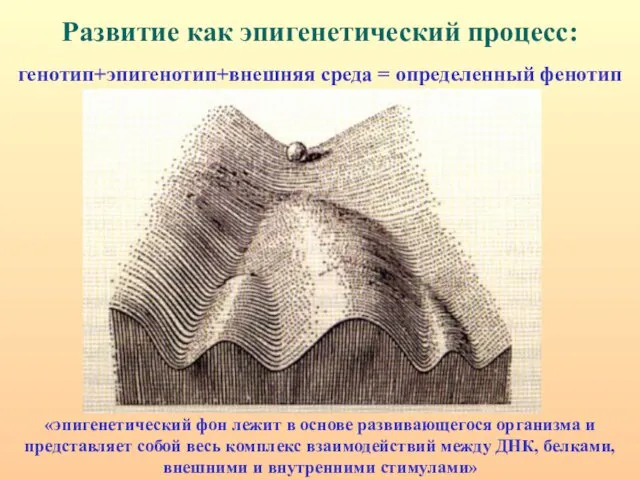
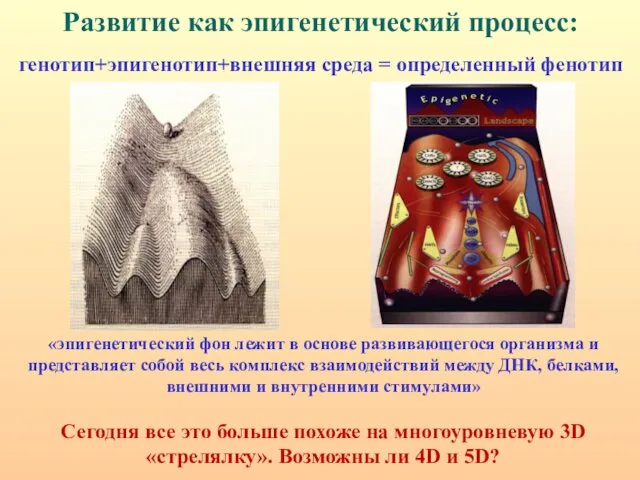
- 3. Развитие как эпигенетический процесс: генотип+эпигенотип+внешняя среда = определенный фенотип «эпигенетический фон лежит в основе развивающегося организма
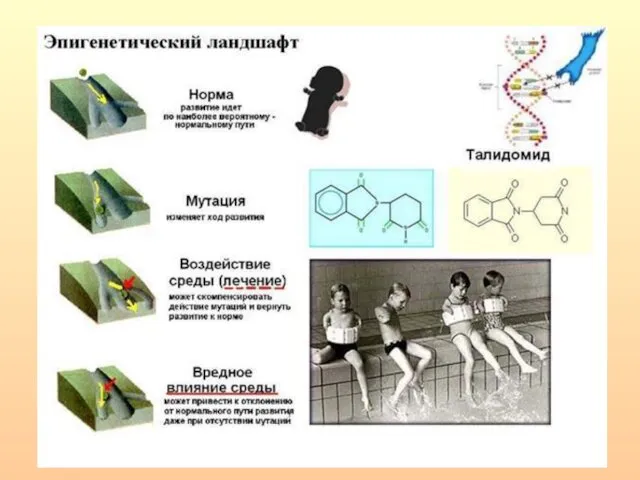
- 4. По Уоддингтону процесс онтогенеза - это пространство возможностей - "эпигенетический ландшафт", представляющий собой набор эпигенетических траекторий,
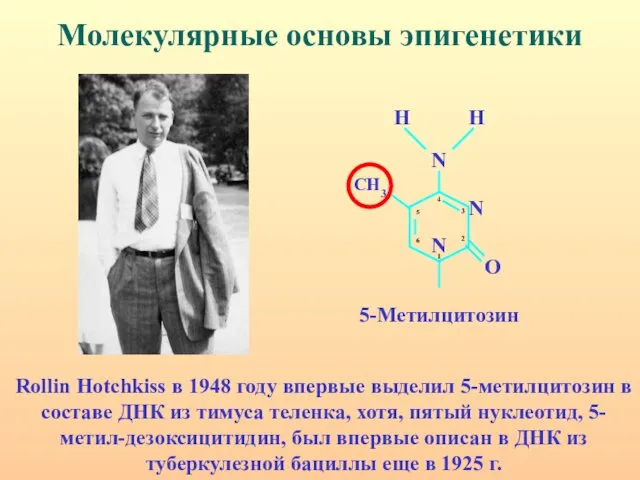
- 6. Молекулярные основы эпигенетики Rollin Hotchkiss в 1948 году впервые выделил 5-метилцитозин в составе ДНК из тимуса
- 7. Молекулярные основы эпигенетики Б.Ф. Ванюшин 16 февраля 1935 Robin Holliday Впервые определил природу метилируемых последовательностей ДНК
- 9. Американцам Эндрю Файру и Крэйгу Мэллоу “за открытие фундаментального явления РНК-интерференции - подавления экспрессии генов с
- 10. В 1990 г. Робин Холлидей дал более конкретное определение эпигенетики. «Исследование механизмов временного и пространственного контроля
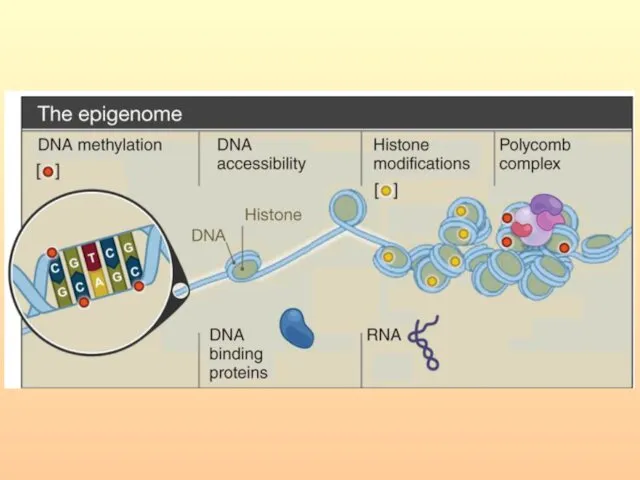
- 11. Геном/клетка содержит информацию двух видов – генетическую и эпигенетическую. Генетическая информация – руководство по созданию живого
- 12. Эпигенетическая регуляция - наследственные и ненаследственные изменения в экспрессии конкретного гена без каких-либо соответствующих структурных изменений
- 13. Эпигенетические механизмы регуляции экспрессии генов можно определить как наследственный код, отличный от геномной последовательности нуклеотидов, который
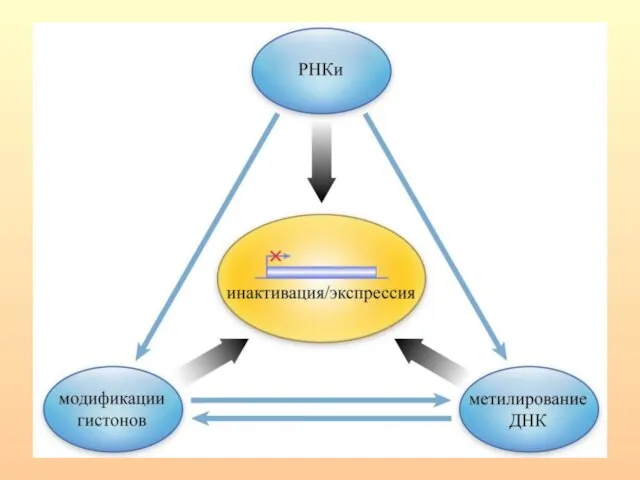
- 15. Уровни эпигенетической регуляции
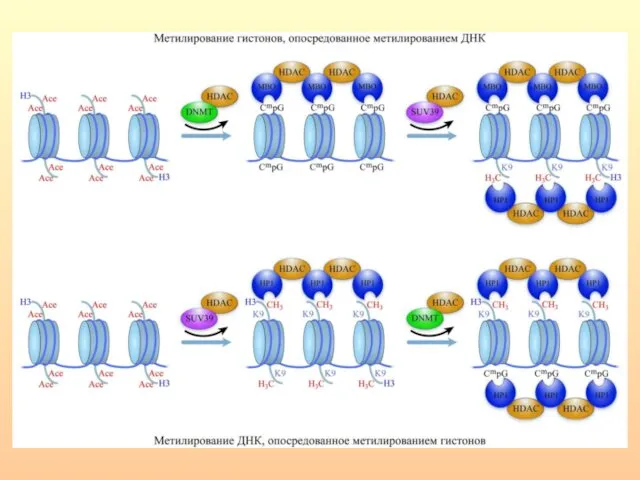
- 17. Метилирование ДНК вовлечено в широкий круг биологических процессов, которые включают регуляцию репликации и сплайсинга ДНК, структуры
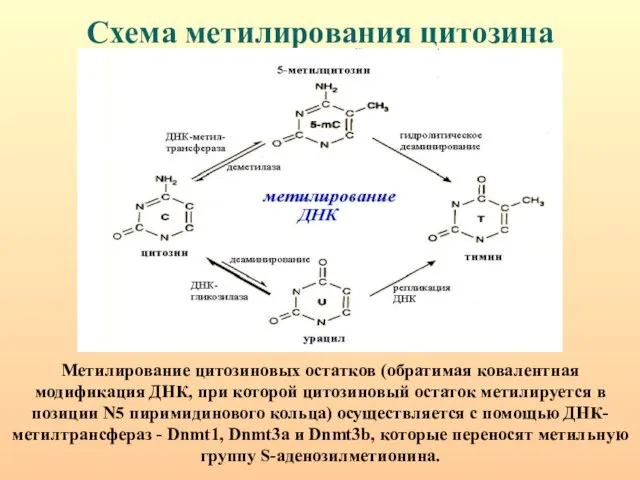
- 18. Схема метилирования цитозина Метилирование цитозиновых остатков (обратимая ковалентная модификация ДНК, при которой цитозиновый остаток метилируется в
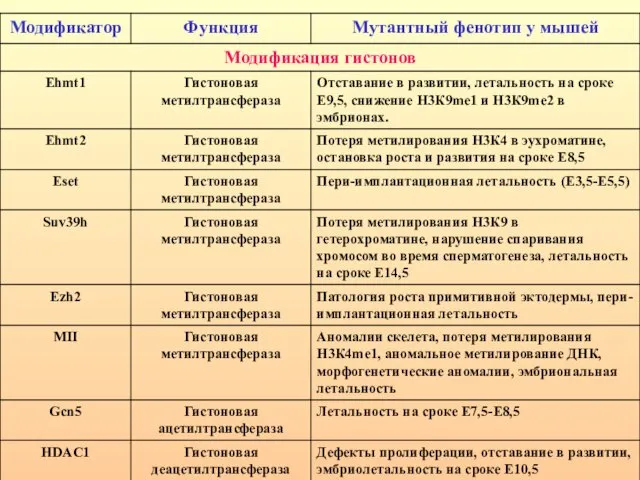
- 21. Фенотипические проявления мутаций ДНК-метилтрансфераз и метилсвязывающих белков
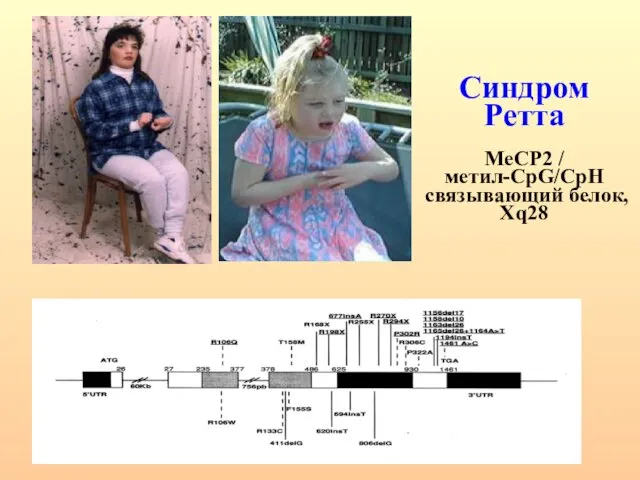
- 22. Синдром Ретта MeCP2 / метил-CpG/CpH связывающий белок, Xq28
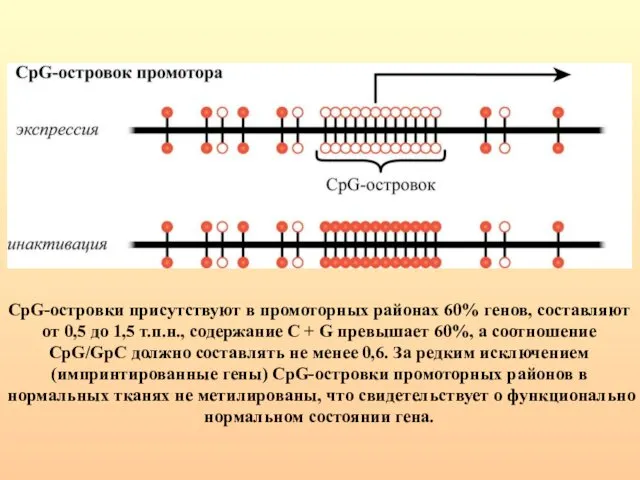
- 23. CpG-островки присутствуют в промоторных районах 60% генов, составляют от 0,5 до 1,5 т.п.н., содержание С +
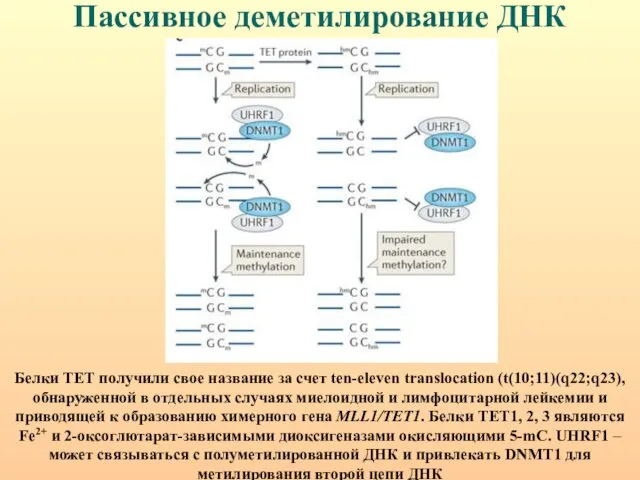
- 24. Пассивное деметилирование ДНК Белки ТЕТ получили свое название за счет ten-eleven translocation (t(10;11)(q22;q23), обнаруженной в отдельных
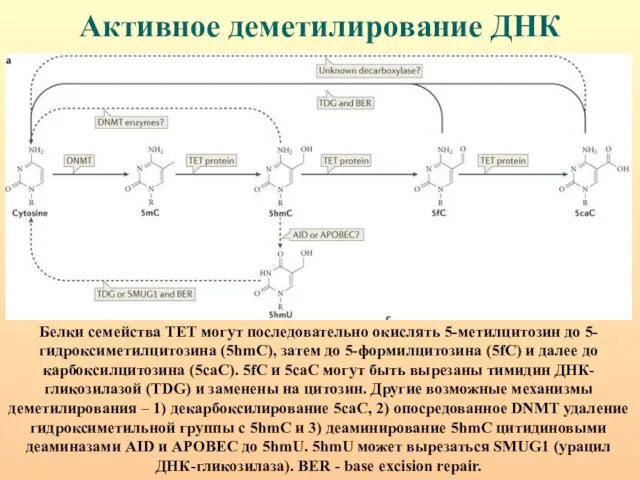
- 25. Активное деметилирование ДНК Белки семейства ТЕТ могут последовательно окислять 5-метилцитозин до 5-гидроксиметилцитозина (5hmC), затем до 5-формилцитозина
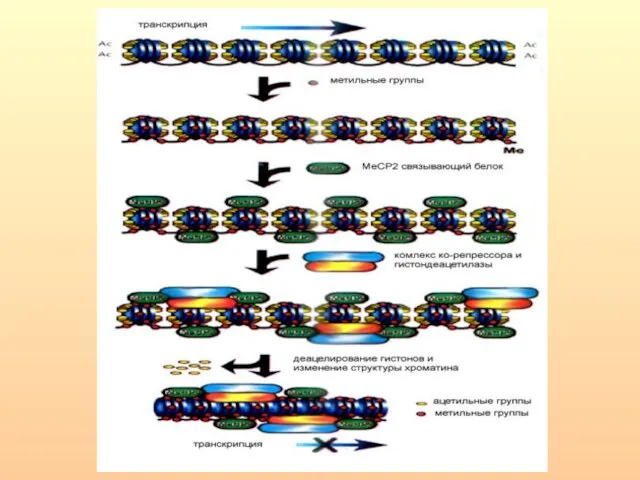
- 26. Метил-связывающий белок MeCP2, которому достаточно одного метилированного CpG для связывания, реагирует также и на СрН. Относительная
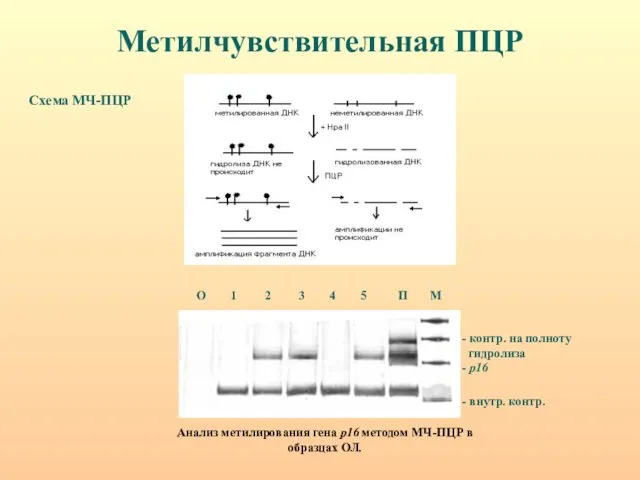
- 27. Методы анализа метилирования 1. Метилчувствительная ПЦР (NotI, EagI, SacII, HpaII, HhaI) аналитическая чувствительность - 1: 2000;
- 28. Метилчувствительная ПЦР Схема МЧ-ПЦР Анализ метилирования гена р16 методом МЧ-ПЦР в образцах ОЛ.
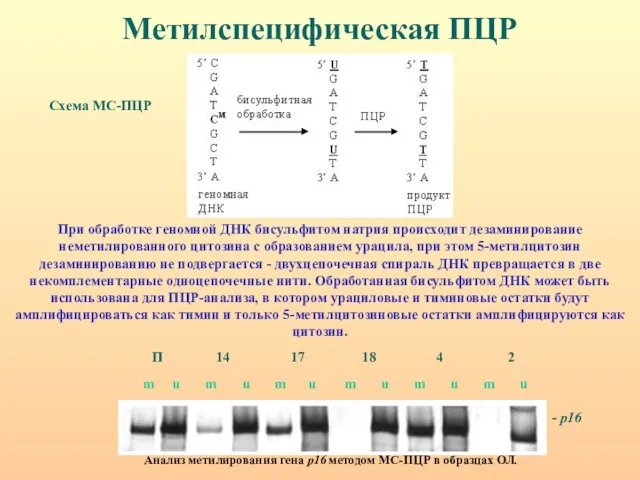
- 29. Метилспецифическая ПЦР Схема МС-ПЦР Анализ метилирования гена р16 методом МС-ПЦР в образцах ОЛ. При обработке геномной
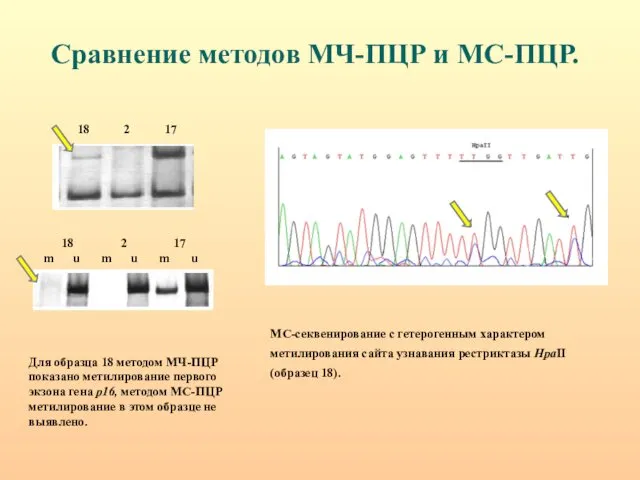
- 30. Сравнение методов МЧ-ПЦР и МС-ПЦР. МС-секвенирование с гетерогенным характером метилирования сайта узнавания рестриктазы HpaII (образец 18).
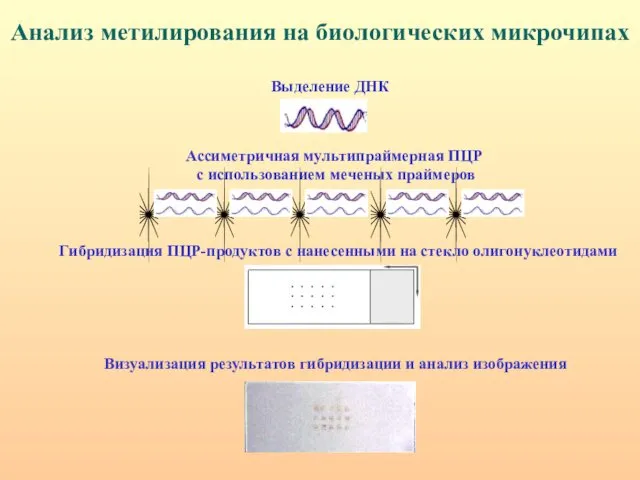
- 31. Анализ метилирования на биологических микрочипах
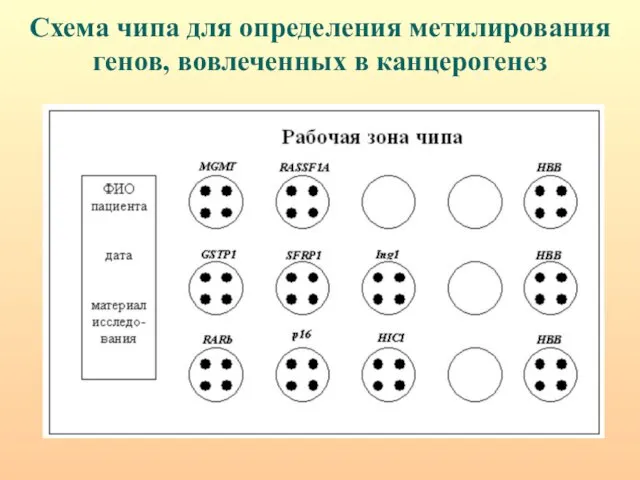
- 32. Схема чипа для определения метилирования генов, вовлеченных в канцерогенез
- 33. Гибридизация не гидролизованной метилчувствительными ферментами рестрикции ДНК; гибридизация контрольной гидролизованной ДНК; гибридизация клинических образцов
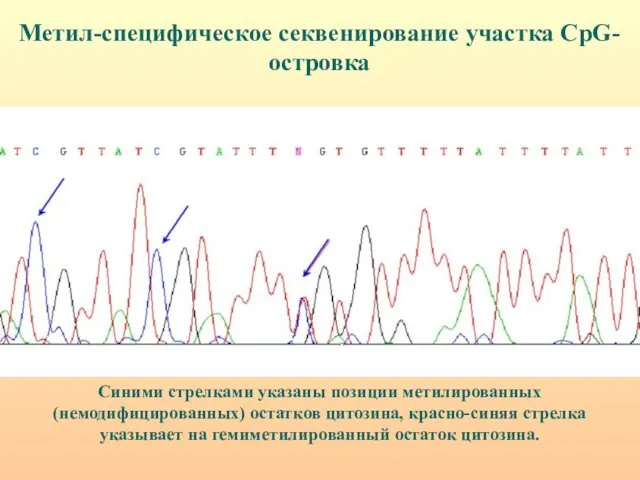
- 34. Синими стрелками указаны позиции метилированных (немодифицированных) остатков цитозина, красно-синяя стрелка указывает на гемиметилированный остаток цитозина. Метил-специфическое
- 35. Механизмы инактивации гена в результате метилирования промоторной области 1. Метильные группы нарушают ДНК-белковые взаимодействия, выступая в
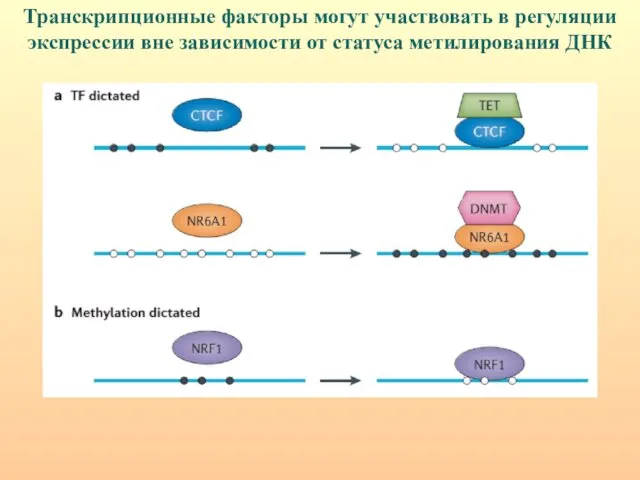
- 38. Транскрипционные факторы могут участвовать в регуляции экспрессии вне зависимости от статуса метилирования ДНК
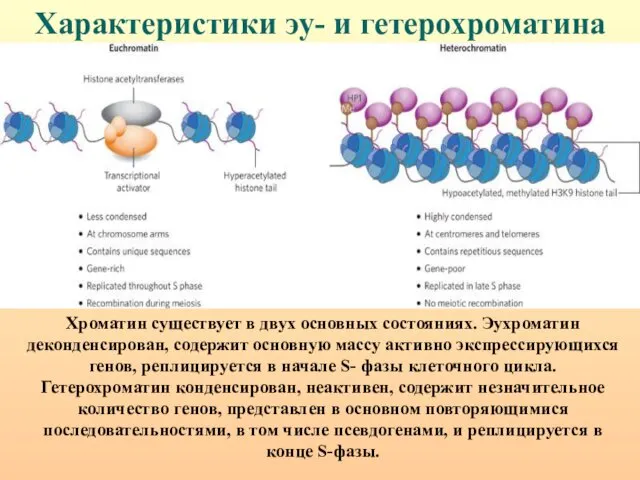
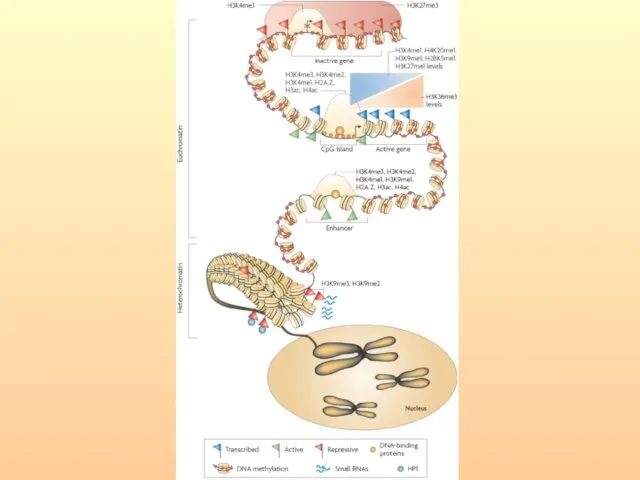
- 40. Характеристики эу- и гетерохроматина Хроматин существует в двух основных состояниях. Эухроматин деконденсирован, содержит основную массу активно
- 41. Основной структурной единицей хроматина является нуклеосома. Она представляет собой белковый октамер, образованный двумя молекулами каждого из
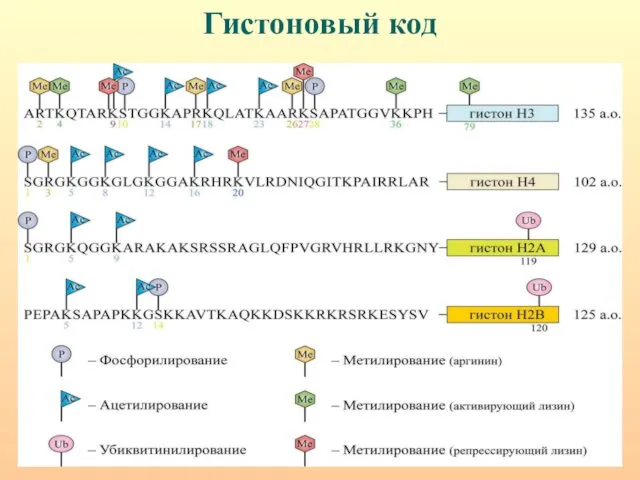
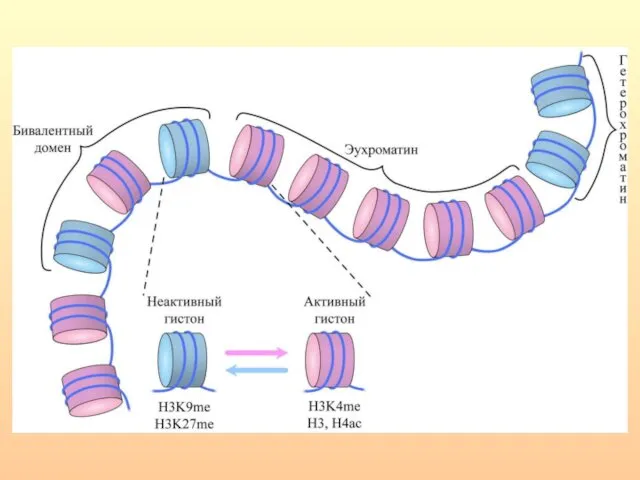
- 42. Гистоновый код - разнообразный набор модификаций N-концевых районов гистоновых белков (метилирование, ацетилирование, фосфорилирование, рибозилирование, убиквитинилирование, сумоилирование),
- 43. Гистоновый код
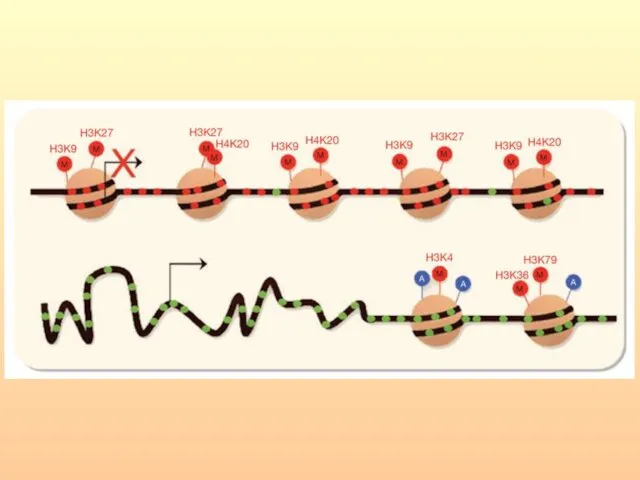
- 44. К маркерам активации гистонов, которые связаны с эухроматином и повышением генной экспрессии, можно отнести ацетилирование лизинов
- 45. Метилирование Н3К9, Н3К27 и Н4К20 является основной модификацией гистонов, соответствующей гетерохроматину и крупномасштабной репрессии транскрипции. При
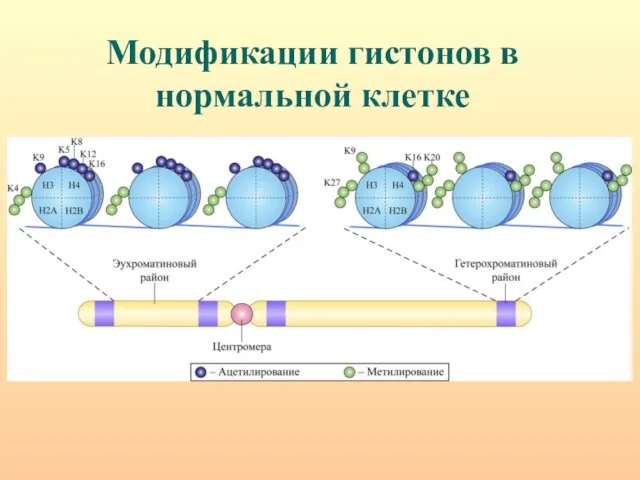
- 47. Модификации гистонов в нормальной клетке
- 48. Повышенный уровень ацетилирования гистонов стимулирует транскрипцию, а деацетилирование приводит к полной инактивации генов. Ацетилирование/деацетилирование может быть
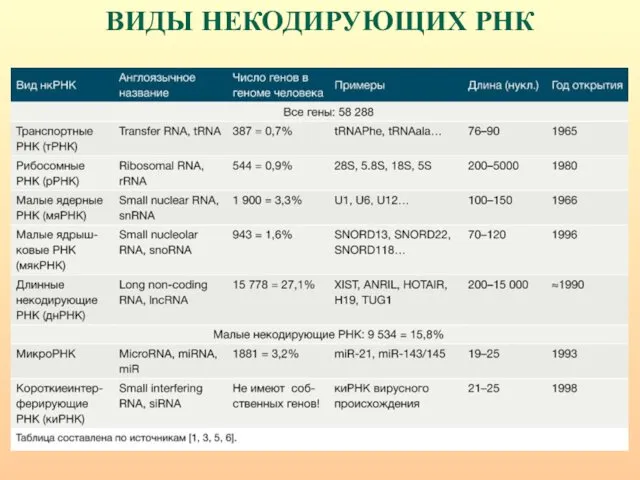
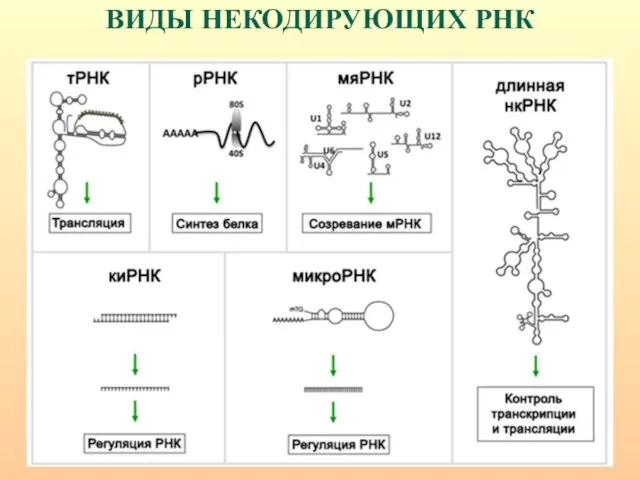
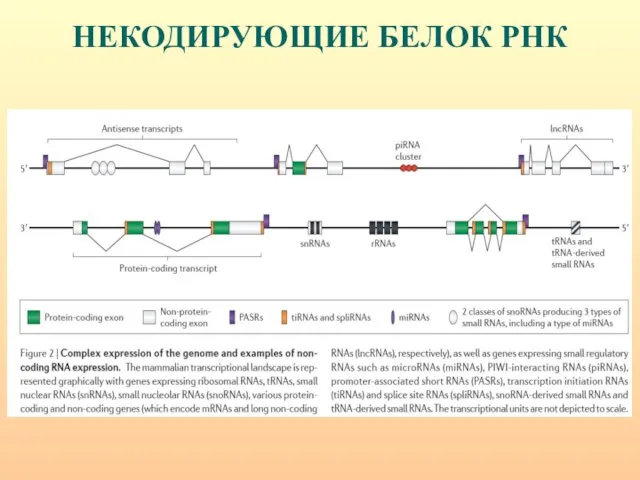
- 52. ВИДЫ НЕКОДИРУЮЩИХ РНК
- 53. Выявлен и охарактеризован целый ряд функциональных классов некодирующей РНК: - рибосомальная (r), - транспортная (t), -
- 54. ВИДЫ НЕКОДИРУЮЩИХ РНК
- 55. МАЛЫЕ НЕКОДИРУЮЩИЕ БЕЛОК РНК snРНК – малые ядерные РНК (или сплайсосомная РНК) являются ключевой составляющей процесса
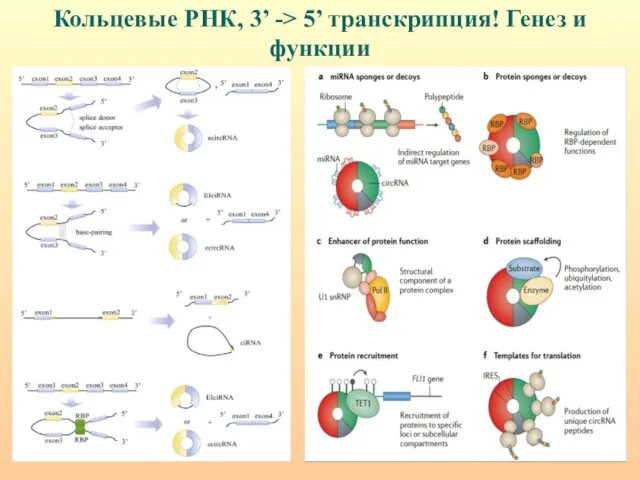
- 56. Кольцевые РНК, 3’ -> 5’ транскрипция! Генез и функции
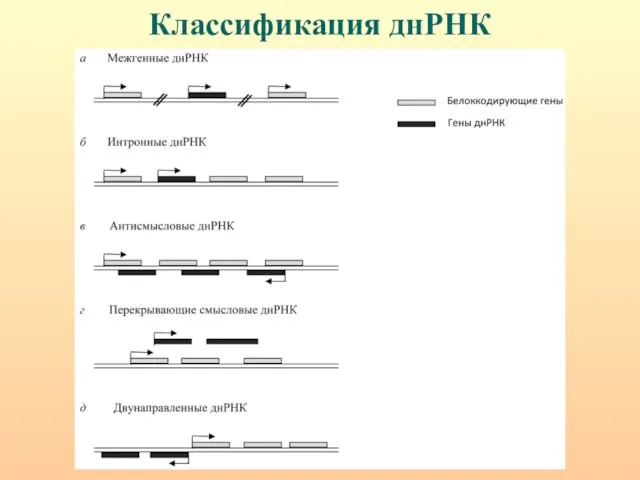
- 57. днРНК (>200 н.). Интронные, межгенные, антисмысловые, не имеют длинной открытой рамки считывания (>200 кодонов) и поли
- 58. Классификация днРНК
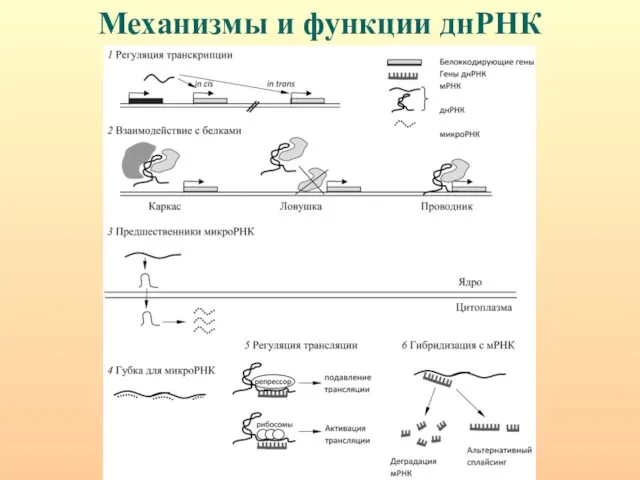
- 59. Механизмы и функции днРНК
- 60. НЕКОДИРУЮЩИЕ БЕЛОК РНК
- 61. Некодирующие РНК
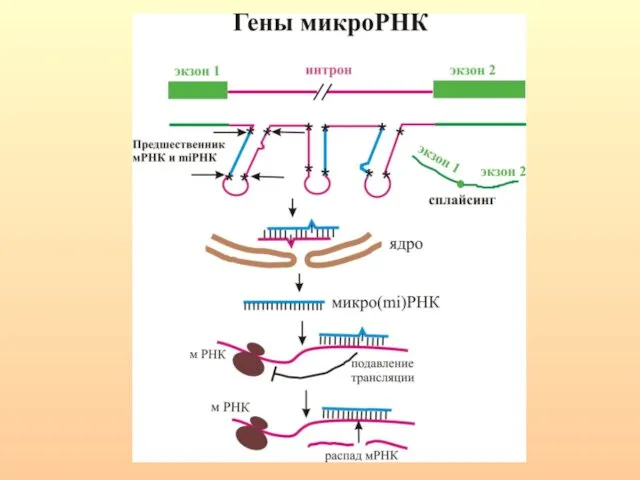
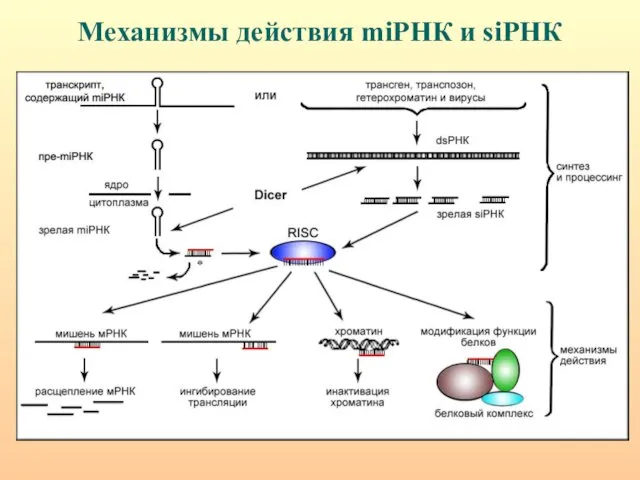
- 62. ХАРАКТЕРНЫЕ ПРИЗНАКИ miРНК И siРНК. Величина - 19-25 н. miРНК образуются из коротких (70-100 н.) шпилечных
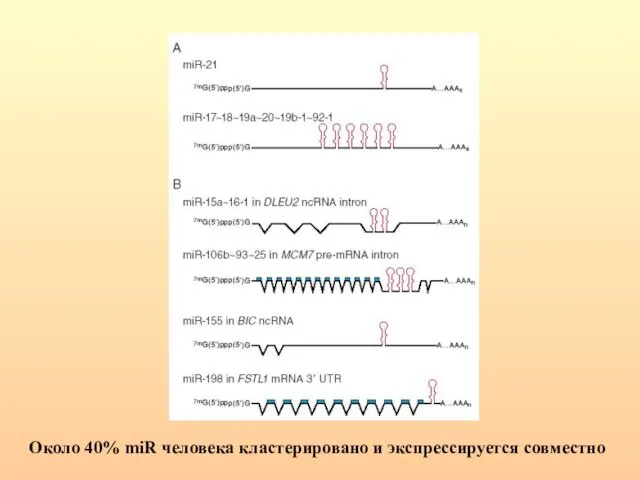
- 64. Около 40% miR человека кластерировано и экспрессируется совместно
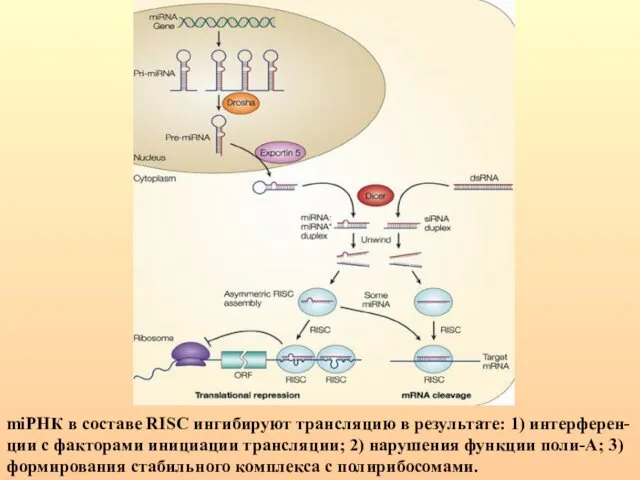
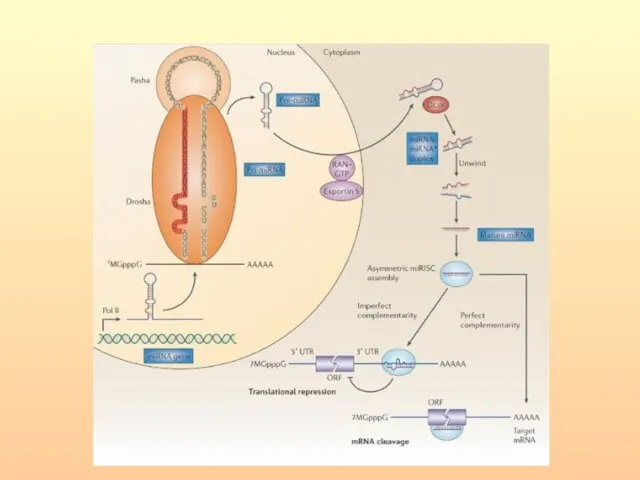
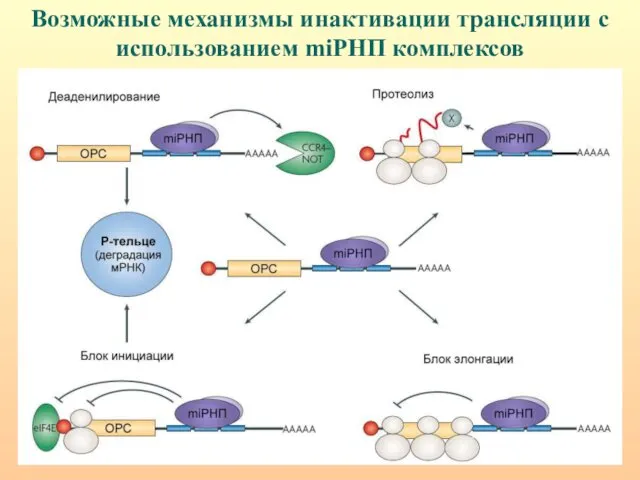
- 65. miРНК в составе RISC ингибируют трансляцию в результате: 1) интерферен-ции с факторами инициации трансляции; 2) нарушения
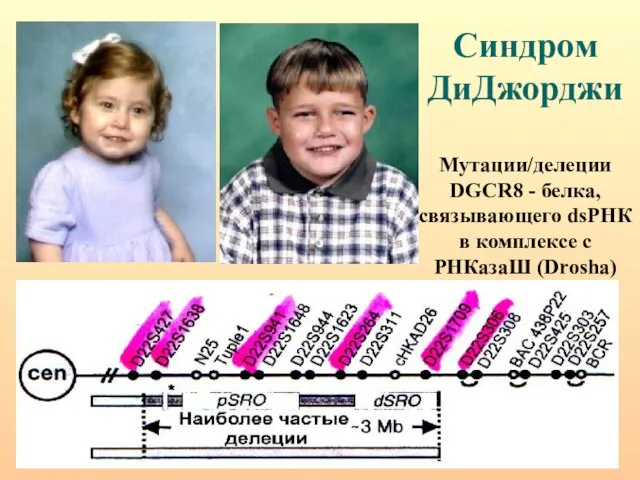
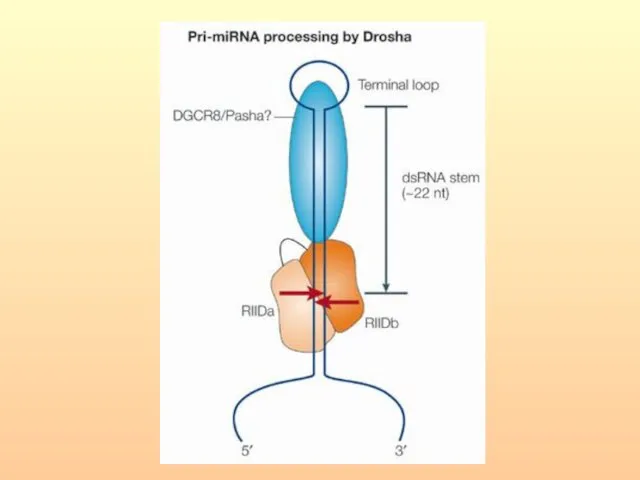
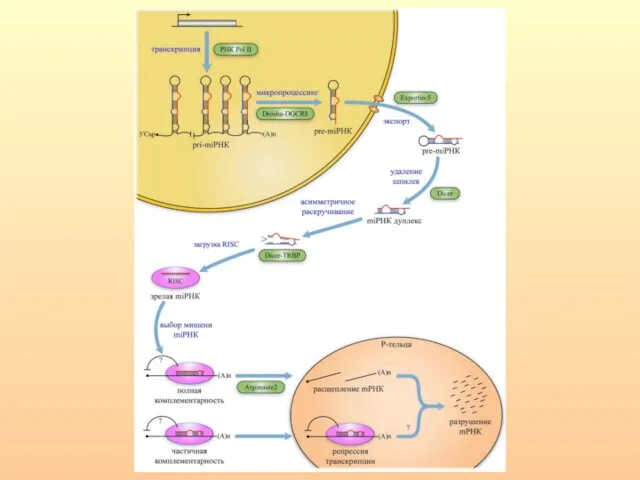
- 66. РНКаза III, называемая Drosha расщепляет шпильки РНК, содержащие большие (≥10 нуклеотидов) концевые петли и вырезает предшественники
- 67. Синдром ДиДжорджи Мутации/делеции DGCR8 - белка, связывающего dsРНК в комплексе с РНКазаШ (Drosha)
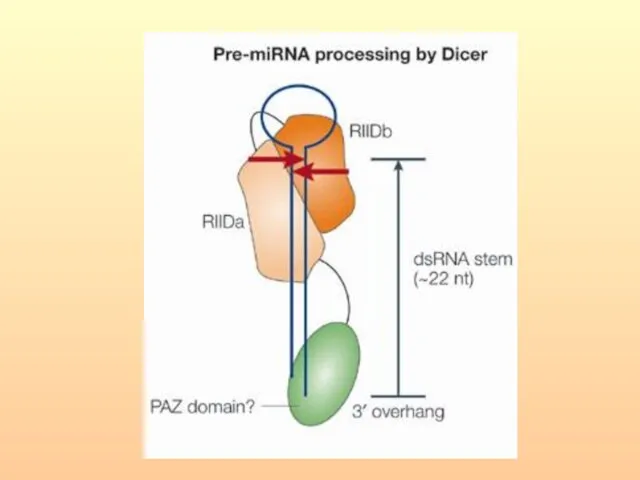
- 70. Цитоплазматическая РНКаза III — Dicer осуществляет дальнейший процессинг. После расщепления нуклеазой Dicer короткие дуплексы РНК встраиваются
- 72. Образованный дуплекс miРНК раскручивается с помощью хеликаз, одна из его цепей входит в состав РНК-зависимого комплекса
- 74. Возможные механизмы инактивации трансляции с использованием miРНП комплексов
- 75. Механизмы действия miРНК и siРНК
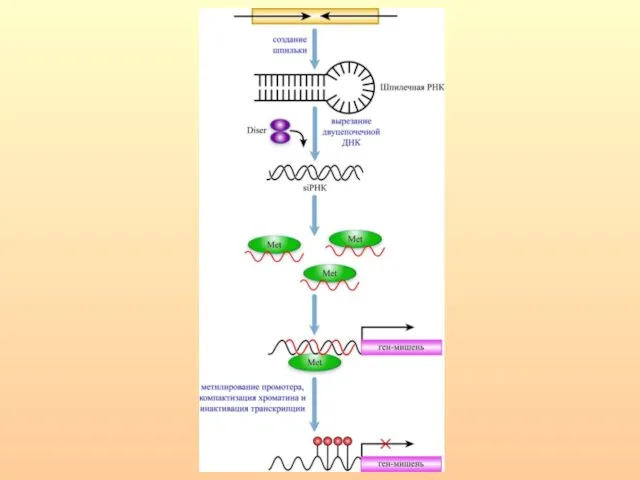
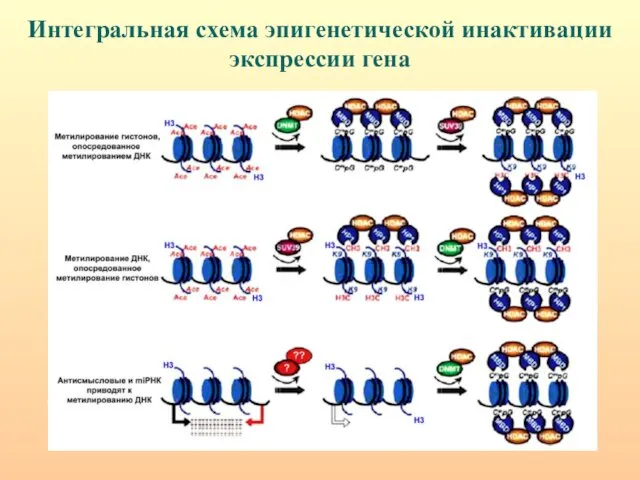
- 77. Интегральная схема эпигенетической инактивации экспрессии гена
- 78. miРНК и siРНК - инструмент избирательного временного подавления экспрессии гена. Потенциальная терапия социально значимых заболеваний (инфекционных,
- 79. miРНК активно участвуют в эмбриональном развитии. В процессе формирования конечностей участвуют miРНК lin-41, let-7 и miR-196;
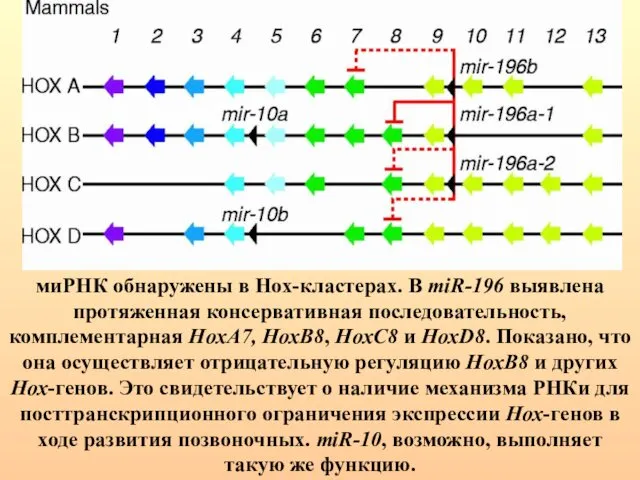
- 80. миРНК обнаружены в Hox-кластерах. В miR-196 выявлена протяженная консервативная последовательность, комплементарная HoxA7, HoxB8, HoxC8 и HoxD8.
- 81. Эктопическая гиперэкспрессия miR-181 у мыши в гемопоэтических стволовых клетках/клетках-предшественниках увеличивает процент клеток B-лимфоцитарной линии как in
- 82. Тиксельская порода овец (Бельгия) знаменита своей мясистостью. Причиной этого признака является полиморфный вариант +6723G - A
- 83. Возможное использование miРНК и siРНК Практическое: - могут являться маркерами какого-либо патологического процесса (злокачественного, неврологического, аутоиммунного
- 85. Развитие как эпигенетический процесс: генотип+эпигенотип+внешняя среда = определенный фенотип «эпигенетический фон лежит в основе развивающегося организма
- 86. - Если вы хотите использовать термин «эпигенетика» для описания клеточной памяти, поддержания гомеостаза при отсутствии внешних
- 88. Да здравствует функциональная геномика!
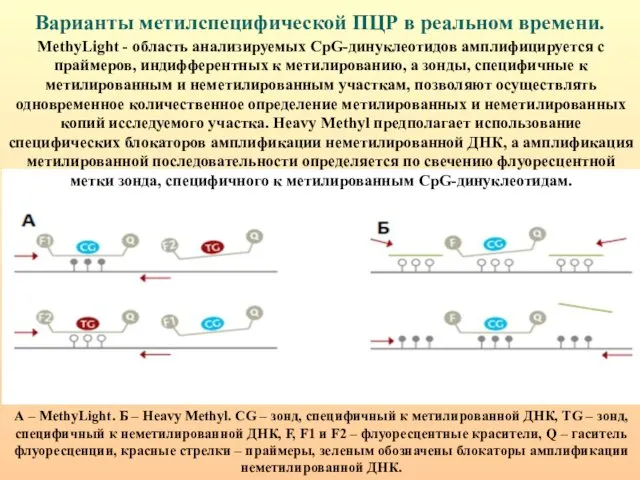
- 89. Варианты метилспецифической ПЦР в реальном времени. А – MethyLight. Б – Heavy Methyl. CG – зонд,
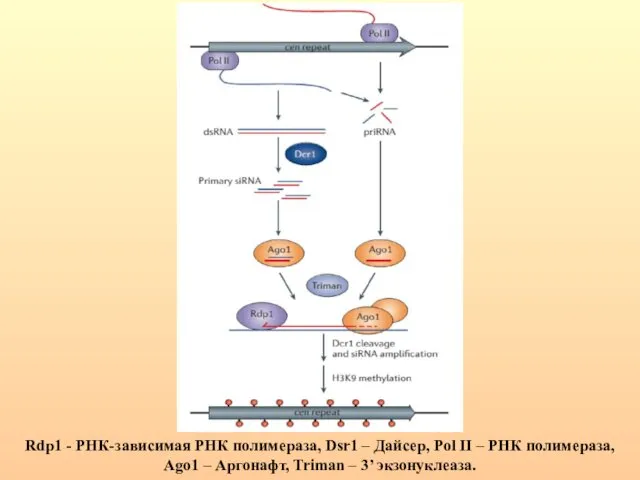
- 90. Rdp1 - РНК-зависимая РНК полимераза, Dsr1 – Дайсер, Pol II – РНК полимераза, Ago1 – Аргонафт,
- 91. днРНК действуют как на уровне транскрипции, так и посттранскрипционно. На уровне транскрипции днРНК рекрутируют факторы транскрипции
- 92. МАЛЫЕ НЕКОДИРУЮЩИЕ БЕЛОК РНК snРНК – малые ядерные РНК (или сплайсосомная РНК) являются ключевой составляющей процесса
- 93. МАЛЫЕ НЕКОДИРУЮЩИЕ БЕЛОК РНК PASRs – малые РНК, ассоциированные с промоторами. РНК-опосредованная инактивация/активация транскрипции? TSSa-РНК –
- 94. днРНК действуют как на уровне транскрипции, так и посттранскрипционно. На уровне транскрипции днРНК рекрутируют факторы транскрипции
- 97. Профессор фармакологии Моше Сциф (Монреаль/ Канада) одним из первых связал эпигенетическиe маркеры (гипометилирование и гиперметилирование генетической
- 100. Скачать презентацию














































 Природные богатства
Природные богатства Фрукты и овощи
Фрукты и овощи Общая и частная физиология ЦНС
Общая и частная физиология ЦНС Постэмбриональное развитие животных
Постэмбриональное развитие животных Способы передвижения животных
Способы передвижения животных Деление клетки. Митоз. Подготовила учитель химии и биологии Родионова Н.Г. МОБУ «Лобасковская ООШ»
Деление клетки. Митоз. Подготовила учитель химии и биологии Родионова Н.Г. МОБУ «Лобасковская ООШ»  Презентация на тему "Каменный лес" - скачать презентации по Биологии
Презентация на тему "Каменный лес" - скачать презентации по Биологии Бурый скалозуб (рыба Фугу)
Бурый скалозуб (рыба Фугу) Методы генетики
Методы генетики Скати
Скати  Это орган растения, который ему жизненно необходим. Это орган растения, который ему жизненно необходим. Этот орган появляется в оп
Это орган растения, который ему жизненно необходим. Это орган растения, который ему жизненно необходим. Этот орган появляется в оп Презентация на тему Микроорганизмы- художники
Презентация на тему Микроорганизмы- художники  Презентация на тему "Обмен веществ в организме человека" - скачать презентации по Биологии
Презентация на тему "Обмен веществ в организме человека" - скачать презентации по Биологии Хозяйственно-биологические особенности птиц
Хозяйственно-биологические особенности птиц Строение нервной системы. Нервная регуляция организма
Строение нервной системы. Нервная регуляция организма Презентация на тему "Разнообразие природных комплексов России" - скачать презентации по Биологии
Презентация на тему "Разнообразие природных комплексов России" - скачать презентации по Биологии Презентация на тему Лес
Презентация на тему Лес 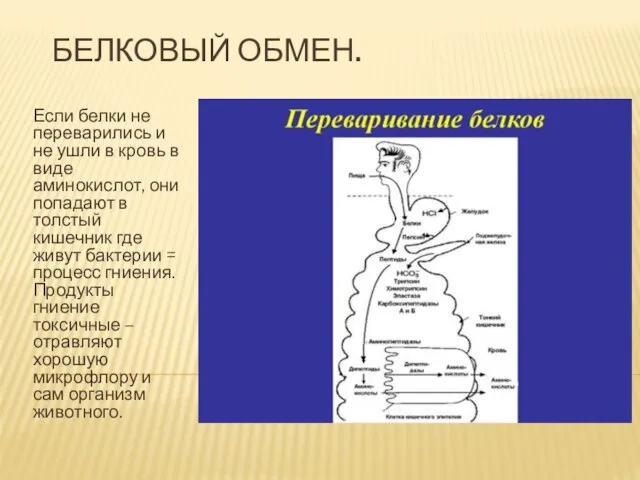 Белковый обмен
Белковый обмен Орган слуха и равновесия. Обонятельный и вкусовой анализаторы
Орган слуха и равновесия. Обонятельный и вкусовой анализаторы Тип Плоские черви
Тип Плоские черви Презентация на тему "Клеточное строение листа" - скачать презентации по Биологии
Презентация на тему "Клеточное строение листа" - скачать презентации по Биологии Урок на тему: «Ткани» биология 8 класс. Автор урока учитель биологии высшей категории МОУ СОШ № 43 г. Пензы. Петрунина Т.П.
Урок на тему: «Ткани» биология 8 класс. Автор урока учитель биологии высшей категории МОУ СОШ № 43 г. Пензы. Петрунина Т.П.  Наш друг лес
Наш друг лес Презентация Акулы
Презентация Акулы Интернет консультация по биологии в формате ЕГЭ зав.каф. анатомии, физиологии и гигиены к.б.н., доцент Кирилина В.М.
Интернет консультация по биологии в формате ЕГЭ зав.каф. анатомии, физиологии и гигиены к.б.н., доцент Кирилина В.М. Микроорганизмдерді дақылдаудың негіздері
Микроорганизмдерді дақылдаудың негіздері Презентация на тему "Ароматерапия" - скачать бесплатно презентации по Биологии
Презентация на тему "Ароматерапия" - скачать бесплатно презентации по Биологии Использование туристических навыков и биологических знаний для выживания в автономной среде Автор: Михалёва Наталия Борисовна,
Использование туристических навыков и биологических знаний для выживания в автономной среде Автор: Михалёва Наталия Борисовна,