Содержание
- 2. Факторы отбора химических элементов для построения и функционирования биологических систем
- 3. Химические элементы живых организмов Материя Вселенной – >100 элементов Основа живых систем – только 6 элементов
- 4. Причины дифференцированного отбора элементов Известно около 15 млн. химических соединений Около 96% – органические соединения, основной
- 5. Причины дифференцированного отбора элементов Следовательно, геохимические условия не играют существенной роли в отборе химических элементов при
- 6. Требования соответствия между строительным материалом и высокоорганизованными структурами Отбор элементов, способных к образованию: достаточно прочных и,
- 7. Углерод – органоген № 1 Углерод способен вмещать и удерживать внутри себя самые резкие химические противоположности,
- 8. Кислород и водород Нельзя считать столь же лабильными элементами Носители крайних и односторонних свойств – окислительных
- 9. Азот, фосфор, сера и др. N, Р и S, некоторые элементы, составляющие активные центры ферментовт(Fе, Мg),
- 10. Внутримолекулярное или внутрикомплексное взаимодействие атомов С, N, S, Р, Н, О, Fе, Мg, Ti создает исключительное
- 11. Все перечисленное выше и определило отбор в ходе эволюции природы определенных химических элементов для построения и
- 12. Классификация биогенных элементов
- 13. По количественному содержанию в организмах (В. И. Вернадский) Макроэлементы – содержание в организме более 10–2% (O,
- 14. По количественному содержанию в организмах (В. И. Вернадский) Микроэлементы – содержание в организме 10–2–10–5% (I, Cu,
- 15. По количественному содержанию в организмах (В. И. Вернадский) Ультрамикроэлементы – содержание в организме меньше 10–5% (Pb,
- 16. По значимости для жизнедеятельности (В. В. Ковальский) Незаменимые элементы – всегда содержатся в живом организме, входя
- 17. По функциональной роли Органогены – элементы, из атомов которых состоят основные органические соединения организма р-элементы C,
- 18. По влиянию на живые организмы Канцерогены… элементы, стимулирующие развитие опухолевых процессов в организме и могущие вызывать
- 19. Химические компоненты клетки Вода
- 20. соединение, которое живая клетка содержит в наибольшем количестве составляет около 70% массы клетки большинство внутриклеточных реакций
- 21. Функции воды в организме Вода – универсальный растворитель Это обусловлено полярностью молекулы и способностью образовывать водородные
- 22. Функции воды в организме Транспортные функции Это обусловлено низкой вязкостью, подвижностью и способностью растворять большое число
- 23. Функции воды в организме Вода – среда, в которой протекают многочисленные и разнообразные химические процессы Большая
- 24. Функции воды в организме Вода – непосредственный участник биохимических реакций Гидролиз Гидратация и дегидратация Окисление Многие
- 25. Функции воды в организме Вода – терморегулятор Основа – высокая теплопроводность воды и значительное поглощение теплоты
- 26. Химические компоненты клетки Органические соединения клетки
- 27. Малые органические молекулы Соединения углерода с Мr от 100 до 1000 (до 30 атомов С) Обычно
- 28. Малые органические молекулы Расщепляясь, все биомолекулы распадаются до тех простых соединений, из которых они и синтезируются,
- 29. Углеводы
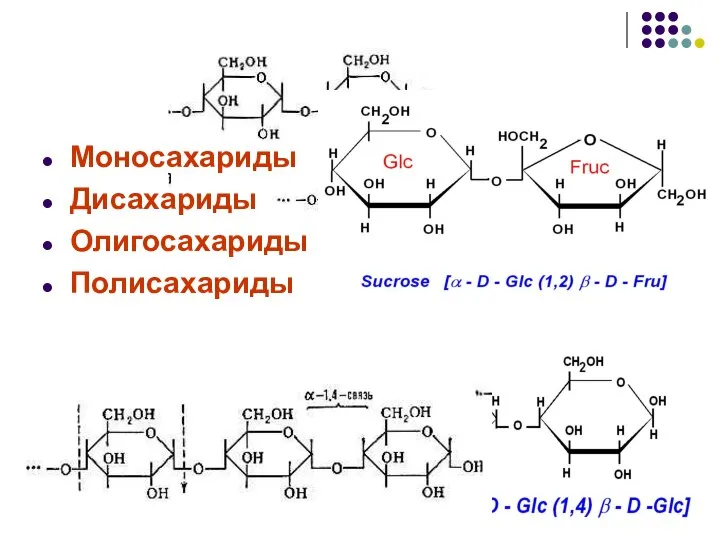
- 30. Моносахариды Дисахариды Олигосахариды Полисахариды
- 31. Глюкоза Главный источник энергии во многих клетках В результате последовательного ряда реакций окисления превращается в различные
- 32. Полисахариды Используются для запасания энергии впрок (гликоген – у животных, крахмал – у растений) Из простых
- 33. Жирные кислоты
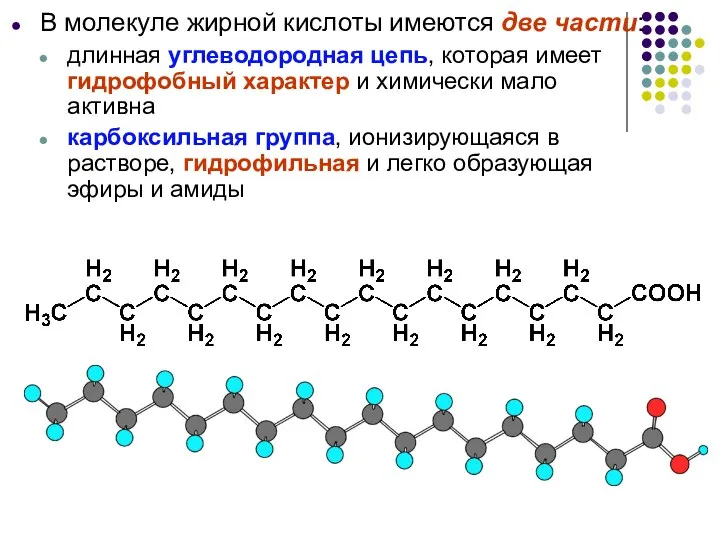
- 34. В молекуле жирной кислоты имеются две части: длинная углеводородная цепь, которая имеет гидрофобный характер и химически
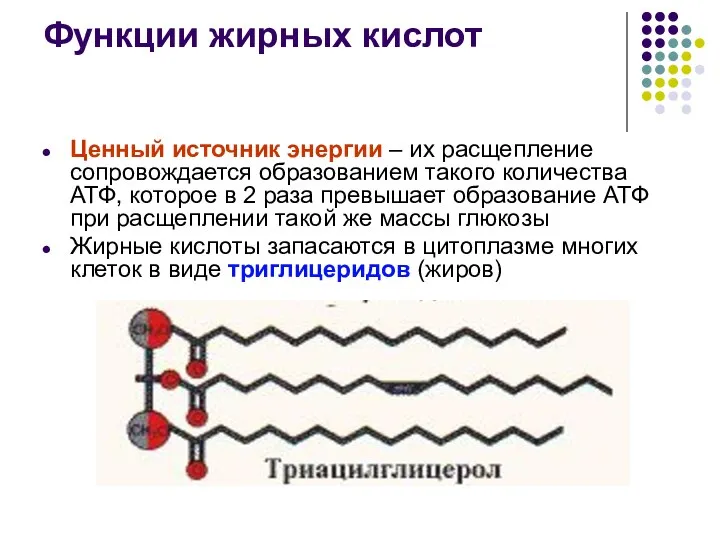
- 35. Функции жирных кислот Ценный источник энергии – их расщепление сопровождается образованием такого количества АТФ, которое в
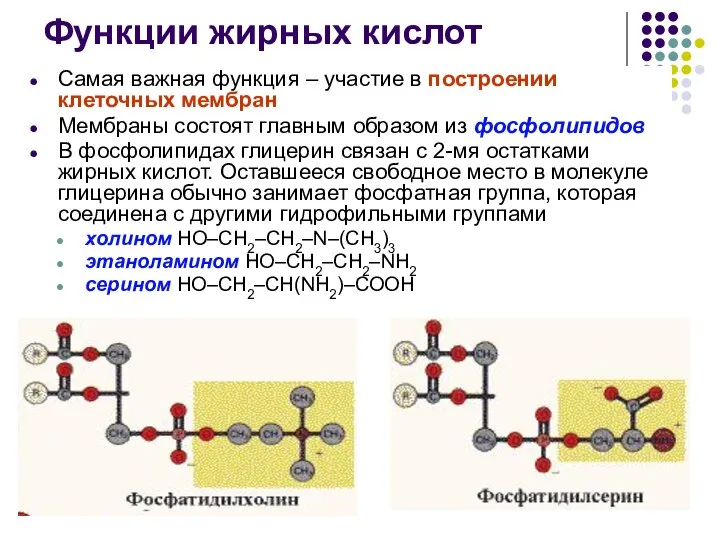
- 36. Функции жирных кислот Самая важная функция – участие в построении клеточных мембран Мембраны состоят главным образом
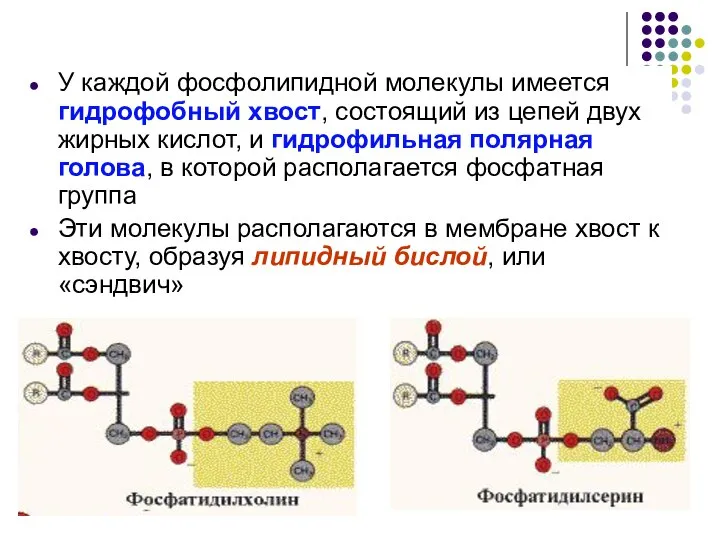
- 37. У каждой фосфолипидной молекулы имеется гидрофобный хвост, состоящий из цепей двух жирных кислот, и гидрофильная полярная
- 38. Аминокислоты
- 39. Аминокислоты Различаются по химическому составу Все они являются α-аминокислотами Служат строительными блоками при синтезе белков –линейных
- 40. Нуклеотиды
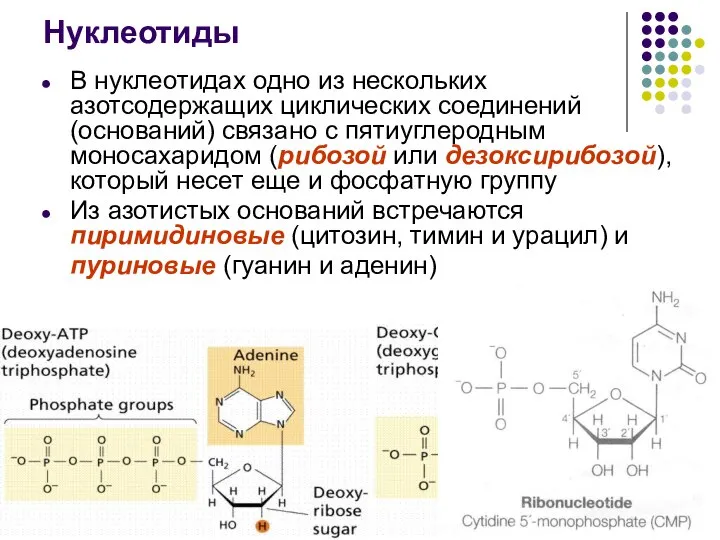
- 41. Нуклеотиды В нуклеотидах одно из нескольких азотсодержащих циклических соединений (оснований) связано с пятиуглеродным моносахаридом (рибозой или
- 42. Функции нуклеотидов Нуклеотиды – переносчики энергии (например, АТФ), отдельных химических групп (атомы Н, остатки моносахаридов) и
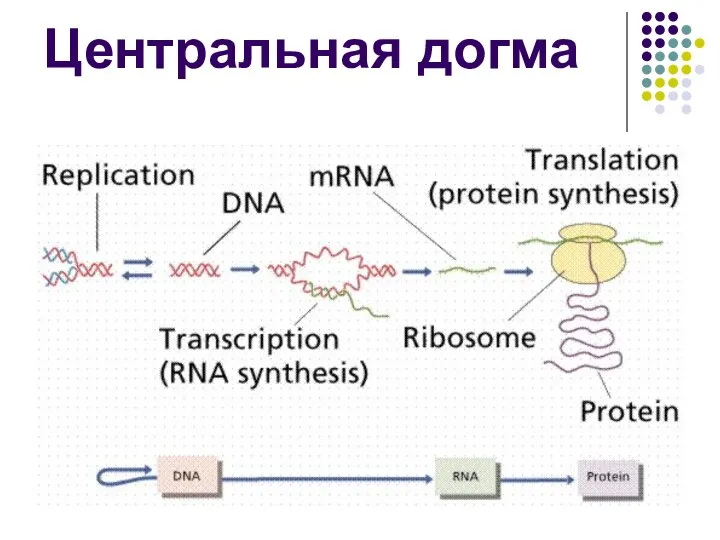
- 43. Центральная догма
- 44. Вывод Живые организмы – автономные самовоспроизводящиеся химические системы Они построены из специфического и вместе с тем
- 46. Скачать презентацию
































 Строение и деятельность внутренних органов
Строение и деятельность внутренних органов Зелёная аптека
Зелёная аптека Законы Менделя
Законы Менделя Презентация на тему Лишайники
Презентация на тему Лишайники  Презентация на тему Отряд Акулы
Презентация на тему Отряд Акулы  Неандертальцы
Неандертальцы Презентация на тему "Чистая вода" - скачать презентации по Биологии
Презентация на тему "Чистая вода" - скачать презентации по Биологии Biology 177: Principles of Modern Microscopy
Biology 177: Principles of Modern Microscopy Муравьи рядом с нами
Муравьи рядом с нами Пастбищные клещи: особенности морфологии
Пастбищные клещи: особенности морфологии «Видообразование. Результаты микроэволюции.» учителя биологии МОУ СОШ «№5» Рыбальченко О.В.
«Видообразование. Результаты микроэволюции.» учителя биологии МОУ СОШ «№5» Рыбальченко О.В. Нервная система. Рефлекс. Инстинкт
Нервная система. Рефлекс. Инстинкт  Презентация по теме «Центры происхождения культурных растений». 10 класс
Презентация по теме «Центры происхождения культурных растений». 10 класс  Слуховая сенсорная система. Слуховой анализатор
Слуховая сенсорная система. Слуховой анализатор Функции органов дыхания. Дыхательная система
Функции органов дыхания. Дыхательная система Вирусы
Вирусы Класс насекомые
Класс насекомые Вирусы. Строение вируса
Вирусы. Строение вируса ВПР по биологии в 5 классе 2018 год. №7 Работа с текстом
ВПР по биологии в 5 классе 2018 год. №7 Работа с текстом Неправильное питание
Неправильное питание  перелетные птицы
перелетные птицы The Insulin Receptor
The Insulin Receptor История изучения происхождения млекопитающих. (Тема 1)
История изучения происхождения млекопитающих. (Тема 1) 10 самых умных животных на Земле
10 самых умных животных на Земле Теории биогенеза и абиогенеза о происхождении живого вещества. Теории А.И. Опарина и С.Миллера о происхождении жизни на Земле
Теории биогенеза и абиогенеза о происхождении живого вещества. Теории А.И. Опарина и С.Миллера о происхождении жизни на Земле Апельсин Жарким пламенем горит , Оранжевый , как солнце , Сильным запахом манит Сок под толстой кожицей . Снимем цедру осторо
Апельсин Жарким пламенем горит , Оранжевый , как солнце , Сильным запахом манит Сок под толстой кожицей . Снимем цедру осторо Презентация на тему Строение животной клетки
Презентация на тему Строение животной клетки  Презентация на тему "Дрозофіла – модельний організм генетичних експериментів" - скачать бесплатно презентации по Биологии
Презентация на тему "Дрозофіла – модельний організм генетичних експериментів" - скачать бесплатно презентации по Биологии