Содержание
- 2. Сортировка (транспорт) белков
- 3. "Признаки адреса" для идентификации органеллы В 1980 Гюнтер Блобель сформулировал основные принципы индентификации и нацеливания белков
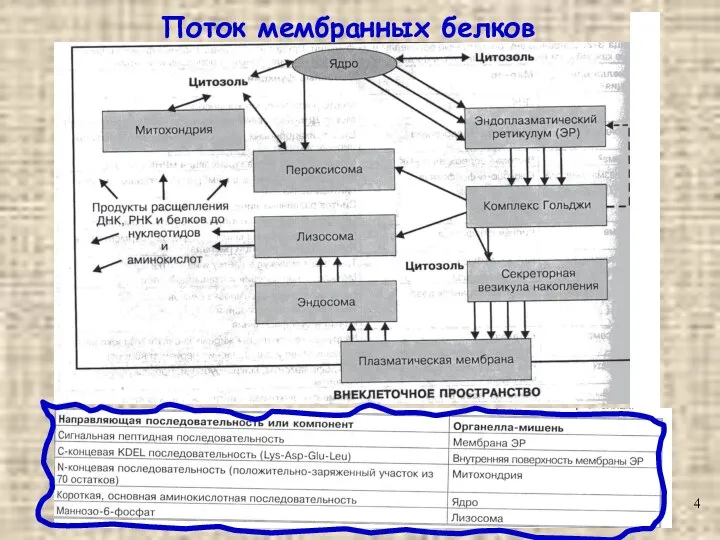
- 4. Поток мембранных белков
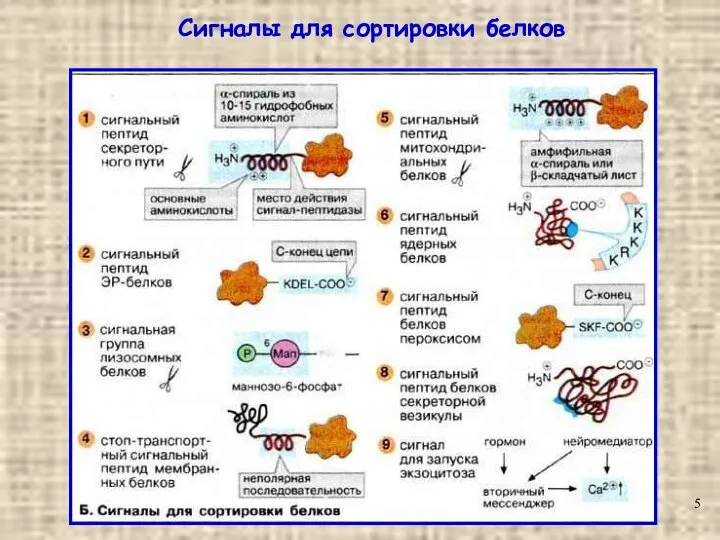
- 5. Сигналы для сортировки белков
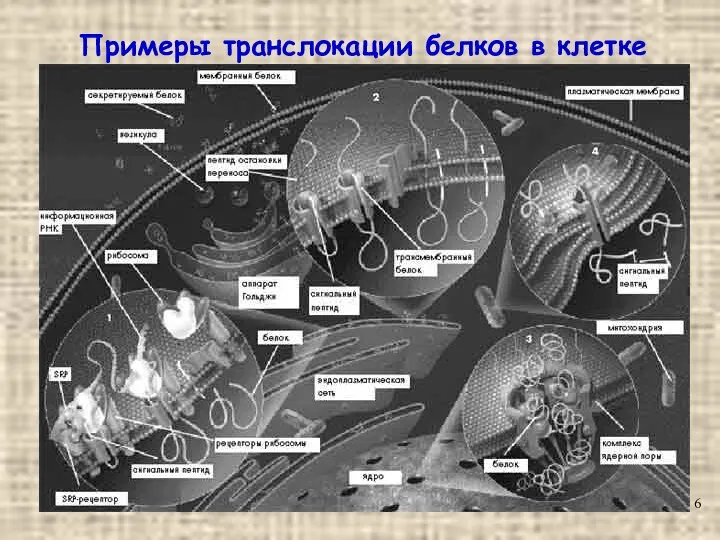
- 6. Примеры транслокации белков в клетке
- 7. Транслокация белков
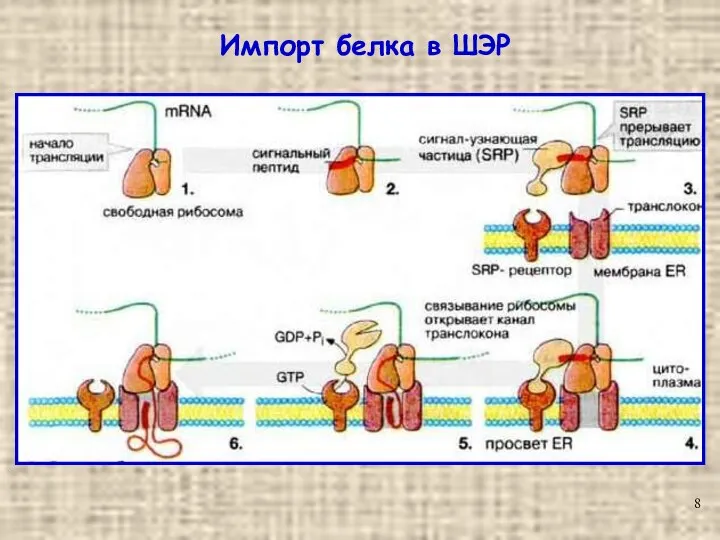
- 8. Импорт белка в ШЭР
- 9. Синтез белка на шероховатом ЭР Большинство белков, встроенных в мембрану ЭР или пересекающих ее , на
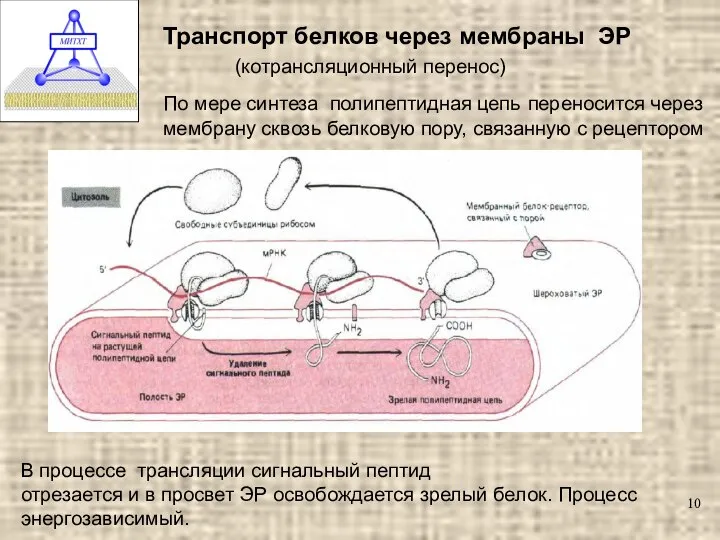
- 10. Транспорт белков через мембраны ЭР (котрансляционный перенос) По мере синтеза полипептидная цепь переносится через мембрану сквозь
- 11. Модификация белков в ШЭР
- 12. Импорт крупных ядерных белков
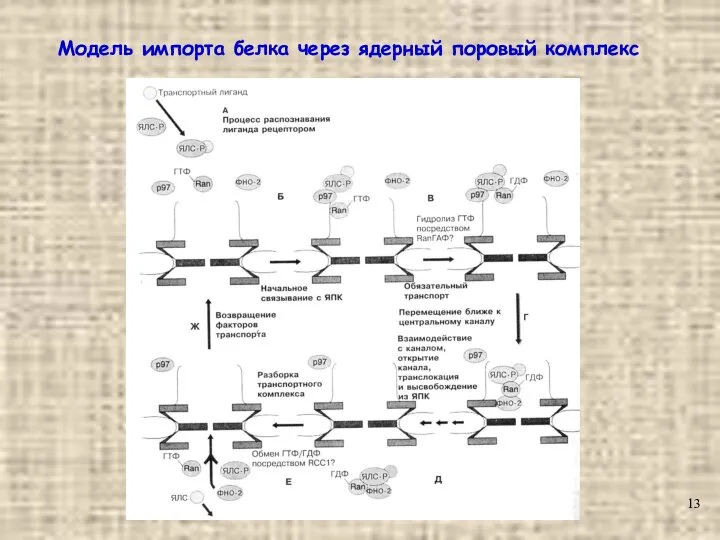
- 13. Модель импорта белка через ядерный поровый комплекс
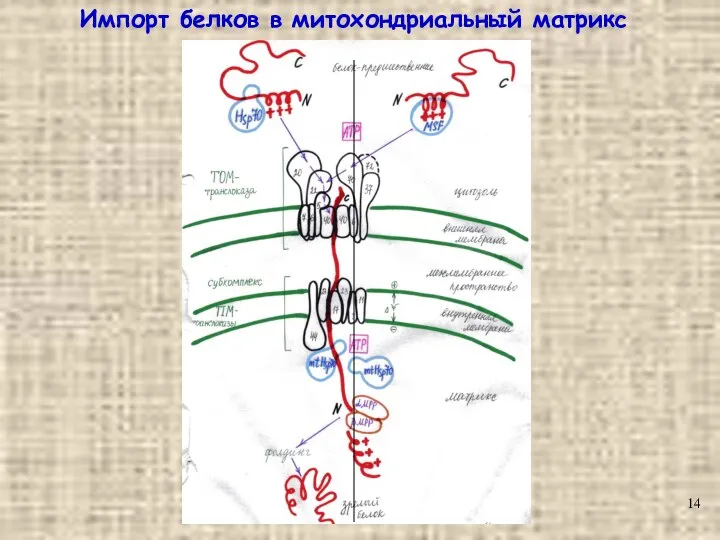
- 14. Импорт белков в митохондриальный матрикс
- 15. Импорт белков в митохондриальный матрикс
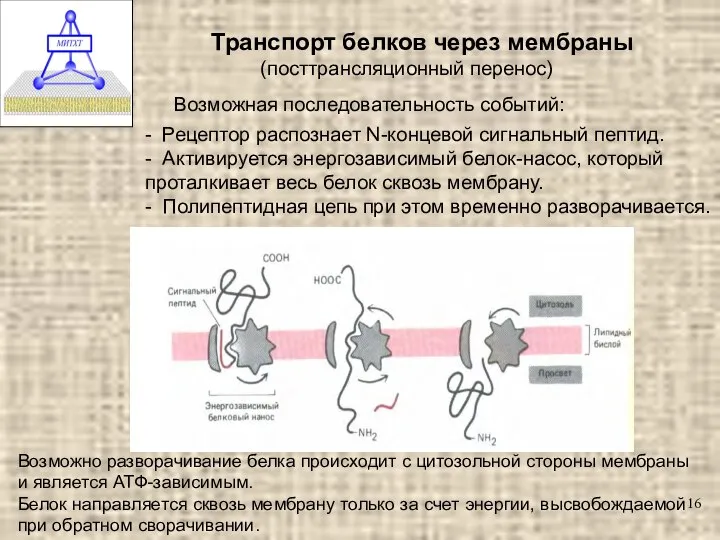
- 16. Транспорт белков через мембраны (посттрансляционный перенос) - Рецептор распознает N-концевой сигнальный пептид. - Активируется энергозависимый белок-насос,
- 17. Импорт белка во внутреннюю мембрану митохондрий
- 18. Импорт белка во внутреннюю мембрану митохондрий
- 19. Встраивание белков в мембрану Имеется один старт-пептид и один стоп-пептид, перенос белка прекращается, когда стоп-пептид достигнет
- 20. Конкретные белки, ответственные за транслокацию, разные для разных органелл, но принцип один тот же: распознавание сигнального
- 21. Шероховатый эндоплазматический ретикулум и аппарат Гольджи
- 22. Транспортные пузырьки Основные принципы формирования пузырьков
- 23. Транспортные пузырьки
- 24. Транспорт между различными компартментами органеллы осуществляется с помощью везикул, которые отпочковываются от «донорной мембраны» и потом
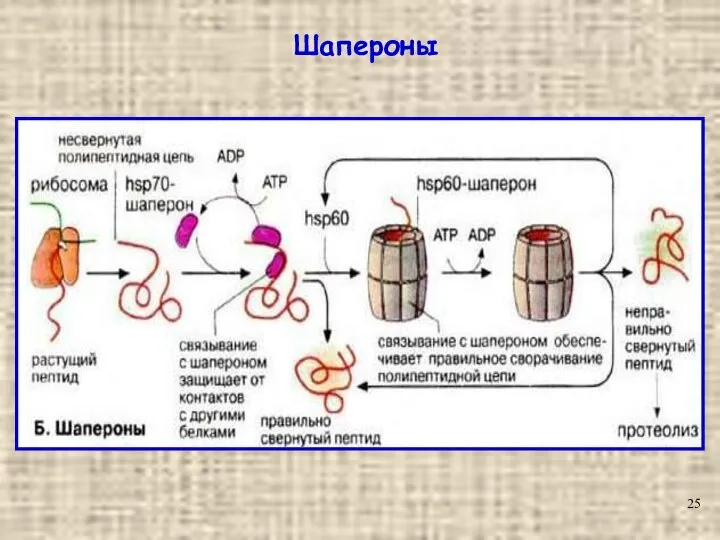
- 25. Шапероны
- 26. Нобелевская премия по химии за 2004 год «за открытие убиквитин-опосредованного разложения белка» "В последние десятилетия биохимия
- 27. Убиквитин-опосредованное разложение белка Энзим E1 образует с убиквитином активированный комплекс. Для осуществления процесса необходима энергия в
- 28. Рибосома - фабрика для синтеза белка Протеасома - фабрика для уничтожения белка
- 29. 3d-модели субъединиц рибосом 30S-субъединица: 1 молекула РНК и 32 белка 50S-субъединица: 3 молекулы РНК и 46
- 30. Исследование функций рибосом A molecular ruler. Венкатраман Рамакришнан установил, что за безошибочную работу рибосом ответственны нуклеотиды
- 31. Исследование функций рибосом Главная функция большой субъединицы – синтез полипептидной цепи:
- 32. Исследование функций рибосом Переход тРНК из А-сайта в Р-сайт за счет её поворота:
- 33. Синтез новых антибиотиков Способы воздействия антибиотиков на работу рибосом: Блокировка туннеля, по которому полипептид покидает рибосому
- 35. Скачать презентацию























 Диагностика описторхоза плотоядных и простогонимоза кур
Диагностика описторхоза плотоядных и простогонимоза кур 20140422_domashnie_zhivotnye2
20140422_domashnie_zhivotnye2 Labmeeting paper. Purkinje cells directly inhibit granule cells in specialized regions of the cerebellar cortex
Labmeeting paper. Purkinje cells directly inhibit granule cells in specialized regions of the cerebellar cortex Эволюция систем регуляции
Эволюция систем регуляции Виконала: Учениця 7 – Б класу Нікітіна Єлизавета
Виконала: Учениця 7 – Б класу Нікітіна Єлизавета  Презентация на тему "Интересные факты о пчелах" - скачать бесплатно презентации по Биологии
Презентация на тему "Интересные факты о пчелах" - скачать бесплатно презентации по Биологии Фотосистема ІІ
Фотосистема ІІ  Строение животной клетки
Строение животной клетки Презентация на тему "Генотип как целостная система. Взаимодействие генов" - скачать презентации по Биологии
Презентация на тему "Генотип как целостная система. Взаимодействие генов" - скачать презентации по Биологии История открытия нуклеиновой кислоты
История открытия нуклеиновой кислоты Пищеварительная система человека
Пищеварительная система человека Осевой и добавочный скелет
Осевой и добавочный скелет Презентация Организмы в мировом океане
Презентация Организмы в мировом океане  Презентация на тему "Шкідливий вплив тютюнопаління на організм людини" - скачать бесплатно презентации по Биологии
Презентация на тему "Шкідливий вплив тютюнопаління на організм людини" - скачать бесплатно презентации по Биологии Різноманітність тварин у природі
Різноманітність тварин у природі  В союзе с природой Экологический турнир в 6 – х классах Степучева Ольга Викторовна Учитель химии и биологии МБОУ СОШ № 9 МО ЩР с
В союзе с природой Экологический турнир в 6 – х классах Степучева Ольга Викторовна Учитель химии и биологии МБОУ СОШ № 9 МО ЩР с Консультация к ЕГЭ. Аутосомно-доминантный тип наследования
Консультация к ЕГЭ. Аутосомно-доминантный тип наследования Класс Млекопитающие (Звери)
Класс Млекопитающие (Звери)  Презентация по биологии Класс двудольные семейство крестоцветные
Презентация по биологии Класс двудольные семейство крестоцветные  Насекомые
Насекомые Интегрированный урок по физике биологии, экологии.
Интегрированный урок по физике биологии, экологии. Чудесные цветники весной
Чудесные цветники весной Птицы Челябинской области
Птицы Челябинской области Санаторная школа-интернат с. Виахту Слуховой анализатор Автор-составитель: © 2009 Долбнев В.В., учитель биологии и географии высшей категории
Санаторная школа-интернат с. Виахту Слуховой анализатор Автор-составитель: © 2009 Долбнев В.В., учитель биологии и географии высшей категории Жизнь и загадки пресного водоёма (экскурсия)
Жизнь и загадки пресного водоёма (экскурсия) Доказательства эволюции
Доказательства эволюции Явище змочування та капілярності в побуті,природі та техніці
Явище змочування та капілярності в побуті,природі та техніці Генетические процессы в популяции. Лекция 10
Генетические процессы в популяции. Лекция 10