Содержание
- 2. Колігативні властивості розчинів одностороння дифузія розчинника через напівпроникну мембрану у бік більш концентрованого розчину називається осмосом.
- 3. Частинки розчинника (сині) здатні перетинати мембрану, частинки розчиненої речовини (червоні) - ні.
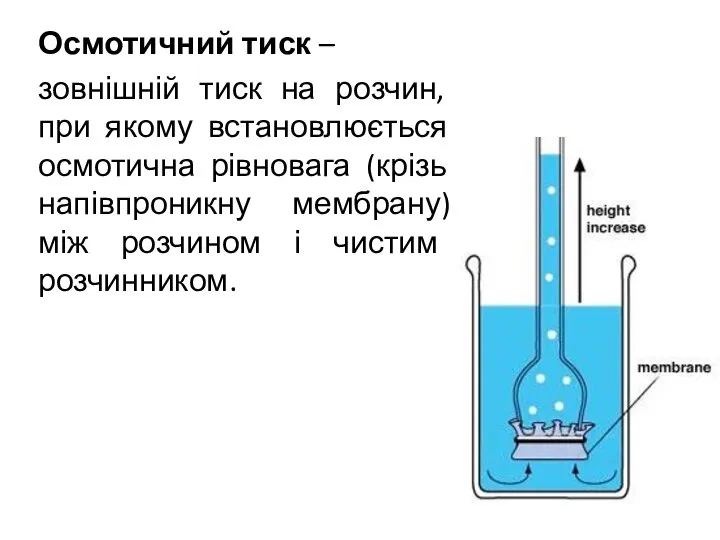
- 4. Осмотичний тиск – зовнішній тиск на розчин, при якому встановлюється осмотична рівновага (крізь напівпроникну мембрану) між
- 5. Закон Вант-Гоффа: Осмотичний тиск розчину дорівнює тому тискові, який мала б розчинена речовина, якби вона при
- 6. Осмотичний тиск крові людини при 37ºC 780 кПа = 7,8∙105 Па (7,7 атм).
- 7. Розчини з однаковим значенням осмотичного тиску називаються ізотонічними Ізотонічними відносно крові являються розчини ω (NaCl) =
- 10. Скачать презентацию






 Презентация на тему "Береза – символ России" - скачать презентации по Биологии
Презентация на тему "Береза – символ России" - скачать презентации по Биологии Зелёные морские водоросли
Зелёные морские водоросли Презентация на тему "Взгляд на эволюцию" - скачать бесплатно презентации по Биологии
Презентация на тему "Взгляд на эволюцию" - скачать бесплатно презентации по Биологии Проблемы искусственного синтеза белка
Проблемы искусственного синтеза белка Ужовник сальвиния
Ужовник сальвиния Шаблоны Ментальных карт
Шаблоны Ментальных карт Форма черепа и его изменчивость
Форма черепа и его изменчивость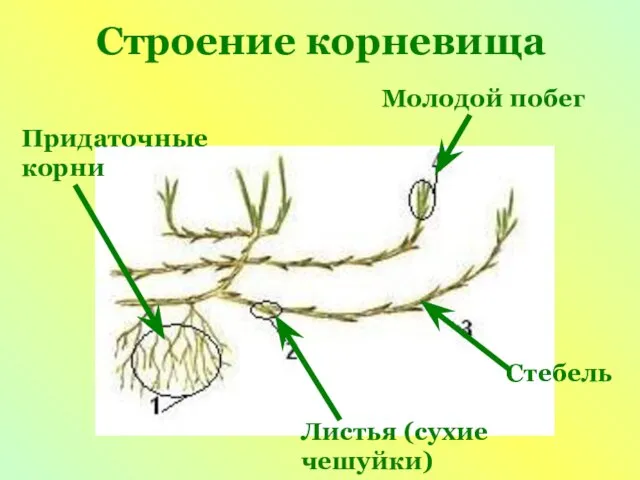 Строение корневища Молодой побег
Строение корневища Молодой побег Lepechin Ivan Ivanovich
Lepechin Ivan Ivanovich Биология 6 класс
Биология 6 класс Тип Плоские черви. Белая планария
Тип Плоские черви. Белая планария  Мейоз
Мейоз Презентация на тему Для чего свет нужен растениям 6 класс
Презентация на тему Для чего свет нужен растениям 6 класс Кто умеет летать
Кто умеет летать Строение сердца человека
Строение сердца человека ПОДЦАРСТВО ВЫСШИЕ РАСТЕНИЯ ОТДЕЛ МОХОВИДНЫЕ. ОСОБЕННОСТИ СТРОЕНИЯ И ЖИЗНЕДЕЯТЕЛЬНОСТИ
ПОДЦАРСТВО ВЫСШИЕ РАСТЕНИЯ ОТДЕЛ МОХОВИДНЫЕ. ОСОБЕННОСТИ СТРОЕНИЯ И ЖИЗНЕДЕЯТЕЛЬНОСТИ  Дикие животные. Белый медведь, верблюд, обезьяна. (Часть 2)
Дикие животные. Белый медведь, верблюд, обезьяна. (Часть 2) Многообразие земноводных Жовтобрюх Андрея 7”В”Класса
Многообразие земноводных Жовтобрюх Андрея 7”В”Класса Презентация на тему "Обмен веществ. Этапы и особенности метаболизма" - скачать презентации по Биологии
Презентация на тему "Обмен веществ. Этапы и особенности метаболизма" - скачать презентации по Биологии Вымерший гигант-мегалодон
Вымерший гигант-мегалодон Женская репродуктивная система
Женская репродуктивная система Свиньи. Породы свиней
Свиньи. Породы свиней Кудрявый клен
Кудрявый клен Шоколад. Плюсы и минусы
Шоколад. Плюсы и минусы Строение человека Система кровообращения
Строение человека Система кровообращения Серый кит
Серый кит Основы гельминтологии. Тип плоские черви (plathelminthes). Класс ленточные черви (cestoidea)
Основы гельминтологии. Тип плоские черви (plathelminthes). Класс ленточные черви (cestoidea) Биология человека: содержание. Предмет молекулярной биологии
Биология человека: содержание. Предмет молекулярной биологии