Содержание
- 2. История исследований в молекулярной биологии Апрель 1953 г. - предложена модель пространственной структуры ДНК - двойная
- 3. Джеймс Уотсон (р. 1928) Френсис Крик (1916-2004) 1952 г работа над моделированием ДНК Основа: правило Чаргаффа
- 4. "...выдающийся харизматический символ нашего времени - спиральная лестница, ведущая, я надеюсь, в небеса, - была разрекламирована
- 5. Актуальность темы лекции: открытия молекулярной биологии играют важную роль в развитии современной медицины Использование ДНК-технологий выявление
- 6. Генная и клеточная терапия – «небеса», к которым привела спиральная лестница ДНК Генная терапия – лечение
- 7. Клеточная терапия Терапия с использованием стволовых клеток С помощью определенных генов можно перепрограммировать клетку и изменить
- 8. Цель лекции Знать: строение и функции нуклеиновых кислот химико-биологическую сущность процессов репликации, транскрипции, трансляции Использовать знания
- 9. План лекции 1. Строение и функции ДНК и РНК (самостоятельное повторение курса химии с использованием слайдов
- 10. Строение нуклеиновых кислот Функция: хранение, передача, реализация наследственной информации Нуклеиновые кислоты (НК) - биополимеры Мономер –
- 11. Пентозы в структуре нуклеиновых кислот
- 12. Первичная структура НК: последовательность нуклеотидов Химические связи: 1 - 5′-фосфоэфирная 2 – N-гликозидная 3 - 3′,5′
- 13. Вторичная структура ДНК: двойная спираль Правозакрученная спираль (виток = 10 н.п.) Цепи антипараллельны: 5′→3′ и 3′→
- 14. Третичная структура ДНК: нуклеопротеидные комплексы (хромосомы) Гистоновые белки: белки с высоким содержанием лиз и арг 5
- 15. Структура нуклеосом
- 16. Пространственная структура РНК Одноцепочечная Шпильки – спирализованные участки (водородные связи) Не соблюдается правило Чаргаффа Виды РНК:
- 17. тРНК Структура тРНК: 1 – шпильки 2 - петли молекулы-адапторы: переводят информацию мРНК в последовательность аминокислот
- 18. рРНК структурный компонент рибосом 80% от общего количества РНК в клетке 4 типа у эукариот: 5S,
- 19. РЕПЛИКАЦИЯ: синтез ДНК Протекает в ядре в S-фазу клеточного цикла перед митозом Стимулы: гормоны, ростовые факторы,
- 20. 1 этап репликации: инициация Формирование репликативной вилки: ДНК-топоизомераза расщепляет 3′,5′-фосфодиэфирную связь в одной из цепей ДНК
- 21. Схема инициации репликации
- 22. 2 этап репликации: элонгация Синтез новых цепей ДНК Лидирующая цепь: 3′ - 5′ (синтез непрерывный по
- 23. 3 этап репликации: терминация Исключение праймеров Завершение формирования отстающей цепи ДНК Эндонуклеаза (РНКаза) удаляет РНК-праймер ДНК-полимераза
- 24. Схема репликативной вилки
- 25. Репарация ошибок и повреждений ДНК Причина повреждений ДНК: действие факторов окружающей и внутренней среды Повреждение ДНК
- 26. Схема работы системы репарации ДНК
- 27. Роль системы репарации Репарация необходима для сохранения генома и возможна благодаря существованию 2-х цепей ДНК Снижение
- 28. ТРАНСКРИПЦИЯ: синтез РНК Протекает в ядре вне зависимости от фаз клеточного цикла Матрица: нить ДНК 3′
- 29. 1 этап транскрипции: инициация Промотор – последовательность ДНК (ТАТА), с которой связывается РНК-полимераза Сайт терминации –
- 30. 2 этап транскрипции: элонгация и терминация Элонгация: рост нити пре-РНК Факторы элонгации (E, H, F) повышают
- 31. Схема транскрипции
- 32. Посттранскрипционные модификации пре-РНК «Созревание» пре-мРНК «Кэпирование» на стадии элонгации Образование поли(А)- «хвоста» после транскрипции Сплайсинг –
- 33. Схема «созревания» пре-мРНК
- 34. «Созревание» пре-тРНК Удаление интронов Модификация азотистых оснований (10-15%) Формирование акцепторного участка и антикодона 3. Выход зрелых
- 35. «Созревание» пре-рРНК
- 36. ТРАНСЛЯЦИЯ: синтез белка Место синтеза: рибосомы Матрица: мРНК Субстраты: аминокислоты (АК) Адапторы: тРНК Источники энергии: АТФ,
- 37. Свойства биологического кода Триплетность Наличие терминирующих кодонов (UAA, UAG, UGA) Специфичность Вырожденность Универсальность Однонаправленность Колинеарность
- 38. Активация аминокислот
- 39. 1 этап трансляции: инициация К мРНК присоединяется малая субъединица рибосомы, фактор инициации IF, мет-тРНК и ГТФ.
- 40. 2 этап трансляции: элонгация (рост пептидной цепи) Стадии элонгации: Связывание аа-тРНК в А-центре при участии фактора
- 41. 3 этап трансляции: терминация Высвобождение пептида из связи с тРНК и рибосомой: Стоп-кодоны UAA, UAG, UGA
- 42. Посттрансляционные модификации белков – образование функционально активных белков Частичный протеолиз Фолдинг – формирование пространственной структуры (II,
- 43. Регуляция матричных биосинтезов Экспрессия генов — процесс, в ходе которого наследственная информация от гена (последовательности нуклеотидов
- 44. Адаптивная регуляция осуществляется при участии: регуляторных белков, взаимодействующих с участками ДНК индукторов (стимулируют экспрессию) корепрессоров (подавляют
- 45. Примеры адаптивной регуляции экспрессии генов КОРТИЗОЛ (как индуктор) стимулирует присоединение регуляторного белка к энхансеру и вызывает
- 46. Примеры ингибиторов матричных биосинтезов Токсин белой поганки аманитин ингибирует РНК-полимеразу II (синтез мРНК) Энтеротоксин возбудителя дифтерии
- 47. Задание для самостоятельной работы Используя интернет-ресурсы и учебник выполните задания и составьте конспект по вопросам: 1.
- 48. Противоопухолевые и антибактериальные препараты – ингибиторы матричных биосинтезов
- 49. Заключение Процессы репликации, транскрипции, трансляции (матричные биосинтезы) лежат в основе «производства» белков и ферментов, функционирование которых
- 51. Скачать презентацию
















































 mushroom cultivation
mushroom cultivation ВИРУСЫ Презентацию подготовил ученик 10 «В» класса Зверев Вениамин
ВИРУСЫ Презентацию подготовил ученик 10 «В» класса Зверев Вениамин Строение ногтя
Строение ногтя Жақ сүйексіздер кластан жоғары топ. Дөңгелек ауыздылардың сыртқы пішіні мен құрылысы
Жақ сүйексіздер кластан жоғары топ. Дөңгелек ауыздылардың сыртқы пішіні мен құрылысы Сложное поведение ракообразных
Сложное поведение ракообразных Презентация на тему "Вода" - скачать презентации по Биологии
Презентация на тему "Вода" - скачать презентации по Биологии Мозг и способы его изучения
Мозг и способы его изучения Основы кинетики ферментативных реакций
Основы кинетики ферментативных реакций Происхождение человека. Человеческие расы. Стадии антропосоциогенеза. Адаптация человека.
Происхождение человека. Человеческие расы. Стадии антропосоциогенеза. Адаптация человека.  Микроскоп и его строение. Работа с микроскопом
Микроскоп и его строение. Работа с микроскопом Взаимодействие аллельных генов. Неполное доминирование, множественный аллелизм, кодоминирование, плейотропия
Взаимодействие аллельных генов. Неполное доминирование, множественный аллелизм, кодоминирование, плейотропия Опыты с растениями
Опыты с растениями Проект Экологическое воспитание учащихся при изучении биотических закономерностей развития экосистем Автор: Гаршина Ольга Викт
Проект Экологическое воспитание учащихся при изучении биотических закономерностей развития экосистем Автор: Гаршина Ольга Викт Презентация на тему Царство: Животные Тип: Членистоногие Подтип: Хелицеровые Класс: Паукообразные
Презентация на тему Царство: Животные Тип: Членистоногие Подтип: Хелицеровые Класс: Паукообразные Царство Животные. Подцарство Одноклеточные
Царство Животные. Подцарство Одноклеточные Бактериальный фотосинтез
Бактериальный фотосинтез Животные Арктики, тундры и Антарктики
Животные Арктики, тундры и Антарктики Тип Кольчатые черви. Класс Малощетинковые
Тип Кольчатые черви. Класс Малощетинковые Физиология синапсов
Физиология синапсов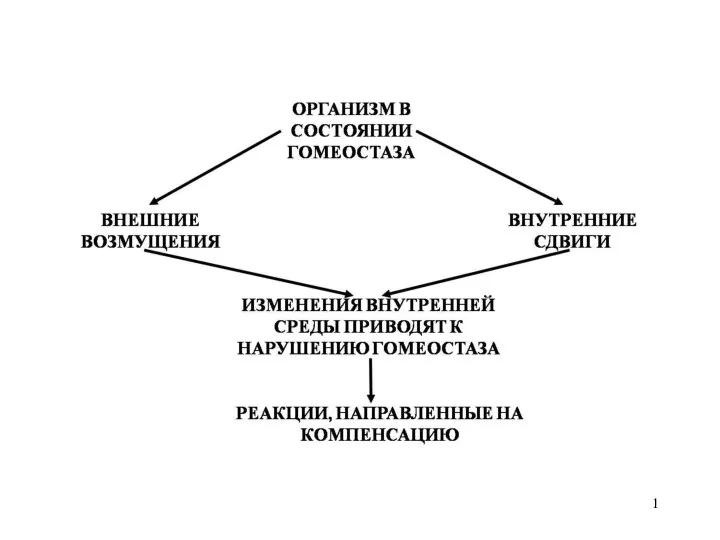 Эволюция систем регуляции
Эволюция систем регуляции Координация и регуляция
Координация и регуляция  Первоцветы
Первоцветы Белки Жиры Углеводы Презентация по Химии ученика 11-А класса УВК «Школы-коллегиум» № 14 г.Симферополя Шевцова Николая
Белки Жиры Углеводы Презентация по Химии ученика 11-А класса УВК «Школы-коллегиум» № 14 г.Симферополя Шевцова Николая Внутреннее строение млекопитающих
Внутреннее строение млекопитающих Презентация по биологии Птицы
Презентация по биологии Птицы  Адаптации организмов к условиям обитания
Адаптации организмов к условиям обитания Презентация на тему "Видовой состав птиц города Вилючинска и его окрестностей" - скачать презентации по Биологии
Презентация на тему "Видовой состав птиц города Вилючинска и его окрестностей" - скачать презентации по Биологии Как питаться правильно?
Как питаться правильно?