Содержание
- 2. Стволовые клетки
- 3. Стволовые клетки (история) 1908: российским ученым Александром Максимовым предсказано существование СК (им же введен этот термин).
- 4. Тератокарциномы – ключ к обнаружению стволовых клеток Тератокарциномы – злокачественные тератомы, которые содержат как дифференцирующиеся ткани,
- 5. Свойства тератокарциномных клеток - Неоднородный состав клеток - Аномалии кариотипа - Легко культивируются и гибридизуются -
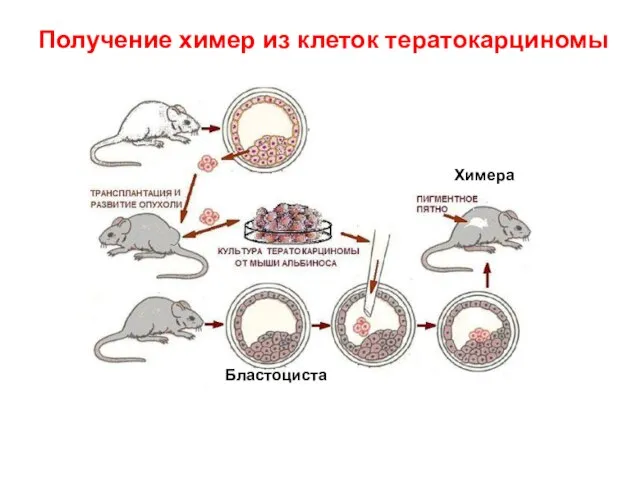
- 6. Получение химер из клеток тератокарциномы Химера Бластоциста
- 7. Получение эмбриональных стволовых клеток Классический метод (М. Эванс и М. Кауфман, 1981 г.): Источник - ВКМ
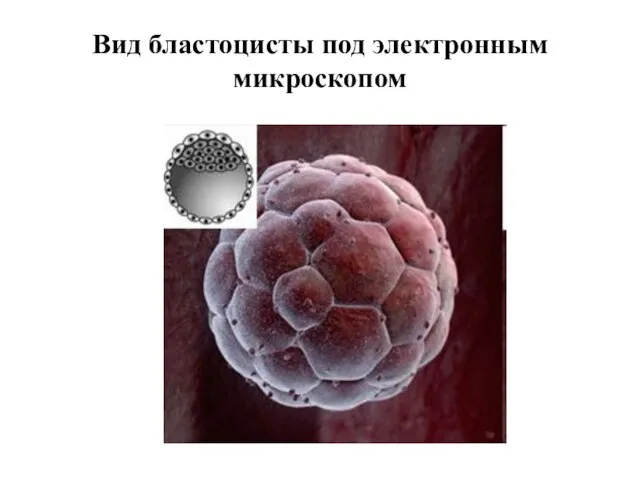
- 8. Вид бластоцисты под электронным микроскопом
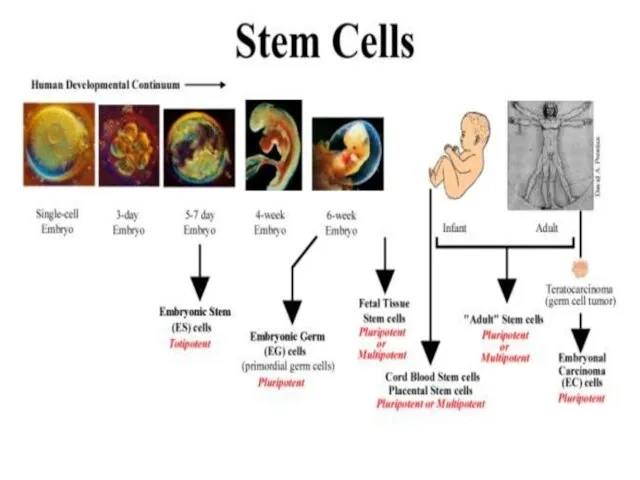
- 9. Тотипотентность (totipotency) [лат. totus — весь, целый и potentia — сила] — способность клетки дифференцироваться в
- 10. Основные свойства ЭСК 1) Плюрипотентность (тотипотентность?) 2) Нормальный кариотип 3) Самоподдержание в культуре (иммортальность ) 4)
- 11. Изоферменты щелочной фосфатазы, транскрипционные факторы Oct-4, Nanog, теломеразная активность, маркеры клеточной поверхности: SSEA-3, SSEA-4 – антигенные
- 13. Гаплоидные эмбриональные стволовые клетки — ЭС клетки с гаплоидным набором хромосом. Сочетают в себе преимущества гаплоидии
- 14. Гаплоидные половые клетки из ЭСК В 2003 г. из эмбриональных стволовых клеток получены полноценные мышиные ооциты
- 15. Андрогенные гаплоидные ЭСК (AhаESC) Получение – перенос сперматозоида в энуклеированный ооцит, развитие ооцита до бластоцисты, выделение
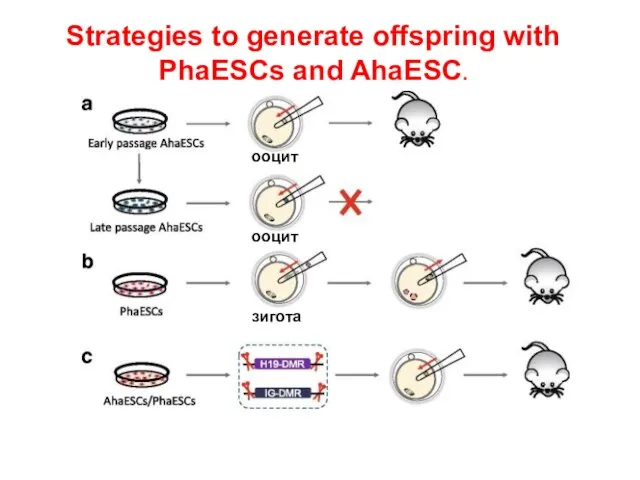
- 16. Strategies to generate offspring with PhaESCs and AhaESC. ооцит ооцит зигота
- 17. Эмбриональные стволовые клетки – подобие раковых клеток Недифференцированные клетки; Способность к долговременному делению; Высокая теломеразная активность;
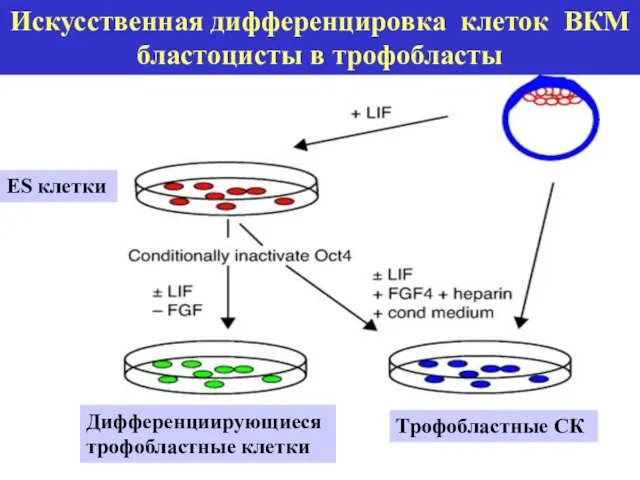
- 18. Искусственная дифференцировка клеток ВКМ бластоцисты в трофобласты Трофобластные СК ES клетки Дифференциирующиеся трофобластные клетки
- 19. Опухолевые стволовые клетки — немногочисленные специфические долгоживущие и медленно пролиферирующие опухолевые клетки, способные при трансплантации иммунодефицитным
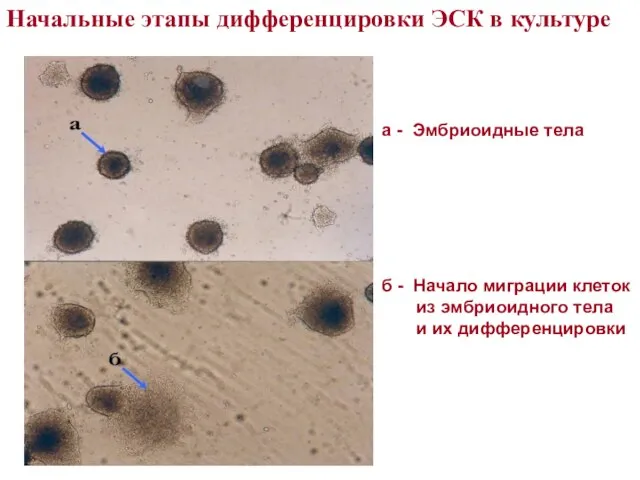
- 20. а - Эмбриоидные тела б - Начало миграции клеток из эмбриоидного тела и их дифференцировки Начальные
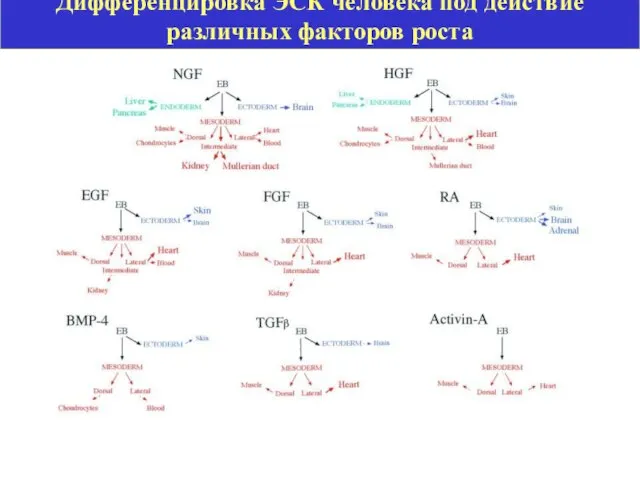
- 21. Дифференцировка ЭСК человека под действие различных факторов роста
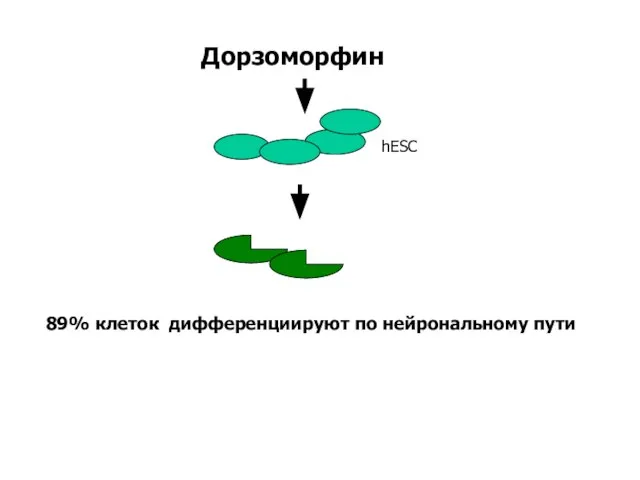
- 22. Дорзоморфин 89% клеток дифференциируют по нейрональному пути hESC
- 23. Ниша стволовых клеток
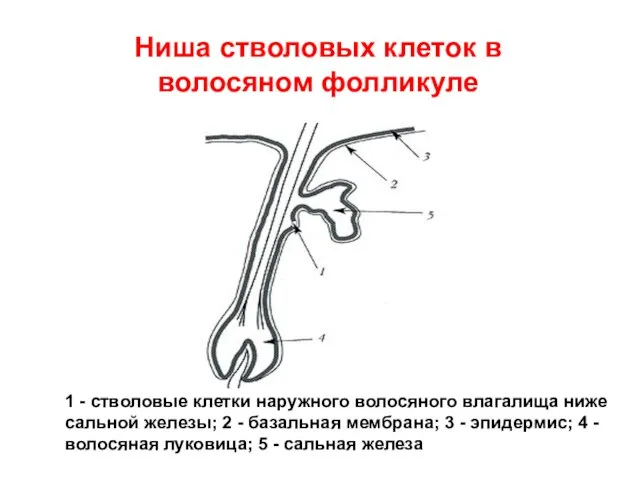
- 24. Ниша стволовых клеток в волосяном фолликуле 1 - стволовые клетки наружного волосяного влагалища ниже сальной железы;
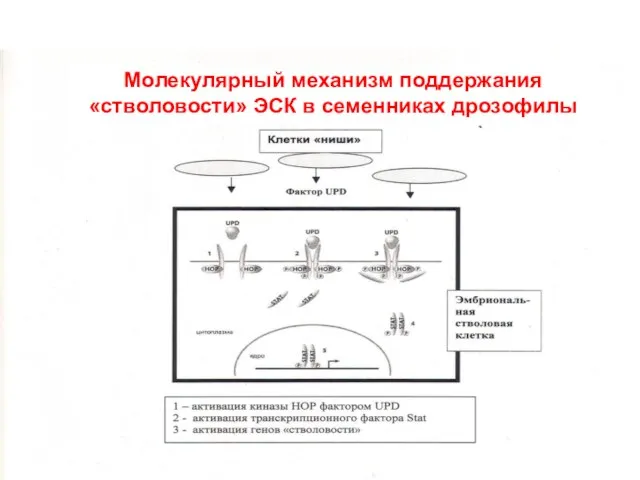
- 25. цитоплазма ядро транскрипция Молекулярный механизм поддержания «стволовости» ЭСК в семенниках дрозофилы
- 26. Ключевые факторы транскрипции, поддерживающие «стволовость» ЭСК Oct-4 – Присутствует в ЭСК, эктодерме гаструлы, примордиальных (первичных) зародышевых
- 27. Основные назначения «ниши» для стволовых клеток ограничение пролиферации стволовых клеток только необходимостью поддержи-вать тканевой гомеостаз; 2)
- 28. Региональные стволовые клетки Региональные стволовые клетки
- 29. Мезенхимальные стволовые клетки Ведут свое происхождение от зародышевого листка мезенхимы. Содержатся в костном мозге, надкостнице, жировой
- 30. Гемопоэтические стволовые клетки — плюрипотентные кроветворные стволовые клетки, которые способны многократно делиться и дифференцироваться во все
- 31. Нейрональные стволовые клетки - Мультипотентные клетки, которые способны многократно делиться и дифференцироваться во все классы нейрональных
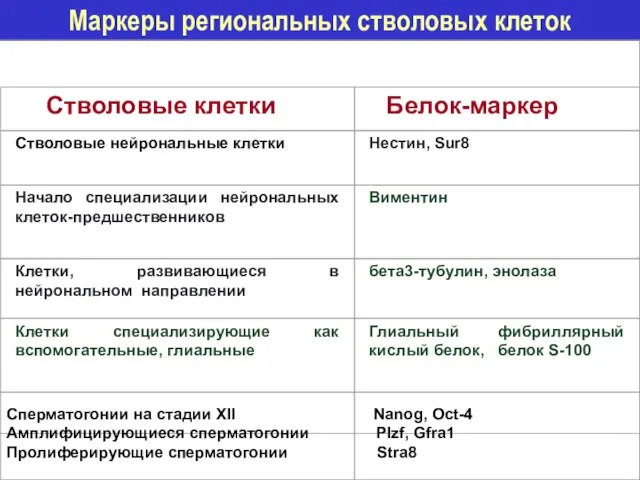
- 32. Маркеры региональных стволовых клеток Стволовые клетки Белок-маркер Стволовые нейрональные клетки Нестин, Sur8 Начало специализации нейрональных клеток-предшественников
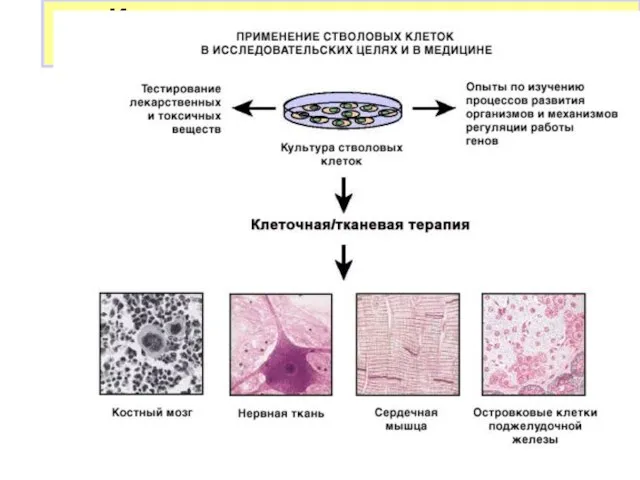
- 33. Использование стволовых клеток в исследовательских целях и в медицине Направленная дифференцировка
- 34. Перечень заболеваний, при лечении которых в отдельных случаях была успешно применена трансплантация стволовых клеток Основное внимание
- 35. В глазу человека обнаружены особые стволовые клетки, которые не только способны превращаться в высокочувствительные к свету
- 36. Индукция плюрипотентности в фибробластах с помощью ретровирусных конструкций, содержащих гены: 4 фактора: Oct3/4, Sox2, c-Myc, Klf4
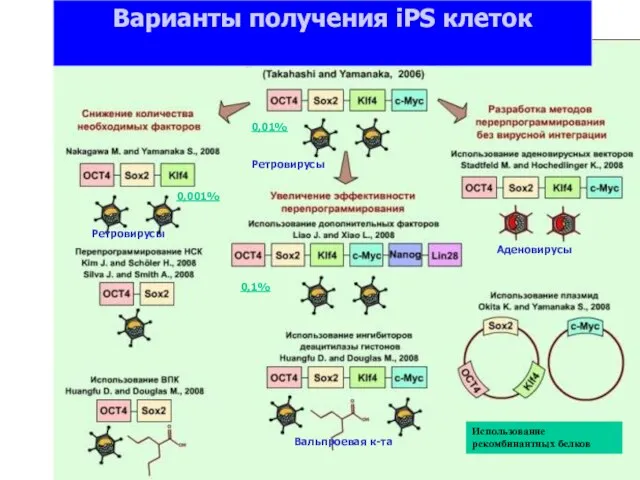
- 37. Ретровирусы Аденовирусы Вальпроевая к-та Варианты получения iPS клеток 0,01% 0,1% 0,001% Ретровирусы Использование рекомбинантных белков
- 38. Ген c-myc – ключевой для получения полноценных iPS Тест с химерными мышами показал, что 3F-iPSC (отсутствие
- 39. Дальнейшее развитие метода 1) Использование белков (2011). 2) Химически индуцированные плюрипотентные стволовые клетки, ХИПСК (смесь из
- 40. Cочетание трех небольших соединений (форсколина, основного фактора роста фибробластов и ингибитора фермента киназы гликогенсинтазы-3 GSK-3beta )
- 41. Белок Oct-4 – играет ключевую роль в самообновлении недифференцированных эмбриональных стволовых клеток. Клетки кожи с введенным
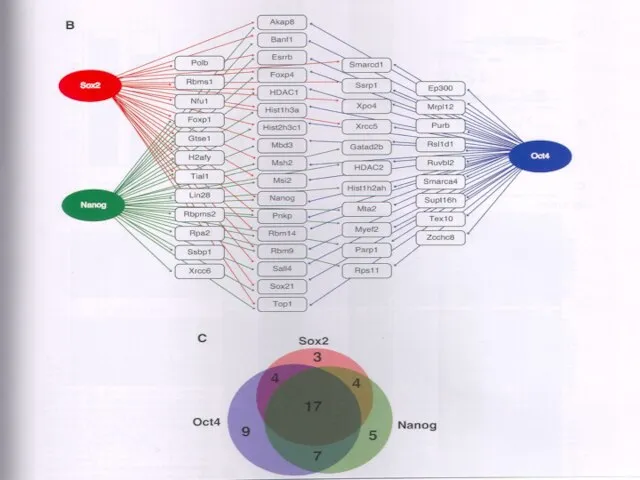
- 42. Спектр белков, с которым взаимодействуют коровые транскрипционные факторы в ЭСК
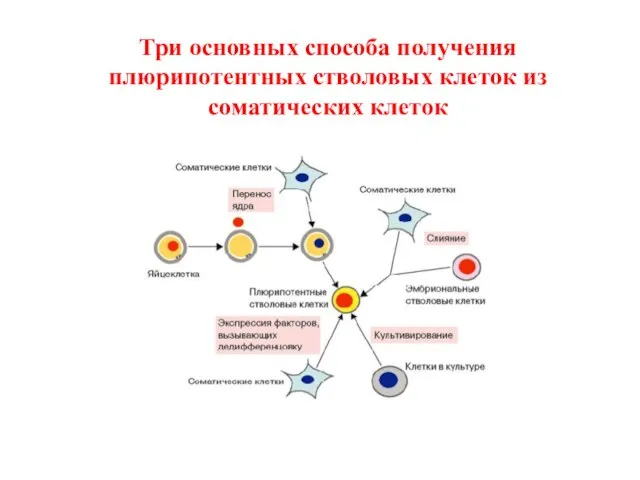
- 43. Три основных способа получения плюрипотентных стволовых клеток из соматических клеток
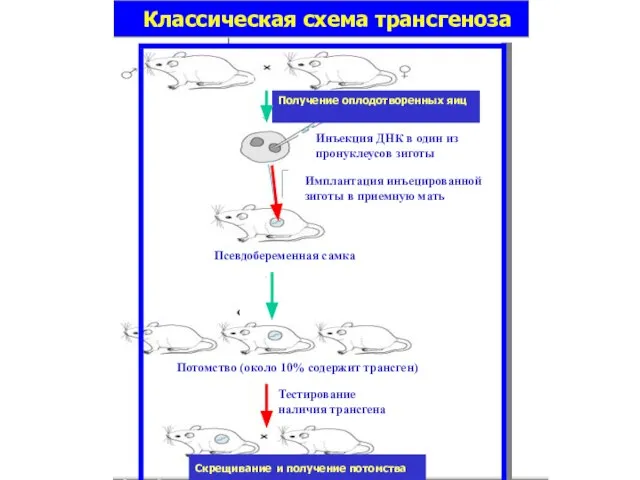
- 44. Трансгеноз, трансгенез (transgenesis) [лат. trans(ferre) — переносить и греч. genes(is) — происхождение] — искусственный перенос экзогенной
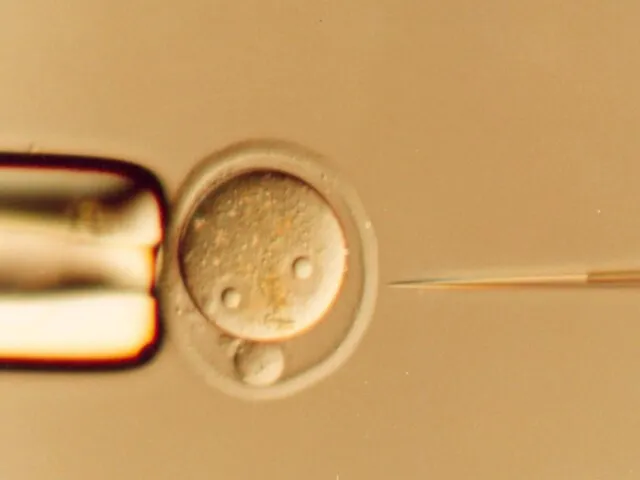
- 45. Инъекция ДНК в один из пронуклеусов зиготы Имплантация инъецированной зиготы в приемную мать Псевдобеременная самка Тестирование
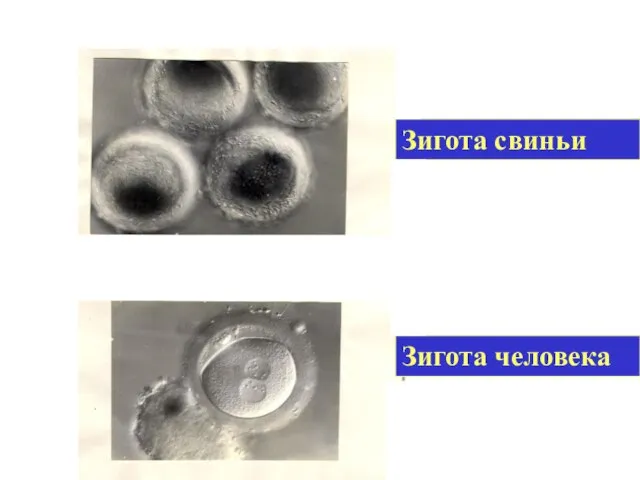
- 46. Зигота человека Зигота свиньи
- 48. Из истории микроинъекций Т. Лин, середина 60-х годов – первые микроинъекции веществ в яйцеклетку мыши Гермерад,
- 49. 1. Приемы переноса генов с помощью вирусов SV-40 и MoMLV (Р. Яниш, Б. Минц с 1974
- 50. Перенос вирусов в с/х животных Salter, 1987 – куры (вирус лейкемии птиц) Narvey, 1990 – овцы
- 51. Схема переноса генов с использованием ретровирусных векторов Культуральная среда
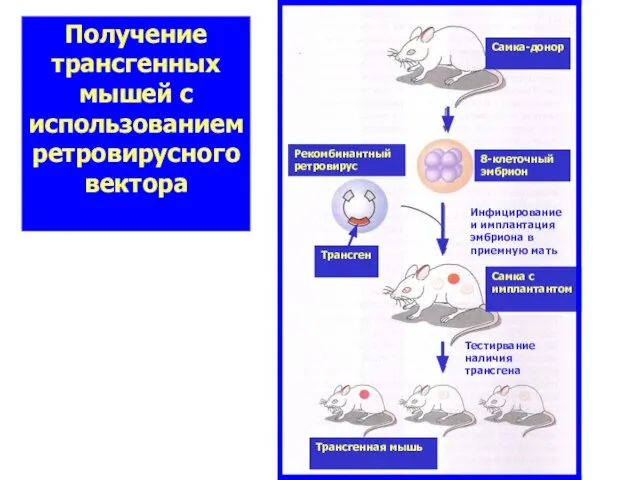
- 52. Получение трансгенных мышей с использованием ретровирусного вектора 8-клеточный эмбрион Самка-донор Рекомбинантный ретровирус Трансген Инфицирование и имплантация
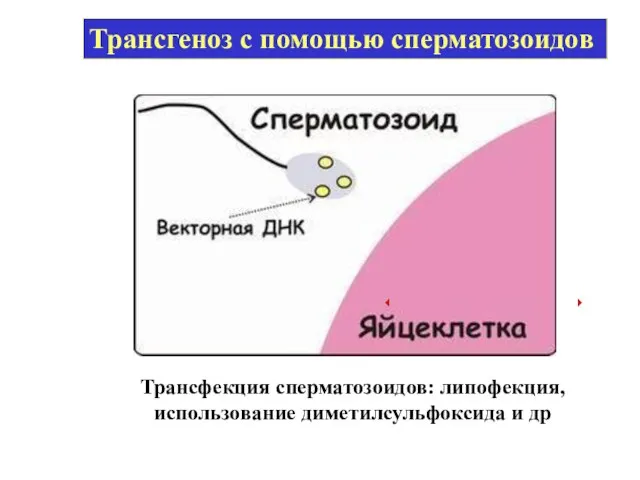
- 53. Трансфекция сперматозоидов: липофекция, использование диметилсульфоксида и др Трансгеноз с помощью сперматозоидов
- 54. Bracket et al., 1971 – захват спермиями чужеродной ДНК Lavitrano et al., 1989 – трансгенная мышь
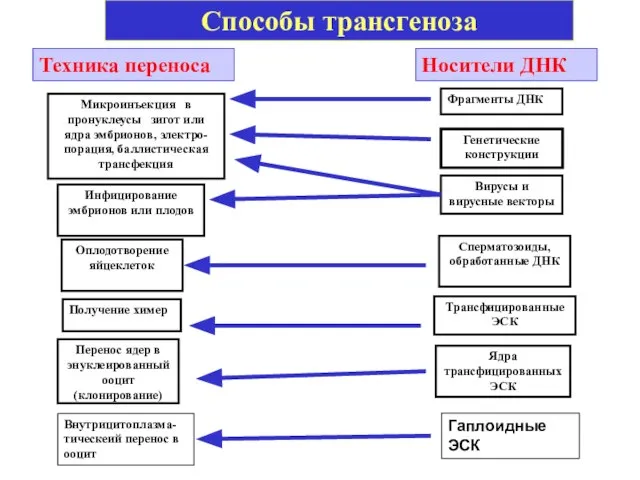
- 55. Способы трансгеноза Микроинъекция в пронуклеусы зигот или ядра эмбрионов, электро-порация, баллистическая трансфекция Фрагменты ДНК Техника переноса
- 56. Эмпирически подобранные условия для наиболее эффективного получения трансгенных организмов (мышей) с помощью микроинъекций Для инъекций удобен
- 57. На сегодняшний день: 1 трансгенная мышь из 10-40 инъецированных зигот 1 трансгенная корова из 1600 инъецированных
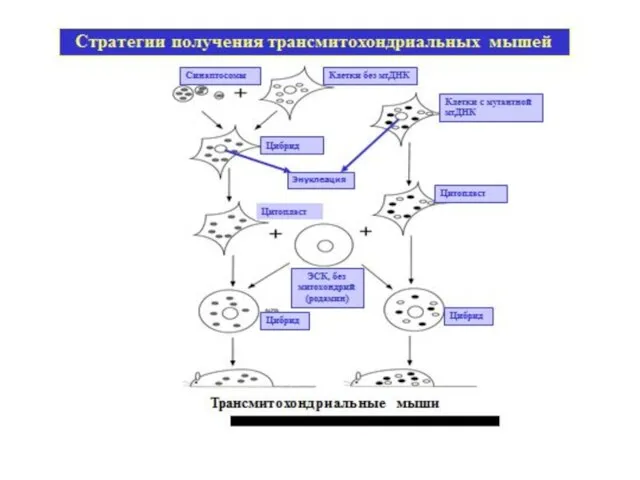
- 58. Трансмитохондриальный организм (trans-mitochondrial organism) — животный организм, содержащий в своих клетках митохондрии другого организма, который получают
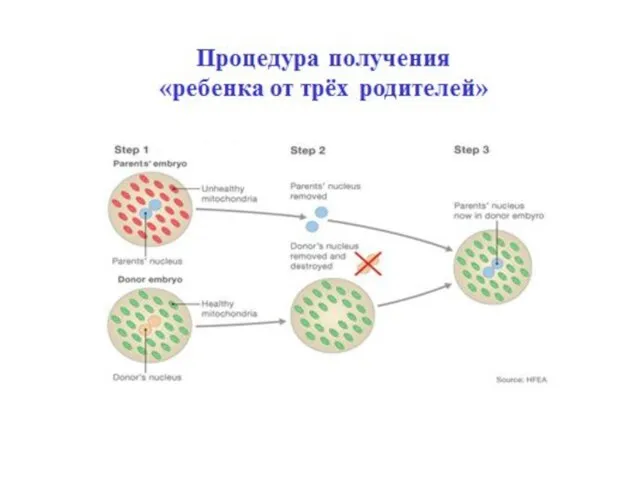
- 60. «Ребенок от трёх родителей» - Митохондриальные болезни встречаются у 1 из 6500 детей. - Описано около
- 62. Цисгеноз (сisgenesis) — процесс получения генетически-модифицированных организмов, основанный на методах генной инженерии, при котором в отличие
- 63. Паратрансгеноз (paratransgenesis) [лат. para — возле, при, вне, trans(ferre) — переносить и греч. genesis — происхождение]
- 64. -- Изучение функции генов - Изучение механизмов регуляции экспрессии генов (ткане – и стадиеспецифическая экспрессия) -
- 66. Скачать презентацию





![Тотипотентность (totipotency) [лат. totus — весь, целый и potentia — сила]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/515691/slide-8.jpg)


































 Прокариотическая клетка
Прокариотическая клетка Презентация на тему «Лекарственные и ядовитые растения» Презентацию подготовила ученица 6 А класса МОУ-СОШ № 33 Резнеченко Ангел
Презентация на тему «Лекарственные и ядовитые растения» Презентацию подготовила ученица 6 А класса МОУ-СОШ № 33 Резнеченко Ангел Отряд Непарнокопытные
Отряд Непарнокопытные  КОЛЬЧАТЫЕ ЧЕРВИ. ДОЖДЕВОЙ ЧЕРВЬ Нет сомнения, что вряд ли есть еще другие животные, которые сыграли бы столь важную роль в ист
КОЛЬЧАТЫЕ ЧЕРВИ. ДОЖДЕВОЙ ЧЕРВЬ Нет сомнения, что вряд ли есть еще другие животные, которые сыграли бы столь важную роль в ист Zarządzanie zasobami przyrody
Zarządzanie zasobami przyrody Тема: Перенос веществ в организме позвоночных животных.
Тема: Перенос веществ в организме позвоночных животных.  Презентация Хлор
Презентация Хлор Формирование скелета головы
Формирование скелета головы Асимметрия больших полушарий мозга и особенности развития способностей детей различающихся по латеральному профилю Исследоват
Асимметрия больших полушарий мозга и особенности развития способностей детей различающихся по латеральному профилю Исследоват Комнатные растения
Комнатные растения СВОЯ ИГРА ОБОБЩАЮЩИЙ УРОК Рыбы, Земноводные и Пресмыкающиеся Разработала : учитель биологии Отряскина Т.А.
СВОЯ ИГРА ОБОБЩАЮЩИЙ УРОК Рыбы, Земноводные и Пресмыкающиеся Разработала : учитель биологии Отряскина Т.А.  ОРГАНИЗМ ЧЕЛОВЕКА. МИФЫ И РЕАЛЬНОСТЬ Человеческий организм — это одна из наивысших самоорганизованных и саморегулирующихся биос
ОРГАНИЗМ ЧЕЛОВЕКА. МИФЫ И РЕАЛЬНОСТЬ Человеческий организм — это одна из наивысших самоорганизованных и саморегулирующихся биос Лечение патологий мочевыводящей системы у домашних животных
Лечение патологий мочевыводящей системы у домашних животных Ненаследственная изменчивость
Ненаследственная изменчивость Презентация на тему Мечников Илья Ильич
Презентация на тему Мечников Илья Ильич Тип Пластинчатые, тип Губки
Тип Пластинчатые, тип Губки Обмен углеродов
Обмен углеродов Презентация на тему Возникновение жизни и историческое развитие органического мира
Презентация на тему Возникновение жизни и историческое развитие органического мира  Презентация на тему Рак, классификация ракообразных
Презентация на тему Рак, классификация ракообразных  Корень и корневая система
Корень и корневая система Картофель
Картофель Репрезентативность геоботанических описаний лесных сообществ природного парка Кумысная поляна
Репрезентативность геоботанических описаний лесных сообществ природного парка Кумысная поляна Анатомия органов мочевыделительной системы. Надпочечники. Забрюшинное пространство
Анатомия органов мочевыделительной системы. Надпочечники. Забрюшинное пространство Презентация на тему Разнообразие растений
Презентация на тему Разнообразие растений Вид, его критерии и структура
Вид, его критерии и структура Вірусне захворювання рослин Підготувала учениця 10-б класу Стоколюк Вікторія
Вірусне захворювання рослин Підготувала учениця 10-б класу Стоколюк Вікторія  Модификационная изменчивость
Модификационная изменчивость Живая природа
Живая природа