Содержание
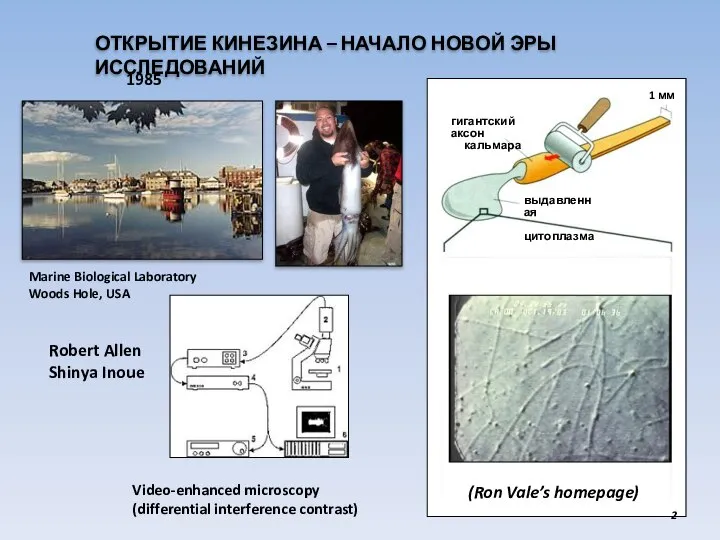
- 2. ОТКРЫТИЕ КИНЕЗИНА – НАЧАЛО НОВОЙ ЭРЫ ИССЛЕДОВАНИЙ Marine Biological Laboratory Woods Hole, USA 1 мм выдавленная
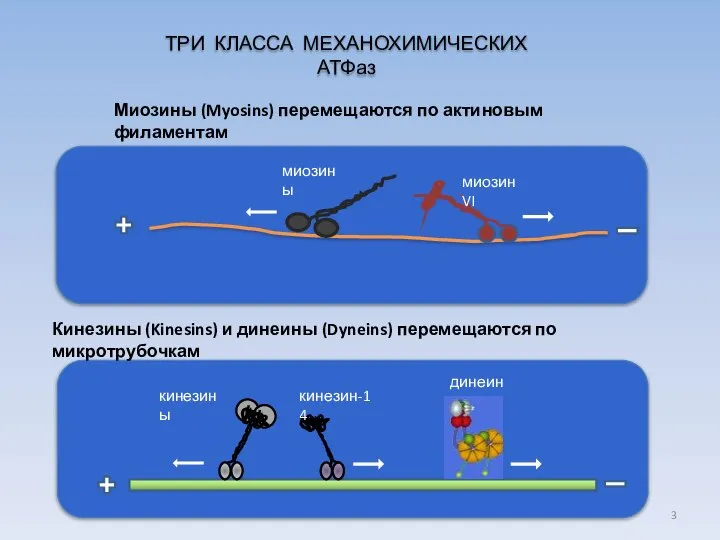
- 3. Кинезины (Kinesins) и динеины (Dyneins) перемещаются по микротрубочкам кинезины кинезин-14 динеины ТРИ КЛАССА МЕХАНОХИМИЧЕСКИХ АТФаз Миозины
- 4. МИОЗИН II ИЗ СКЕЛЕТНЫХ МЫШЦ шея Coiled coil - хвост Легкие цепи Моторные головки Область антипараллельного
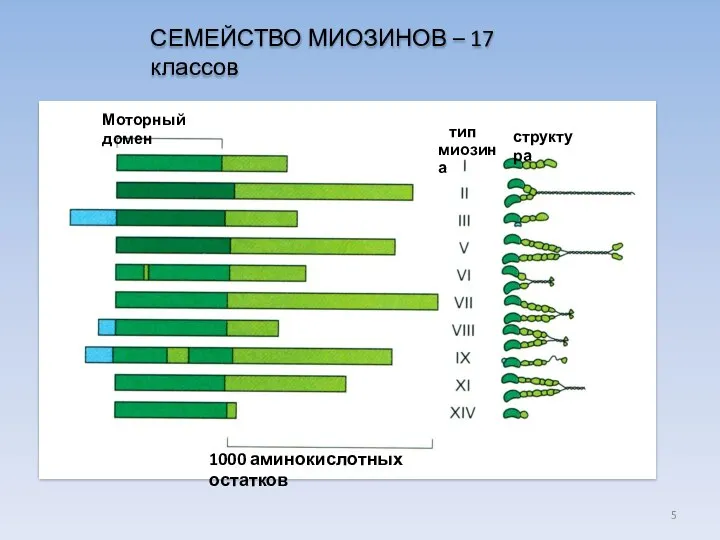
- 5. СЕМЕЙСТВО МИОЗИНОВ – 17 классов Моторный домен тип миозина структура 1000 аминокислотных остатков
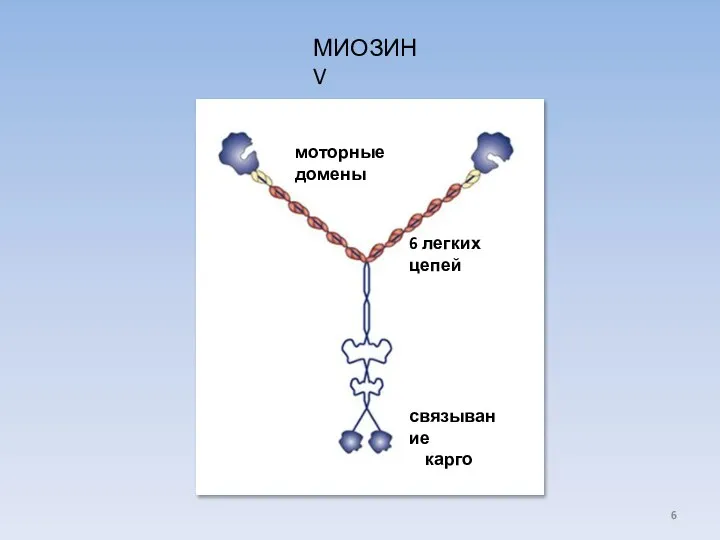
- 6. МИОЗИН V моторные домены 6 легких цепей связывание карго
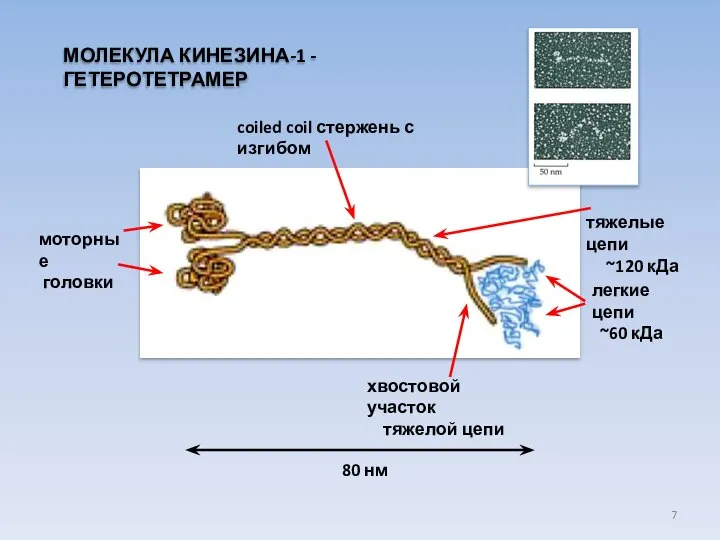
- 7. МОЛЕКУЛА КИНЕЗИНА-1 - ГЕТЕРОТЕТРАМЕР легкие цепи ~60 кДа coiled coil стержень с изгибом хвостовой участок тяжелой
- 9. КИНЕЗИНЫ: ДОМЕННАЯ СТРУКТУРА кинезин-1 Моторный домен: 360 аминокислотных остатков АТФазный центр участок связывания с микротрубочкой Кинезины,
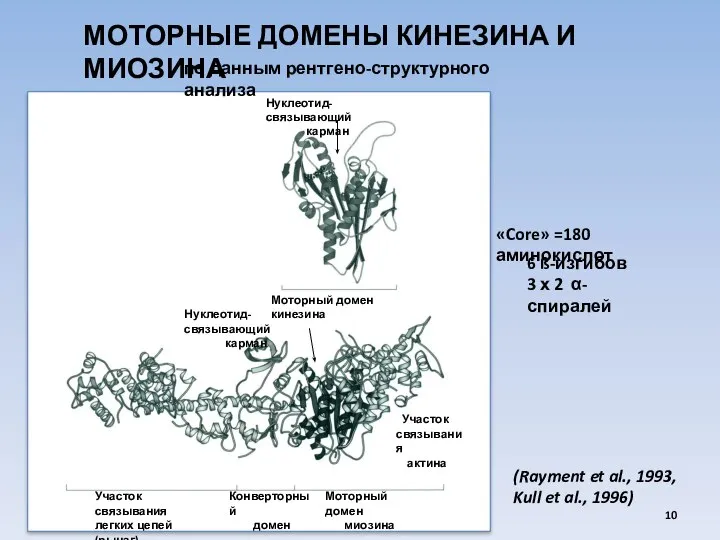
- 10. МОТОРНЫЕ ДОМЕНЫ КИНЕЗИНА И МИОЗИНА Нуклеотид-связывающий карман Моторный домен кинезина Участок связывания актина Участок связывания легких
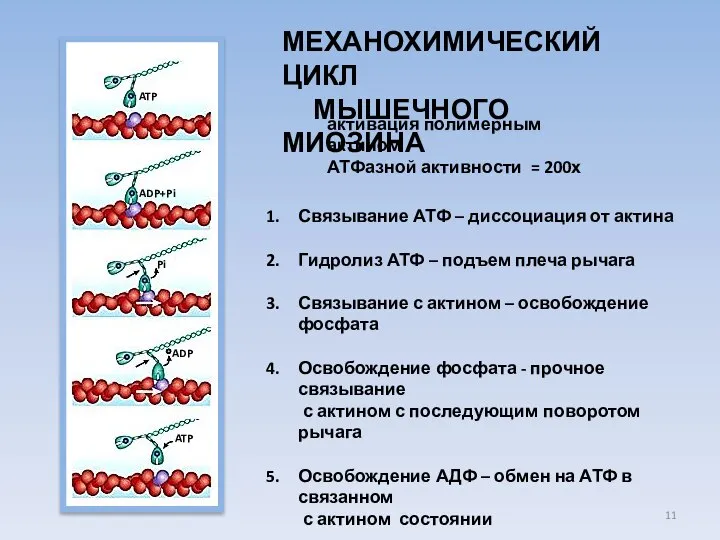
- 11. МЕХАНОХИМИЧЕСКИЙ ЦИКЛ МЫШЕЧНОГО МИОЗИНА Связывание АТФ – диссоциация от актина Гидролиз АТФ – подъем плеча рычага
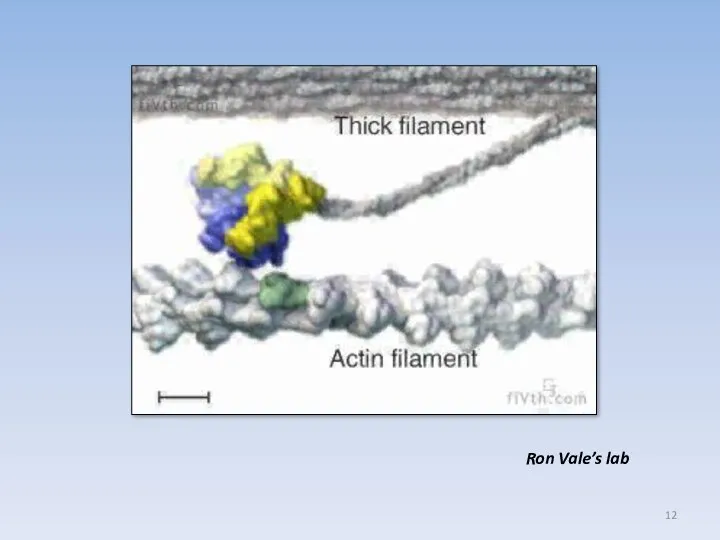
- 12. Ron Vale’s lab
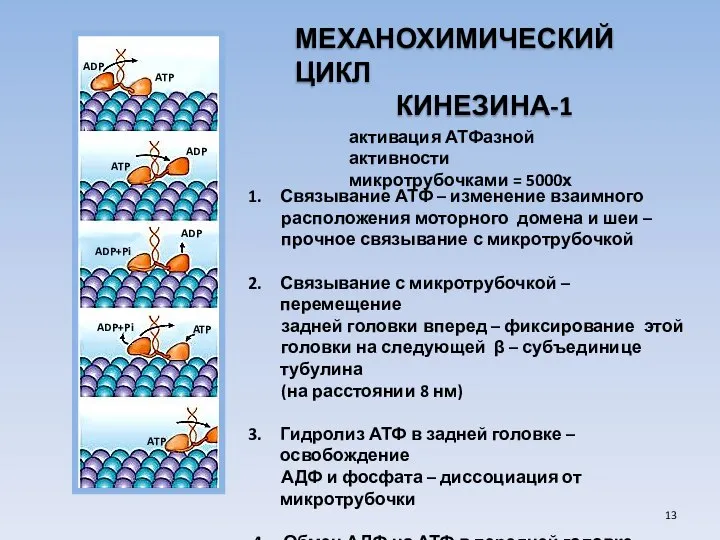
- 13. МЕХАНОХИМИЧЕСКИЙ ЦИКЛ КИНЕЗИНА-1 Связывание АТФ – изменение взаимного расположения моторного домена и шеи – прочное связывание
- 14. (Ron Vale’s lab)
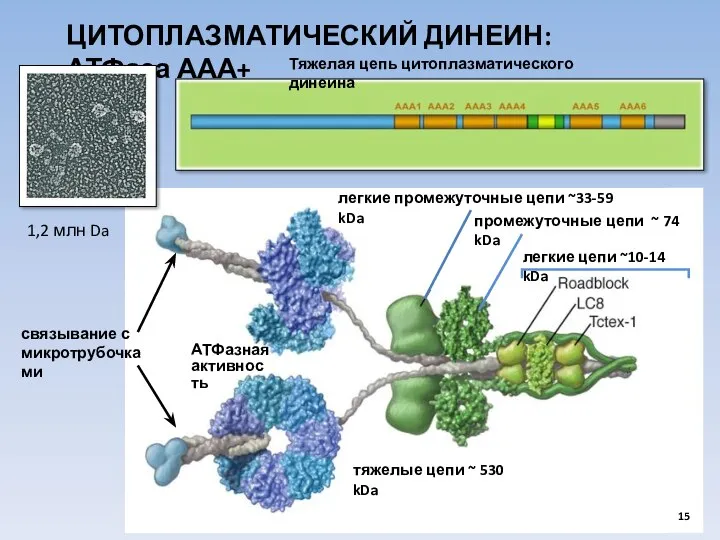
- 15. ЦИТОПЛАЗМАТИЧЕСКИЙ ДИНЕИН: АТФаза ААА+ легкие цепи ~10-14 kDa тяжелые цепи ~ 530 kDa легкие промежуточные цепи
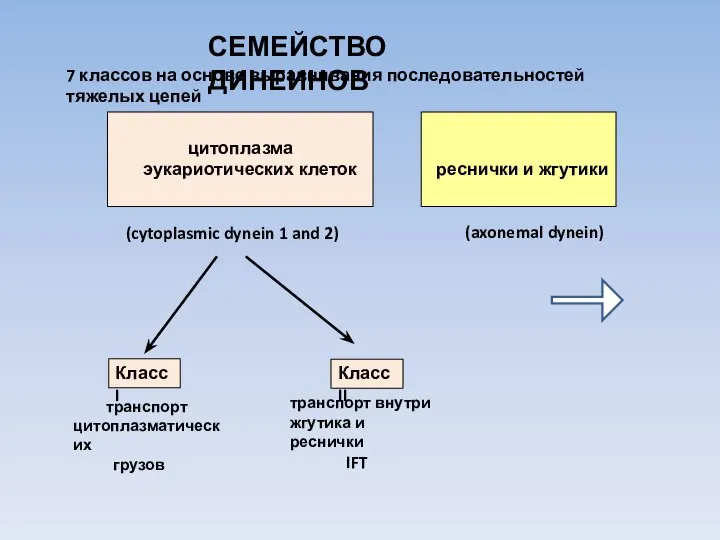
- 16. СЕМЕЙСТВО ДИНЕИНОВ 7 классов на основе выравнивания последовательностей тяжелых цепей цитоплазма эукариотических клеток реснички и жгутики
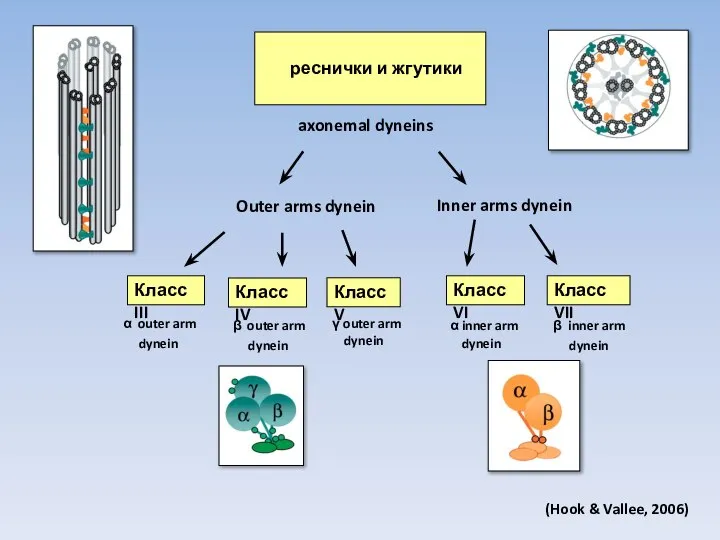
- 17. реснички и жгутики axonemal dyneins Класс III Класс IV Класс V Класс VI Класс VII Outer
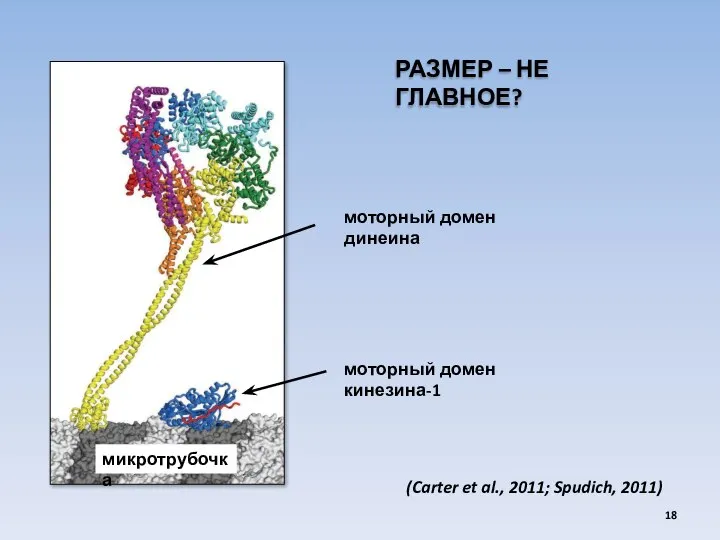
- 18. микротрубочка моторный домен динеина моторный домен кинезина-1 (Carter et al., 2011; Spudich, 2011) РАЗМЕР – НЕ
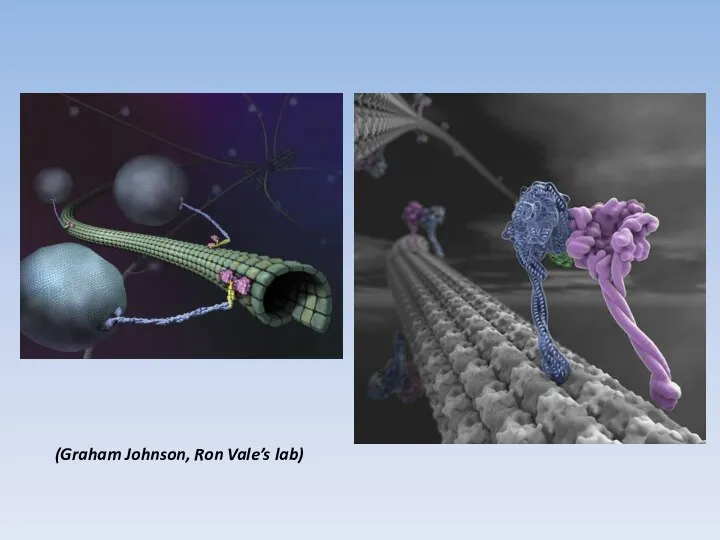
- 19. (Graham Johnson, Ron Vale’s lab)
- 20. СПОСОБЫ ИЗУЧЕНИЯ МОТОРНЫХ БЕЛКОВ Электронная микроскопия отдельных молекул с напылением металлом Рентгеноструктурный анализ: трехмерная структура молекул
- 21. КАК РАБОТАЮТ МОЛЕКУЛЯРНЫЕ МОТОРЫ? Происходит ли изменение конформации при гидролизе АТФ? Как определяется направление? От чего
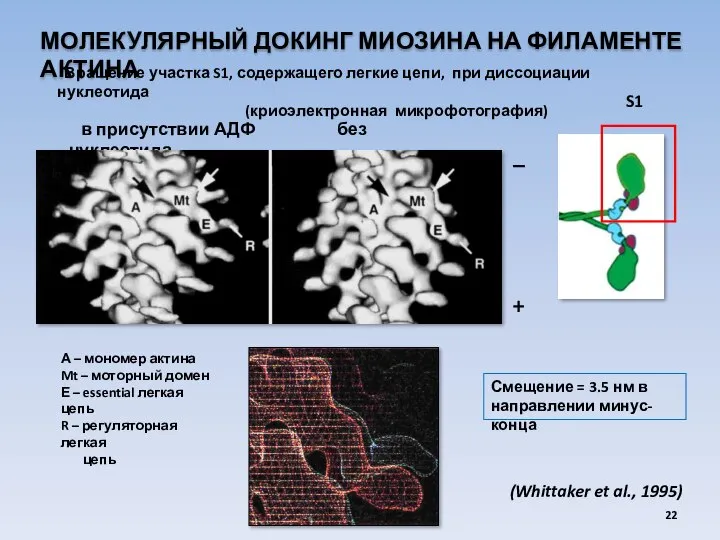
- 22. МОЛЕКУЛЯРНЫЙ ДОКИНГ МИОЗИНА НА ФИЛАМЕНТЕ АКТИНА Вращение участка S1, содержащего легкие цепи, при диссоциации нуклеотида (криоэлектронная
- 23. МОЛЕКУЛЯРНЫЙ ДОКИНГ КИНЕЗИНА НА МИКРОТРУБОЧКЕ А – прикрепленная головка F – свободная головка (Arnal & Wade,
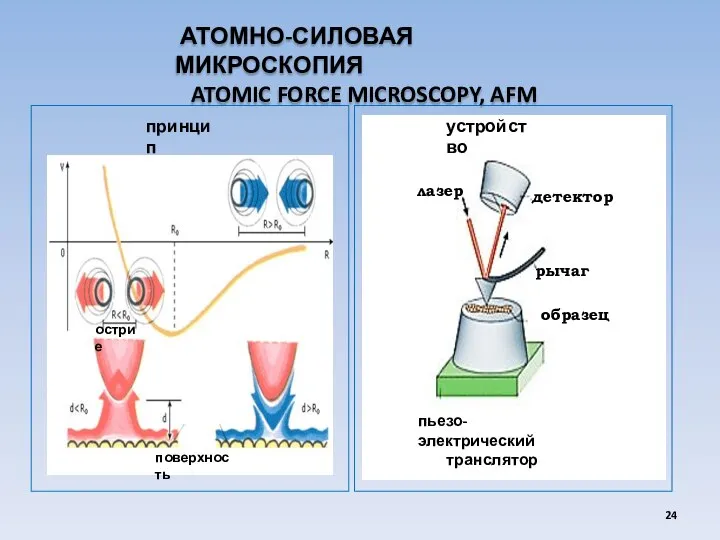
- 24. АТОМНО-СИЛОВАЯ МИКРОСКОПИЯ ATOMIC FORCE MICROSCOPY, AFM принцип устройство лазер образец рычаг пьезо-электрический транслятор детектор поверхность острие
- 25. ПО СРАВНЕНИЮ С ЭЛЕКТРОННОЙ МИКРОСКОПИЕЙ AFM: имеет близкое и даже большее разрешение дает трехмерное изображение объекта
- 26. Кинезин-1 на микротрубочке in vitro в присутствии AMPPNP Миозин V шагает по актиновому филаменту ИЗОБРАЖЕНИЯ, ПОЛУЧЕННЫЕ
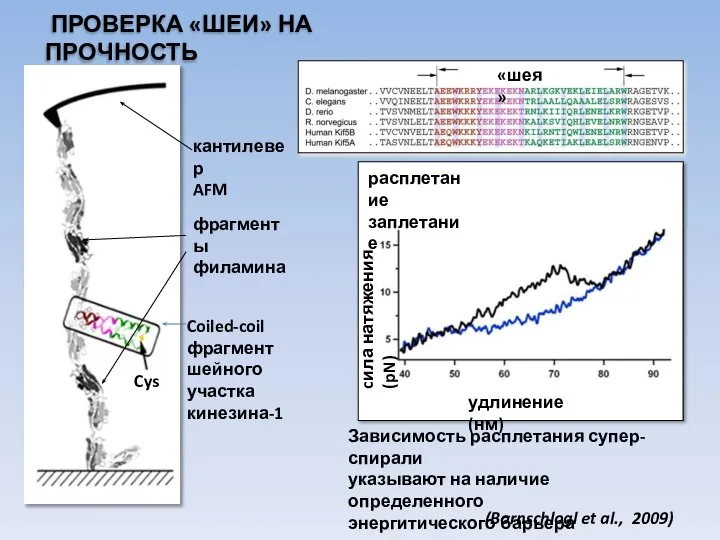
- 27. ПРОВЕРКА «ШЕИ» НА ПРОЧНОСТЬ Coiled-coil фрагмент шейного участка кинезина-1 кантилевер AFM фрагменты филамина Cys Зависимость расплетания
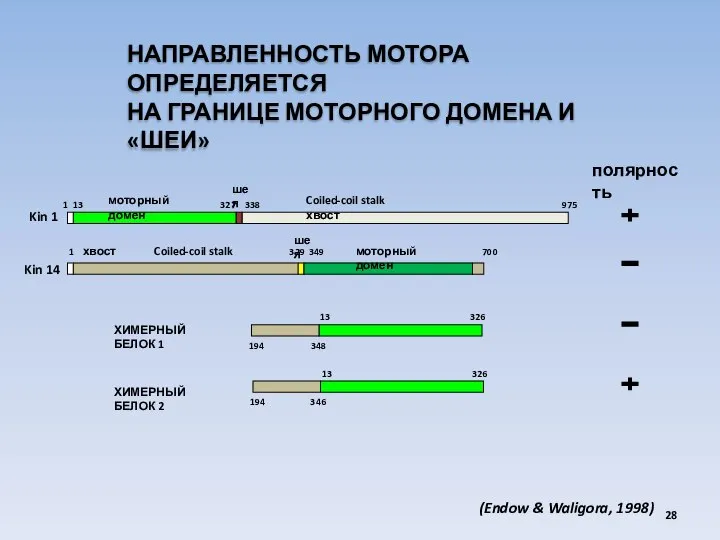
- 28. Kin 14 Kin 1 полярность 1 13 327 338 975 1 хвост Coiled-coil stalk 329 349
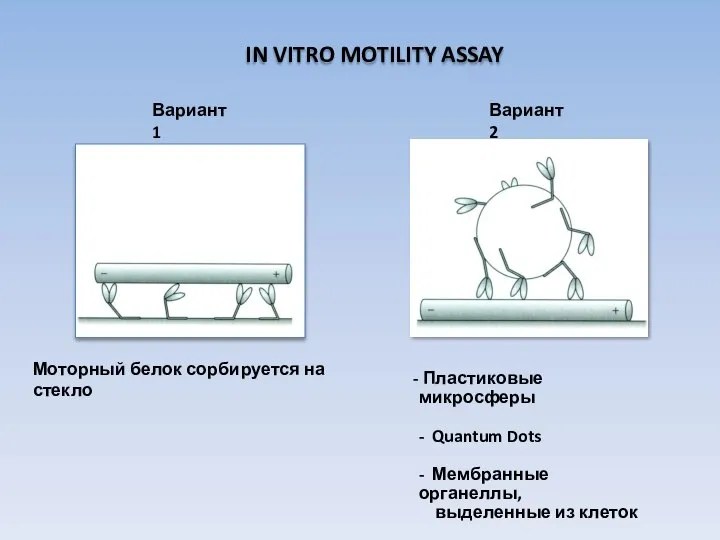
- 29. IN VITRO MOTILITY ASSAY Моторный белок сорбируется на стекло Пластиковые микросферы - Quantum Dots - Мембранные
- 30. ФЛУОРЕСЦИРУЮЩИЕ ФИЛАМЕНТЫ АКТИНА СКОЛЬЗЯТ ПО СТЕКЛУ, ПОКРЫТОМУ МИОЗИНОМ
- 31. дифференциальный интерференционный контраст
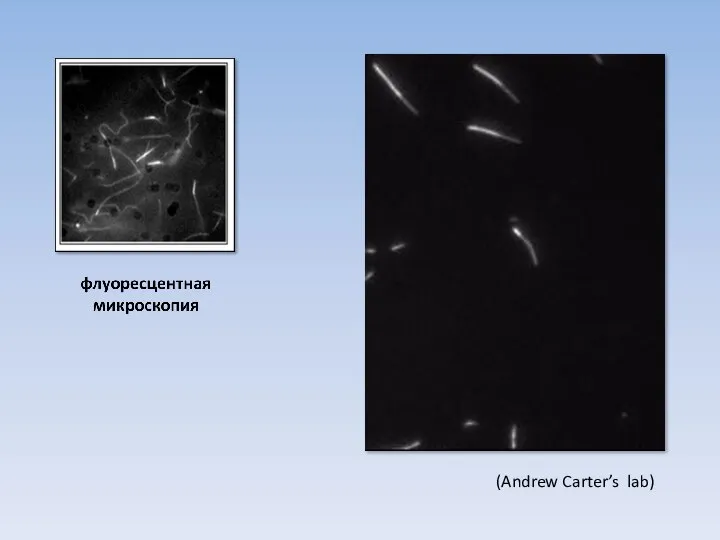
- 32. (Andrew Carter’s lab)
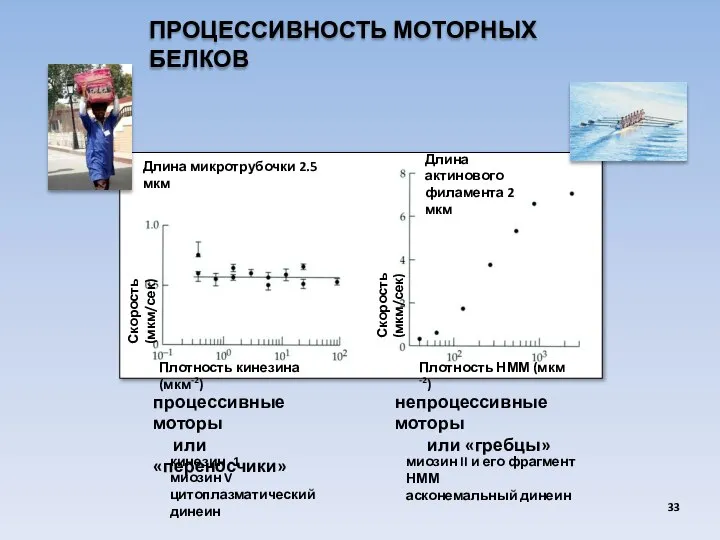
- 33. ПРОЦЕССИВНОСТЬ МОТОРНЫХ БЕЛКОВ Плотность кинезина (мкм-2) Плотность НММ (мкм -2) Скорость (мкм/сек) Скорость (мкм/сек) Длина микротрубочки
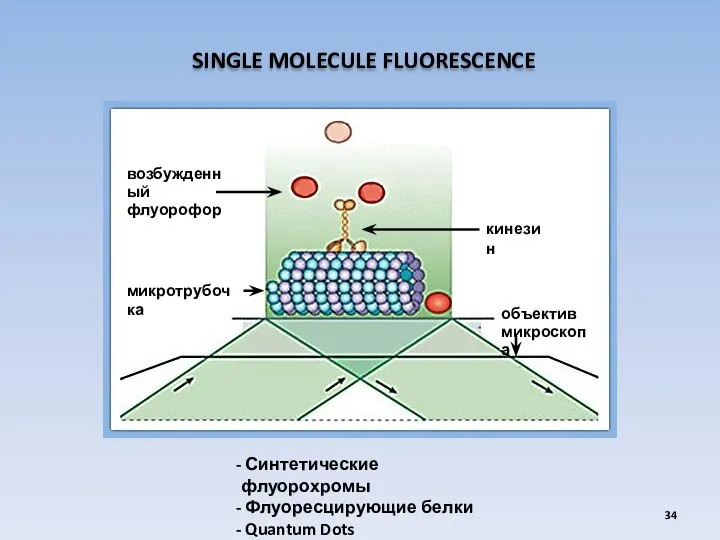
- 34. SINGLE MOLECULE FLUORESCENCE Синтетические флуорохромы Флуоресцирующие белки Quantum Dots микротрубочка объектив микроскопа кинезин возбужденный флуорофор
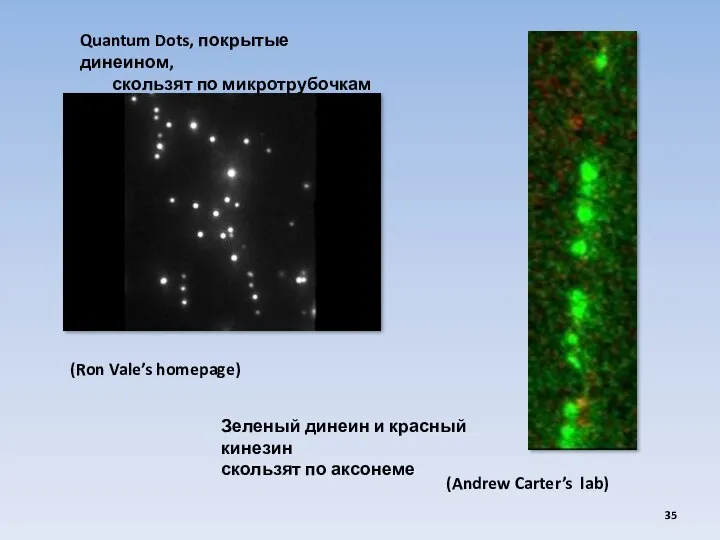
- 35. (Ron Vale’s homepage) Quantum Dots, покрытые динеином, скользят по микротрубочкам Зеленый динеин и красный кинезин скользят
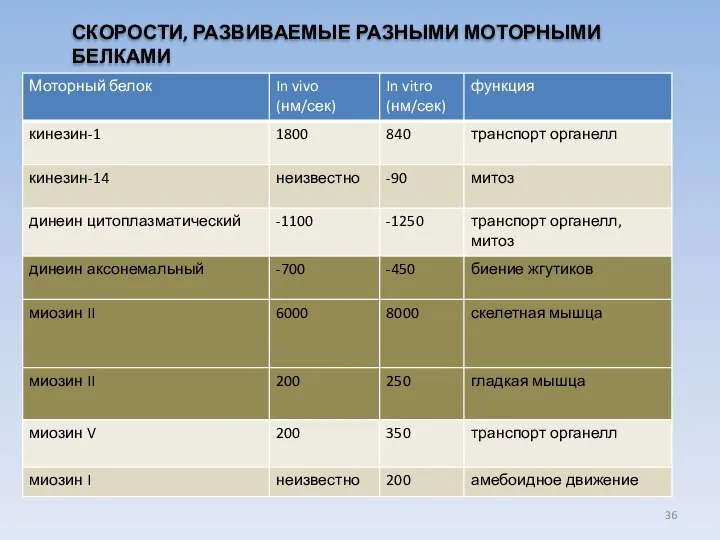
- 36. СКОРОСТИ, РАЗВИВАЕМЫЕ РАЗНЫМИ МОТОРНЫМИ БЕЛКАМИ
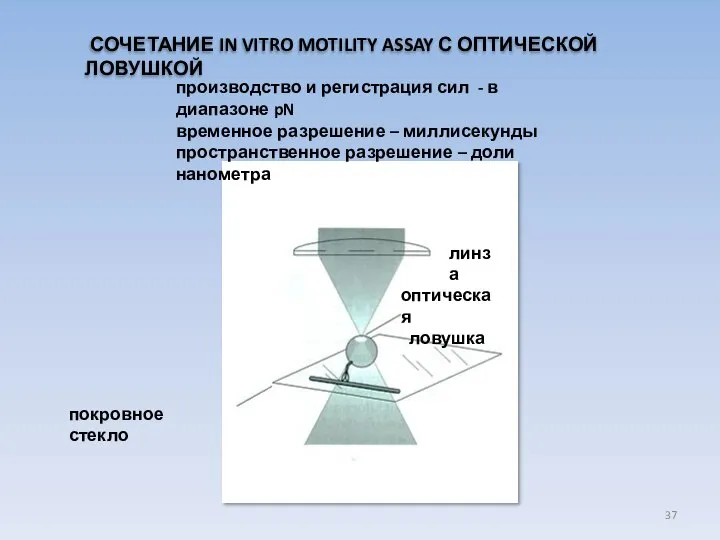
- 37. производство и регистрация сил - в диапазоне pN временное разрешение – миллисекунды пространственное разрешение – доли
- 38. КИНЕЗИН-1 НЕСЕТ МИКРОСФЕРУ ПО МИКРОТРУБОЧКЕ Свободное движение Движение в оптической ловушке (S. Block’s lab)
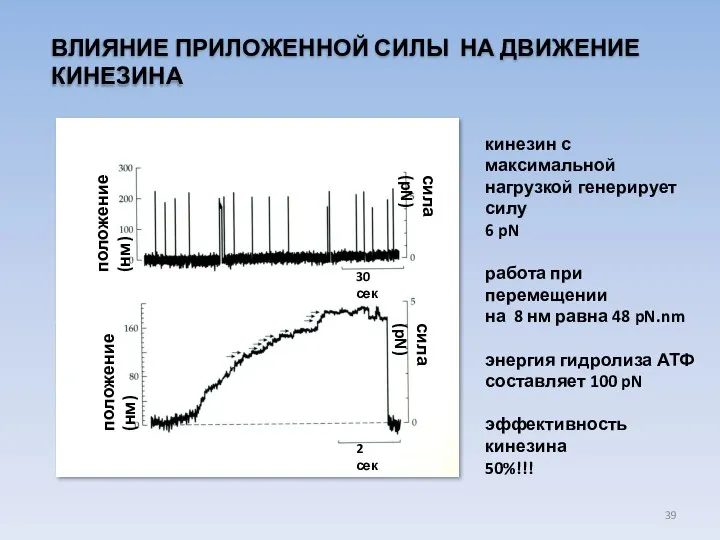
- 39. ВЛИЯНИЕ ПРИЛОЖЕННОЙ СИЛЫ НА ДВИЖЕНИЕ КИНЕЗИНА сила (pN) сила (pN) положение (нм) положение (нм) 30 сек
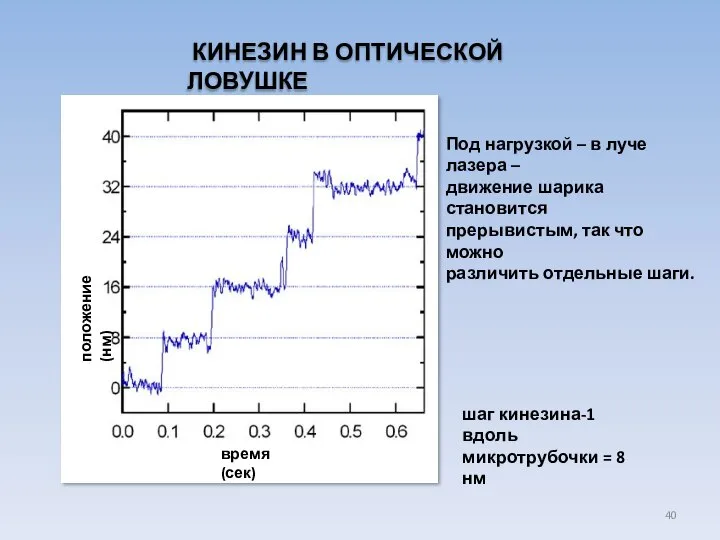
- 40. КИНЕЗИН В ОПТИЧЕСКОЙ ЛОВУШКЕ время (сек) положение (нм) шаг кинезина-1 вдоль микротрубочки = 8 нм Под
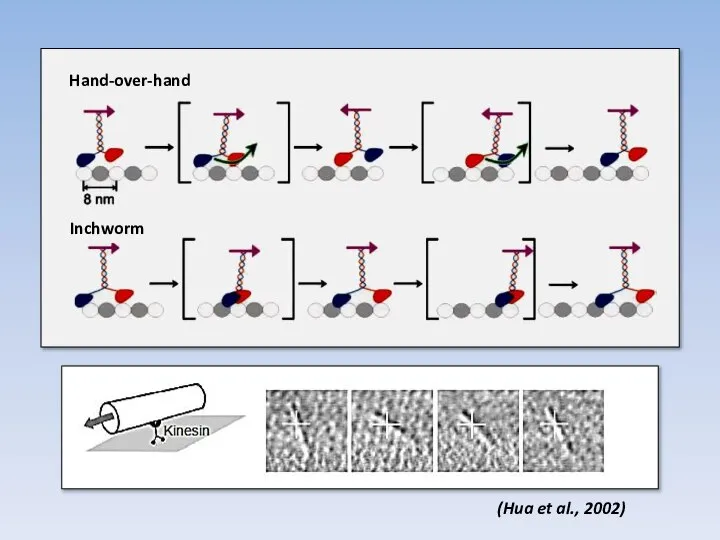
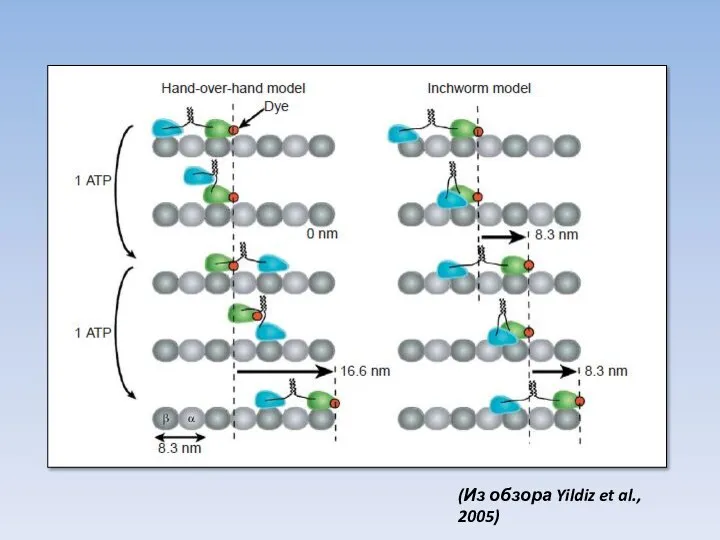
- 41. (Hua et al., 2002) Hand-over-hand Inchworm
- 42. (Из обзора Yildiz et al., 2005)
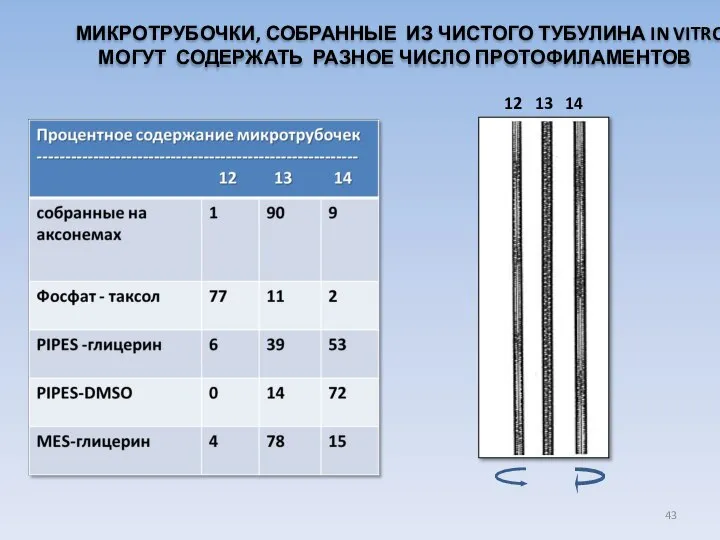
- 43. МИКРОТРУБОЧКИ, СОБРАННЫЕ ИЗ ЧИСТОГО ТУБУЛИНА IN VITRO, МОГУТ СОДЕРЖАТЬ РАЗНОЕ ЧИСЛО ПРОТОФИЛАМЕНТОВ 12 13 14
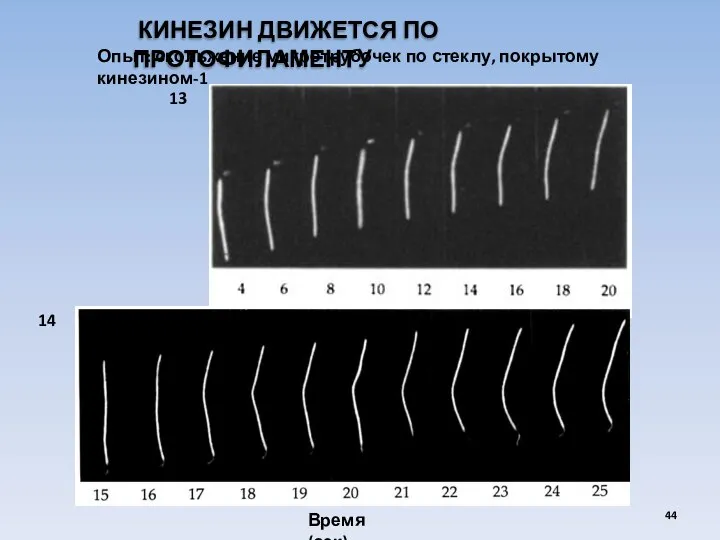
- 44. КИНЕЗИН ДВИЖЕТСЯ ПО ПРОТОФИЛАМЕНТУ Опыт: скольжение микротрубочек по стеклу, покрытому кинезином-1 Время (сек) 13 14
- 47. Скачать презентацию













 Представление
Представление Американская миниатюрная лошадь (AMHA)
Американская миниатюрная лошадь (AMHA) «Красота как биологическая целесообразность».
«Красота как биологическая целесообразность». Строение мышцы
Строение мышцы Будова системи кровообігу і лімфовідтоку
Будова системи кровообігу і лімфовідтоку Морфология системы пищеварения
Морфология системы пищеварения Эволюционный эффект
Эволюционный эффект Мозаичное зрение
Мозаичное зрение Нормальная Физиология для ММА. Физиология возбудимых тканей
Нормальная Физиология для ММА. Физиология возбудимых тканей Многообразие птиц Подготовила: учитель биологии Лужаина С.Л.
Многообразие птиц Подготовила: учитель биологии Лужаина С.Л. Сумчасті. 7 клас
Сумчасті. 7 клас Биологическая эволюция в развитии биосферы в архейcкую и протерозойскую эры
Биологическая эволюция в развитии биосферы в архейcкую и протерозойскую эры Сорные растения и их приспособления к окружающей среде
Сорные растения и их приспособления к окружающей среде Работа учеников 11 А класса Лалыко Екатерины Колесниковой Лизы
Работа учеников 11 А класса Лалыко Екатерины Колесниковой Лизы Полезные насекомые
Полезные насекомые Водоросли. Разнообразие организмов. Значение растений в природе
Водоросли. Разнообразие организмов. Значение растений в природе Нормальная микрофлора организма человека
Нормальная микрофлора организма человека Подготовила учащаяся 9«Б» класс Пишнеха Кристина
Подготовила учащаяся 9«Б» класс Пишнеха Кристина  Современные методы ДНК-диагностики наследственных болезней
Современные методы ДНК-диагностики наследственных болезней Отдел Псилотовые
Отдел Псилотовые Презентация к уроку окружающего мира 4 класс Как устроен организм человека
Презентация к уроку окружающего мира 4 класс Как устроен организм человека  Опорно-двигательная система
Опорно-двигательная система Экосистема болота
Экосистема болота  Голосеменные
Голосеменные  Общая ЦНС
Общая ЦНС Кровь и кровообращение
Кровь и кровообращение Презентация по биологии Вирусные заболевания растений
Презентация по биологии Вирусные заболевания растений  Презентация на тему "Развитие жизни на земле в мезозойскую эру" - скачать презентации по Биологии
Презентация на тему "Развитие жизни на земле в мезозойскую эру" - скачать презентации по Биологии