Содержание
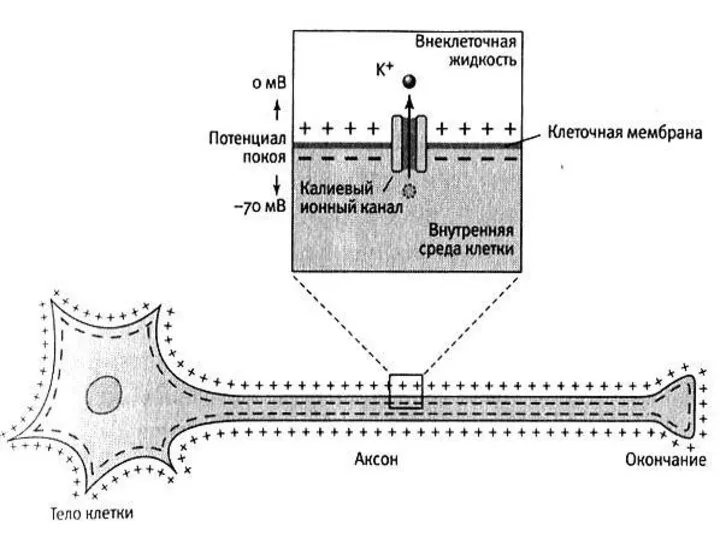
- 3. ВОЗНИКНОВЕНИЕ ПОТЕНЦИАЛА ПОКОЯ Возникает вследствие диффузии положительно заряженных ионов калия в окружающую среду из цитоплазмы клетки
- 5. ГИПОТЕЗА БЕРНШТЕЙНА В 1902 году юлиус Бернштейн выдвинул гипотезу, согласно которой клеточная мембрана пропускает внутрь клетки
- 7. УРАВНЕНИЕ НЕРНСТА Уравнение нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое
- 9. Скачать презентацию
Слайд 2
Слайд 3
ВОЗНИКНОВЕНИЕ ПОТЕНЦИАЛА ПОКОЯ
Возникает вследствие диффузии положительно заряженных ионов калия в окружающую
ВОЗНИКНОВЕНИЕ ПОТЕНЦИАЛА ПОКОЯ Возникает вследствие диффузии положительно заряженных ионов калия в окружающую
среду из цитоплазмы клетки в процессе установления осмотического равновесия. Анионы органических кислот, нейтрализующие заряд ионов калия в цитоплазме, не могут выйти из клетки, однако ионы калия, концентрация которых в цитоплазме велика по сравнению с окружающей средой, диффундируют из цитоплазмы до тех пор, пока создаваемый ими электрический заряд не начнёт уравновешивать их градиент концентрации на клеточной мембране.
Слайд 4
Слайд 5
ГИПОТЕЗА БЕРНШТЕЙНА
В 1902 году юлиус Бернштейн выдвинул гипотезу, согласно которой клеточная
ГИПОТЕЗА БЕРНШТЕЙНА В 1902 году юлиус Бернштейн выдвинул гипотезу, согласно которой клеточная
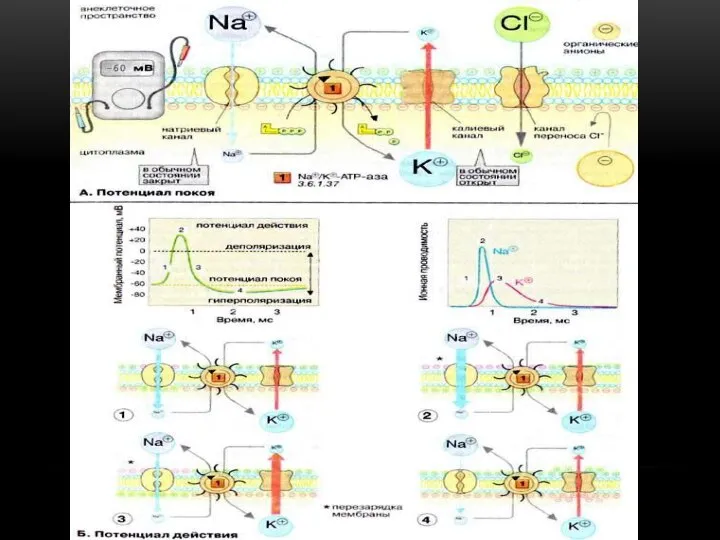
мембрана пропускает внутрь клетки ионы К+, и они накапливаются в цитоплазме. Расчет величины потенциала покоя по уравнению нернста для калиевого электрода удовлетворительно совпал с измеренным потенциалом между саркоплазмой мышцы и окружающей средой, который составлял около — 70 мв.
Согласно теории Ю. Бернштейна, при возбуждении клетки её мембрана повреждается, и ионы К+ вытекают из клетки по концентрационному градиенту до тех пор, пока потенциал мембраны не становится равным нулю. Затем мембрана восстанавливает свою целостность, и потенциал возвращается к уровню потенциала покоя.
Слайд 6
Слайд 7
УРАВНЕНИЕ НЕРНСТА
Уравнение нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями
УРАВНЕНИЕ НЕРНСТА
Уравнение нернста — уравнение, связывающее окислительно-восстановительный потенциал системы с активностями
веществ, входящих в электрохимическое уравнение, и стандартными электродными потенциалами окислительно-восстановительных пар.
Где — E электродный потенциал,
— E0 стандартный электродный потенциал, измеряется в вольтах;
— R универсальная газовая постоянная, равная 8.31 дж/(моль·k);
— T абсолютная температура; — F постоянная фарадея, равная 96485,35 кл·моль−1; — n число электронов, участвующих в процессе; — αox и αRed активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
Где — E электродный потенциал,
— E0 стандартный электродный потенциал, измеряется в вольтах;
— R универсальная газовая постоянная, равная 8.31 дж/(моль·k);
— T абсолютная температура; — F постоянная фарадея, равная 96485,35 кл·моль−1; — n число электронов, участвующих в процессе; — αox и αRed активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.
- Предыдущая
Русская детская литература. Серебряный векСледующая -
Пожарная безопасность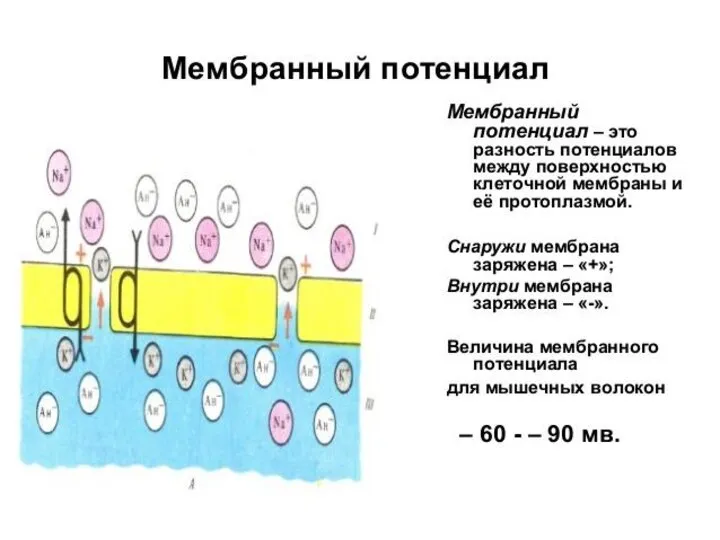



 Обмен углеводов
Обмен углеводов Паспорт комнатных растений
Паспорт комнатных растений ЛЕКАРСТВЕННЫЕ РАСТЕНИЯ викторина
ЛЕКАРСТВЕННЫЕ РАСТЕНИЯ викторина Животные в скульптуре. Звери и птицы
Животные в скульптуре. Звери и птицы Тема урока: внешнее строение листа. Вы узнаете: Какое строение имеет лист. Как могут располагаться листья на побеге.
Тема урока: внешнее строение листа. Вы узнаете: Какое строение имеет лист. Как могут располагаться листья на побеге. Конечный мозг
Конечный мозг Внешнее строение и разнообразие листьев
Внешнее строение и разнообразие листьев Презентация на тему "Тип членистоногие. Класс ракообразные." - скачать презентации по Биологии
Презентация на тему "Тип членистоногие. Класс ракообразные." - скачать презентации по Биологии Факторы эволюции
Факторы эволюции Прокариоты. Строение и функции немембранных и двумембранных органоидов
Прокариоты. Строение и функции немембранных и двумембранных органоидов Причины сокращения численности лошадей и проблемы их содержания в домашних условия
Причины сокращения численности лошадей и проблемы их содержания в домашних условия Капустница - красивая светлая бабочка
Капустница - красивая светлая бабочка демонстрационная лабораторная работа по теме «Строение клетки» (6 класс)
демонстрационная лабораторная работа по теме «Строение клетки» (6 класс)  Организация и функционирование генома человека
Организация и функционирование генома человека Выполнила: Хохлова А. Руководитель: Лопатина Т.П.
Выполнила: Хохлова А. Руководитель: Лопатина Т.П. Деление клетки. Митоз
Деление клетки. Митоз Тип Плоские черви (Plathelminthes) Задачи: Изучить характеристику типа, биологические особенности представителей ресничных червей, с
Тип Плоские черви (Plathelminthes) Задачи: Изучить характеристику типа, биологические особенности представителей ресничных червей, с Hayvanlar
Hayvanlar Луговое разнотравье Нижегородской области. Викторина
Луговое разнотравье Нижегородской области. Викторина Получение белка в биотехнологическом производстве
Получение белка в биотехнологическом производстве Функции и общая характеристика строения биомембран. Виды мембранного танспорта
Функции и общая характеристика строения биомембран. Виды мембранного танспорта ОСНОВНЫЕ ЭТАПЫ АНТРОПОГЕНЕЗА МБОУ «ФИЗИКО-МАТЕМАТИЧЕСКИЙ ЛИЦЕЙ» СЕРГИЕВ ПОСАД Учитель химии-биологии Перепелкин О.В.
ОСНОВНЫЕ ЭТАПЫ АНТРОПОГЕНЕЗА МБОУ «ФИЗИКО-МАТЕМАТИЧЕСКИЙ ЛИЦЕЙ» СЕРГИЕВ ПОСАД Учитель химии-биологии Перепелкин О.В. Белые медведи Составила: Желнина Валентина Ученица 7 «А» класса МОУ СОШ № 10 «УСПЕХ» г. Самара, 2006 г
Белые медведи Составила: Желнина Валентина Ученица 7 «А» класса МОУ СОШ № 10 «УСПЕХ» г. Самара, 2006 г  Выращивание улиток архахатин в домашних условиях
Выращивание улиток архахатин в домашних условиях Физиологические основы голода и насщыения. Регуляция аппетита
Физиологические основы голода и насщыения. Регуляция аппетита Тип Иглокожие
Тип Иглокожие Перевозка животных
Перевозка животных Вид. Критерии вида
Вид. Критерии вида