Содержание
- 2. H Cl = H+ + Cl – H2 SO 4 = 2 H+ + SO42- Кислоты
- 3. Состав кислот H Cl H2SO4 H3PO4 1. Кислоты – это простые или сложные вещества? 2. Что
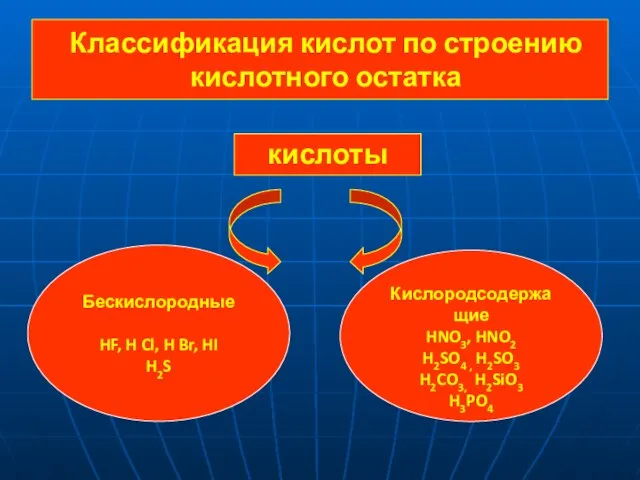
- 4. Классификация кислот по строению кислотного остатка кислоты Бескислородные HF, H Cl, H Br, HI H2S Кислородсодержащие
- 5. Нахождение кислот в природе Лимонная кислота содержится в лимонах, яблочная кислота - в яблоках, щавелевая кислота
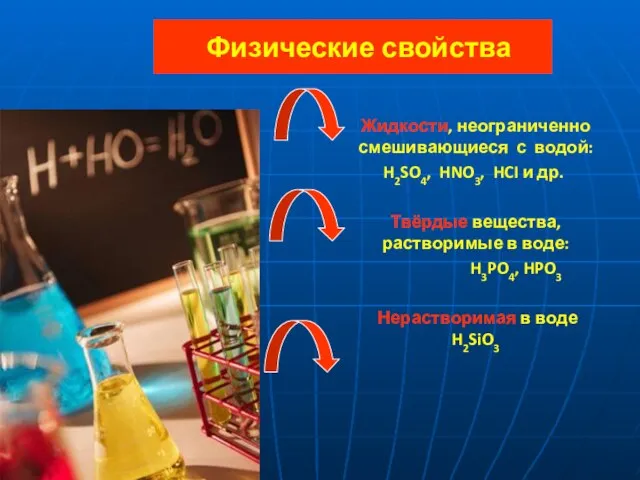
- 6. Физические свойства Жидкости, неограниченно смешивающиеся с водой: H2SO4, HNO3, HCI и др. Твёрдые вещества, растворимые в
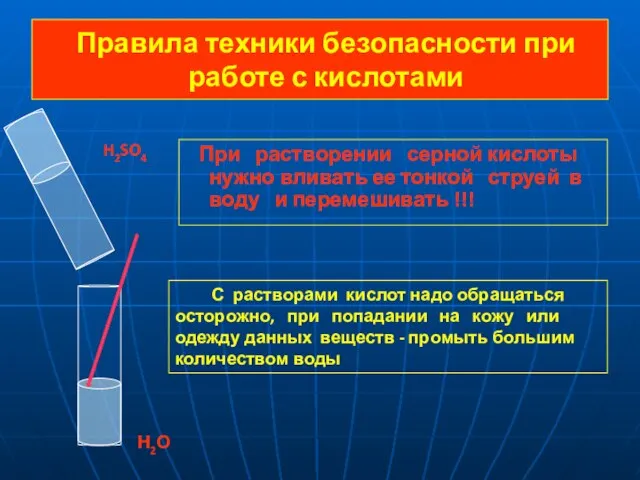
- 7. Правила техники безопасности при работе с кислотами При растворении серной кислоты нужно вливать ее тонкой струей
- 8. Действие кислот на растворы индикаторов фиолетовый красный оранжевый розовый лакмус метилоранж обусловлено наличием в них ионов
- 9. Взаимодействие кислот с металлами Zn + 2 HCI = ZnCI2 + H2 + Q Zn +2H+
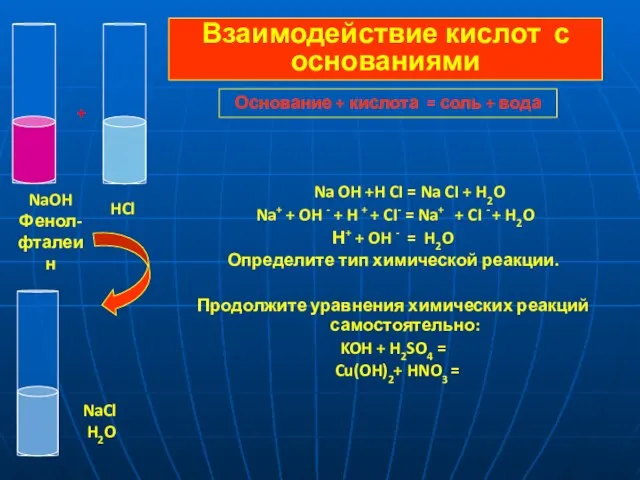
- 10. Na OH +H CI = Na CI + H2O Na+ + OH - + H +
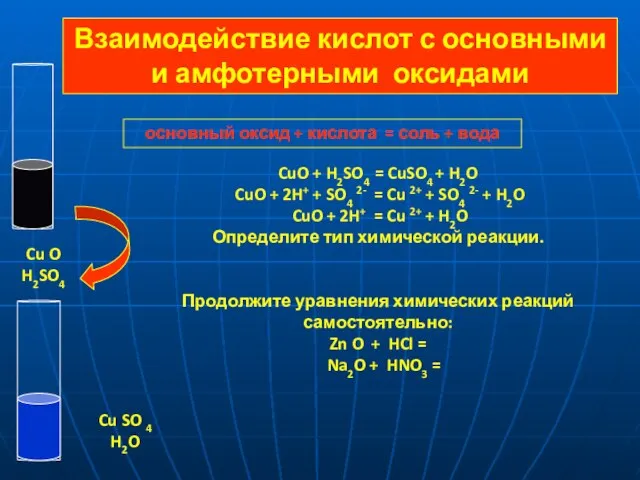
- 11. основный оксид + кислота = соль + вода CuO + H2SO4 = CuSO4 + H2O CuO
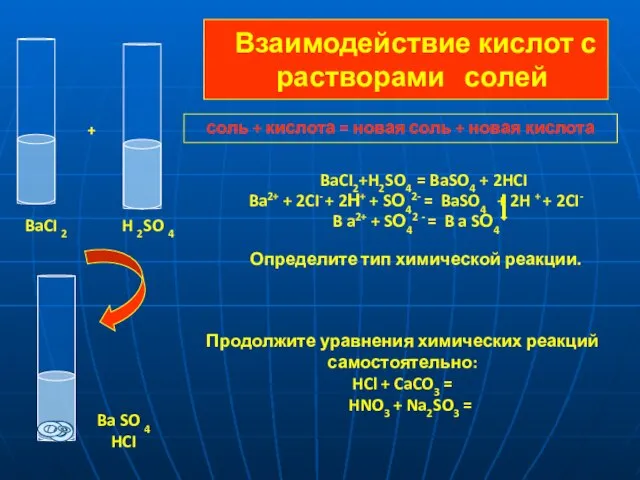
- 12. Взаимодействие кислот с растворами солей BaCI2+H2SO4 = BaSO4 + 2HCI Ba2+ + 2CI- + 2Н+ +
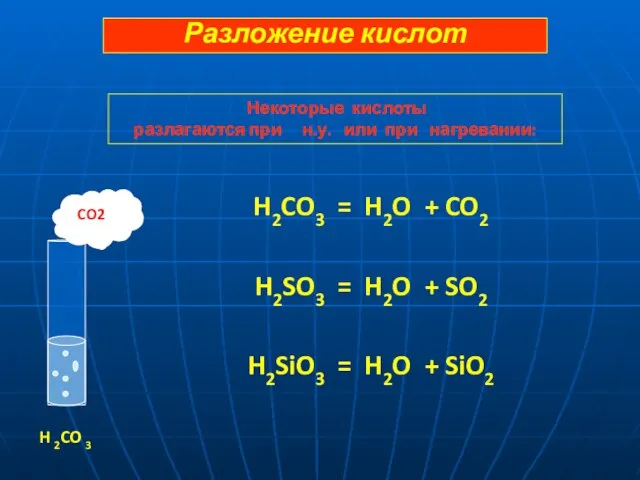
- 13. H2CO3 = H2O + CO2 H2SO3 = H2O + SO2 H2SiO3 = H2O + SiO2 CO2
- 14. Способы получения кислот 1. Взаимодействие кислотных оксидов с водой: P2O5+ 3H2O = 2H3PO4 SO3 + H2O
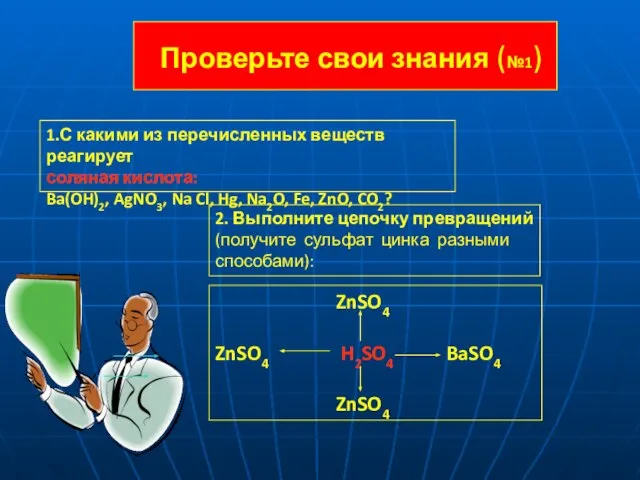
- 15. Проверьте свои знания (№1) 1.С какими из перечисленных веществ реагирует соляная кислота: Ba(OH)2, AgNO3, Na Cl,
- 17. Скачать презентацию






 Влияние минерального питания на рост и развитие растений Авторы: Дюрягина Е.Е., Плетнёва П.В.
Влияние минерального питания на рост и развитие растений Авторы: Дюрягина Е.Е., Плетнёва П.В. Насекомые рекордсмены
Насекомые рекордсмены Презентация на тему Экосистема озера
Презентация на тему Экосистема озера  Презентация на тему "Влияние внешних условий на рост и развитие плесневых грибов" - скачать презентации по Биологии
Презентация на тему "Влияние внешних условий на рост и развитие плесневых грибов" - скачать презентации по Биологии Пингвины
Пингвины Регуляция пищеварения. Гигиена органов пищеварения
Регуляция пищеварения. Гигиена органов пищеварения Гербарий моего двора
Гербарий моего двора Семейство медвежьи
Семейство медвежьи Земноводные - презентации по Биологии
Земноводные - презентации по Биологии Блохи (Siphonapterа)
Блохи (Siphonapterа) Исследование различных по качественному составу соков с целью более эффективного использования их для укрепления здоровья
Исследование различных по качественному составу соков с целью более эффективного использования их для укрепления здоровья Презентация на тему Живой организм и его свойства Какими свойствами обладают живые организмы?
Презентация на тему Живой организм и его свойства Какими свойствами обладают живые организмы? Лишайники
Лишайники Способи розмноження рослин Презентацію підготувала учениця 11 класу Циганок Наталія
Способи розмноження рослин Презентацію підготувала учениця 11 класу Циганок Наталія  Возникновение жизни на земле
Возникновение жизни на земле Подтип Хелицеровые (Chelicerata). Класс Паукообразные (Arachnida). Особенности организации
Подтип Хелицеровые (Chelicerata). Класс Паукообразные (Arachnida). Особенности организации Осеннее явление в лесной экосистеме Кодры
Осеннее явление в лесной экосистеме Кодры Строение ногтя
Строение ногтя Насекомые
Насекомые Фотосинтез. Понятие фотосинтеза
Фотосинтез. Понятие фотосинтеза Презентация на тему "Головной мозг, его строение и функции" - скачать презентации по Биологии
Презентация на тему "Головной мозг, его строение и функции" - скачать презентации по Биологии Вплив алкоголю на організм людини Робота учениці 6-го класу Михайлівської ЗОШ І-ІІст Дзензюр Ангеліни
Вплив алкоголю на організм людини Робота учениці 6-го класу Михайлівської ЗОШ І-ІІст Дзензюр Ангеліни  Половой отбор? Павлины против!
Половой отбор? Павлины против! ДИНОЗАВР
ДИНОЗАВР Русская выхухоль имеет право на жизнь
Русская выхухоль имеет право на жизнь Хвойные
Хвойные Царство Растения. Кружок Горизонты биологии: система живых организмов
Царство Растения. Кружок Горизонты биологии: система живых организмов Межклеточные контакты
Межклеточные контакты