Содержание
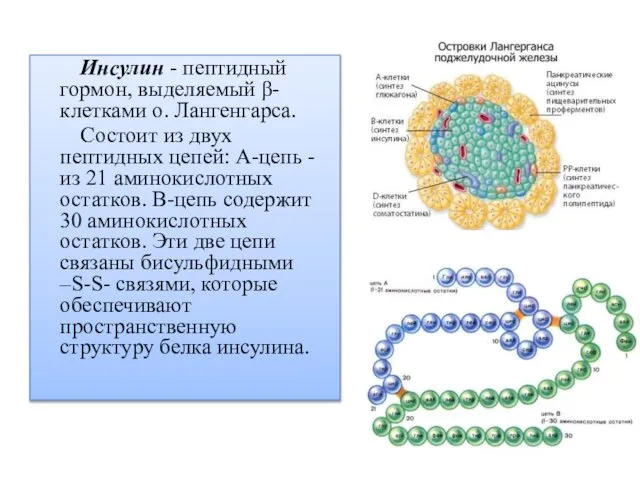
- 2. Инсулин - пептидный гормон, выделяемый β-клетками о. Лангенгарса. Состоит из двух пептидных цепей: А-цепь - из
- 4. История открытия инсулина связана с именем русского врача И.М. Соболева (вторая половина 19 века), доказавшего, что
- 5. В 1935 году датский исследователь Хагедорн оптимизировал действие инсулина в организме, предложив пролонгированный препарат. Первые кристаллы
- 6. Инсулин был открыт Фредериком Бантингом и Чарльзом Бестом, работавшими в лаборатории Дж. Маклеода в Торонто в
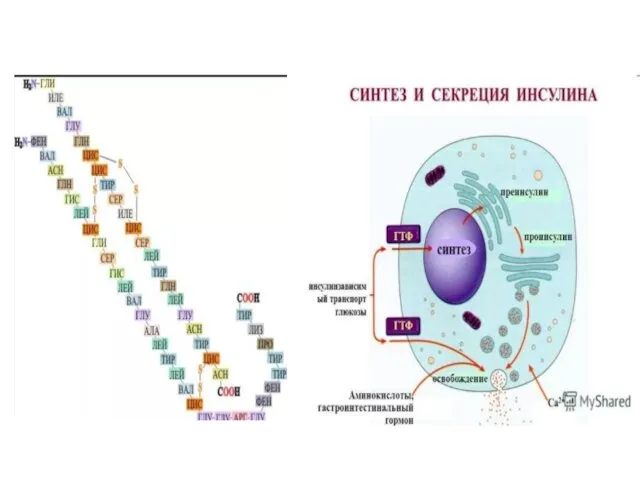
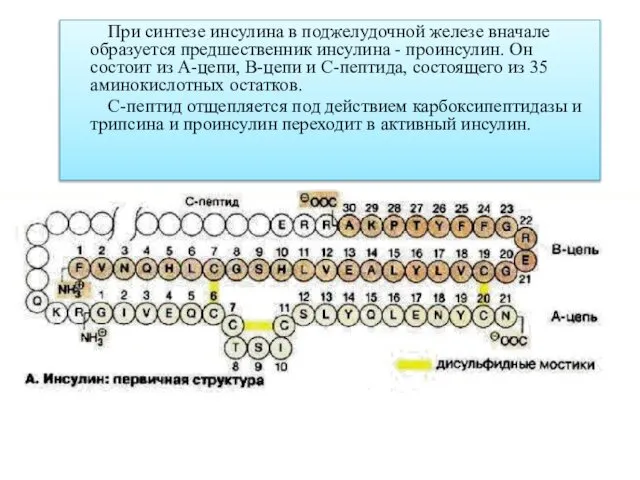
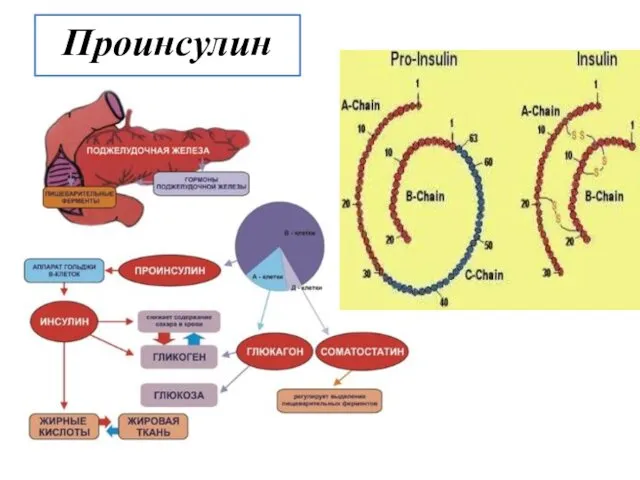
- 8. При синтезе инсулина в поджелудочной железе вначале образуется предшественник инсулина - проинсулин. Он состоит из А-цепи,
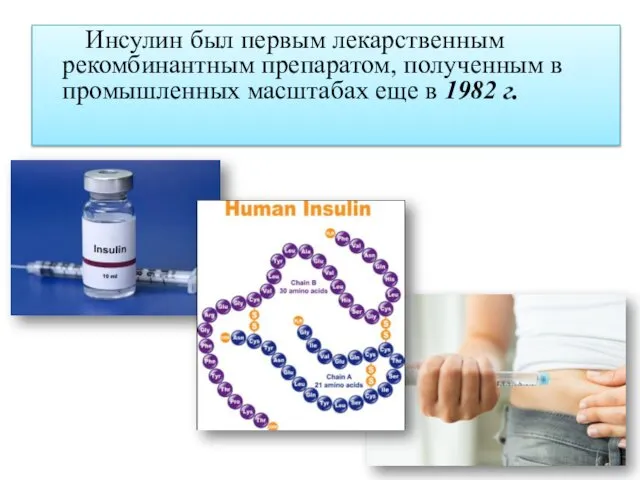
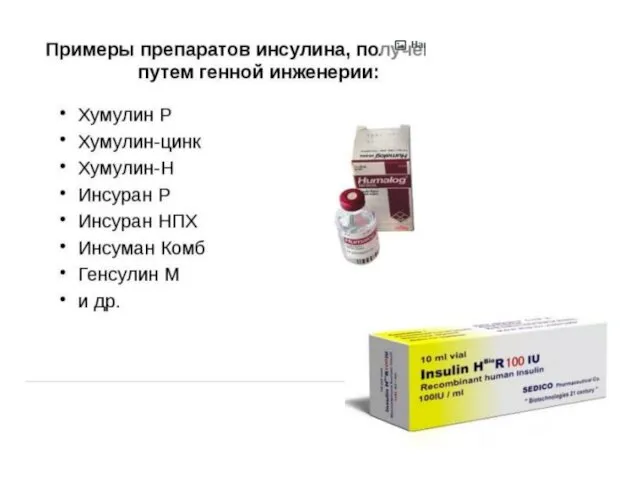
- 9. Инсулин был первым лекарственным рекомбинантным препаратом, полученным в промышленных масштабах еще в 1982 г.
- 10. До получения рекомбинантного инсулина препарат получали из поджелудочной железы свиней и крупного рогатого скота. Однако такой
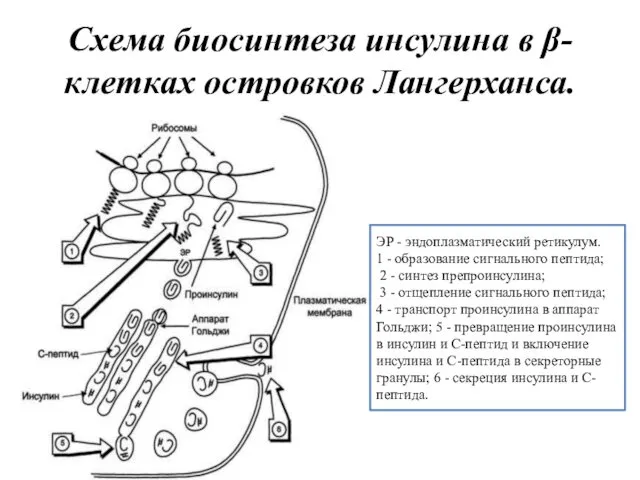
- 11. Схема биосинтеза инсулина в β-клетках островков Лангерханса. ЭР - эндоплазматический ретикулум. 1 - образование сигнального пептида;
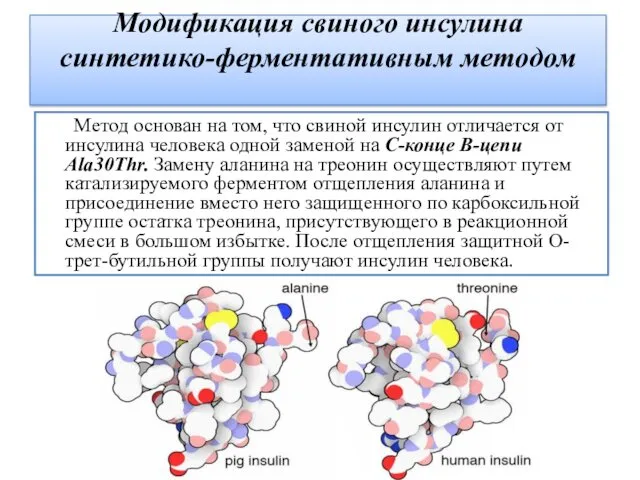
- 12. Модификация свиного инсулина синтетико-ферментативным методом Метод основан на том, что свиной инсулин отличается от инсулина человека
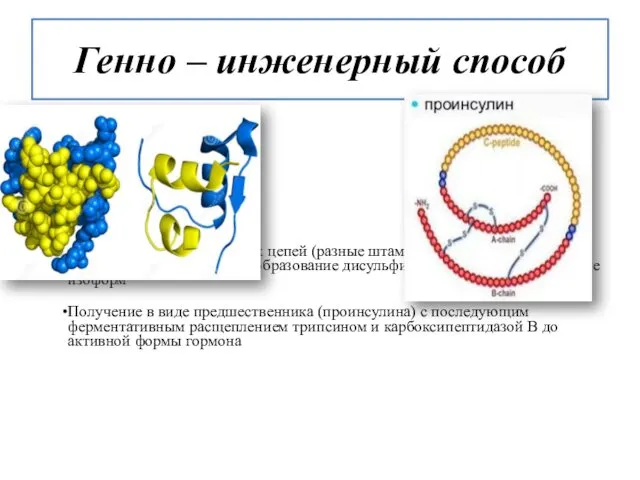
- 13. Генно – инженерный способ 2 пути: Раздельное получение обеих цепей (разные штаммы - продуценты) с последующим
- 14. Проинсулин
- 15. Химический синтез 1. Путем химического синтеза создаются последовательности нуклеотидов, которые кодируют образование А и В цепей
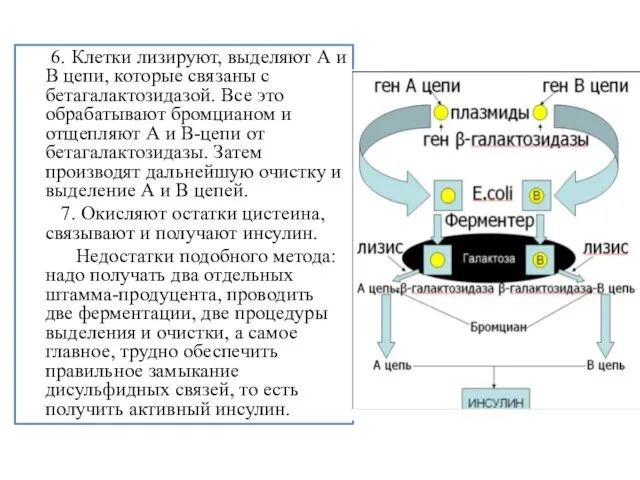
- 16. 6. Клетки лизируют, выделяют А и В цепи, которые связаны с бетагалактозидазой. Все это обрабатывают бромцианом
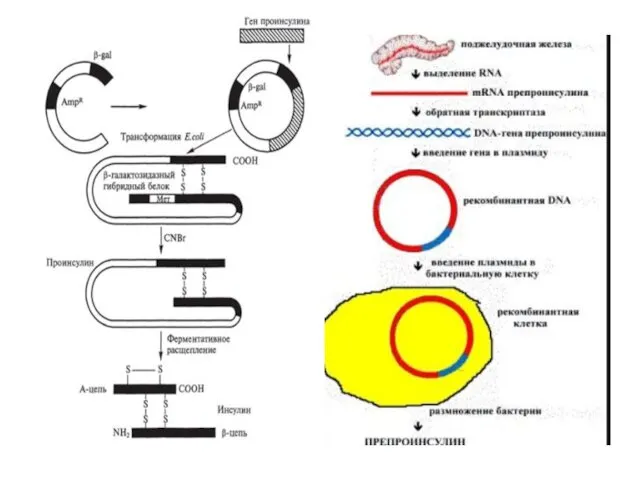
- 18. В 1975 г. У.Гилберт предложил следующую схему синтеза инсулина: Из опухолевых клеток поджелудочный железы выделяется мРНК
- 20. Следующий этап – включение гена предшественника инсулина (или генов цепей порознь) в геном E.coli – особого
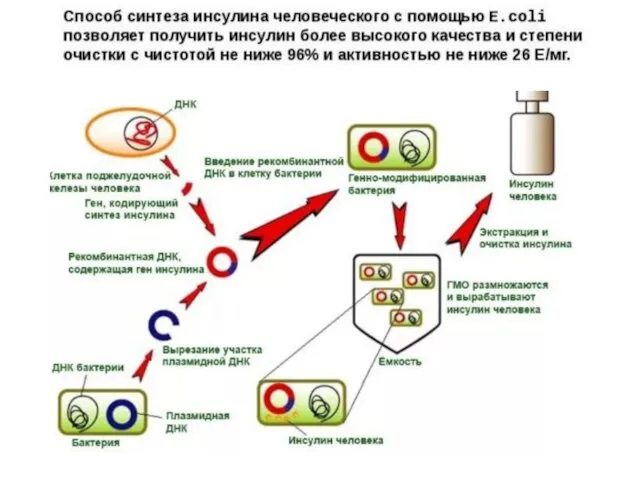
- 21. В институте биоорганической химии РАН получен рекомбинантный инсулин (инсуран) с использованием генно-инженерных штаммов E.coli. Из выращенной
- 22. Получение рекомбинантного инсулина Культивирование штамма продуцента E.coli JM109/pPINS07 осуществляют в промышленном ферментере объемом 200-1500 л. Концентрацию
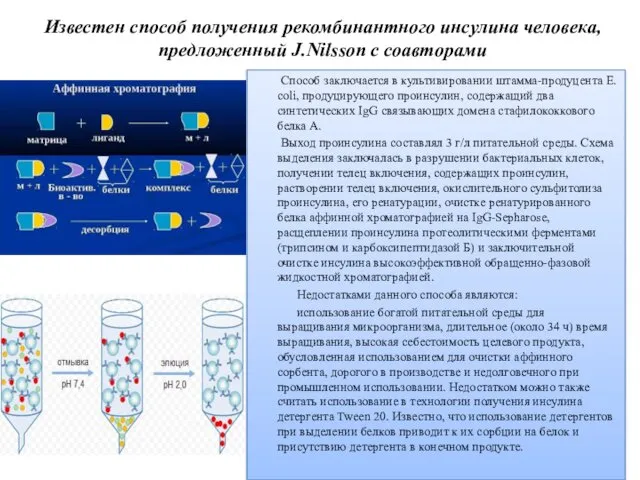
- 23. Известен способ получения рекомбинантного инсулина человека, предложенный J.Nilsson с соавторами Способ заключается в культивировании штамма-продуцента Е.
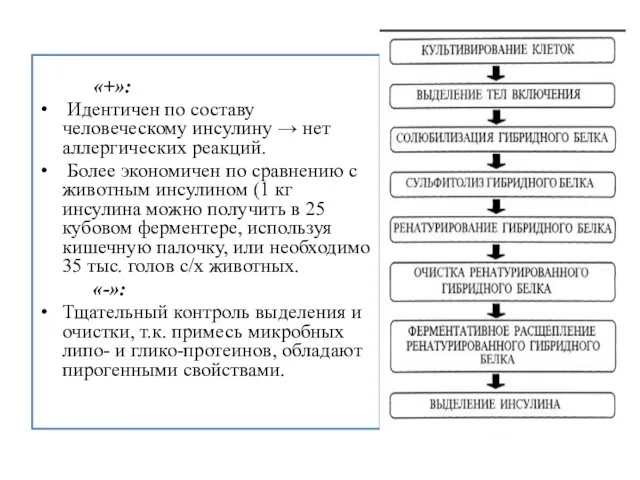
- 24. «+»: Идентичен по составу человеческому инсулину → нет аллергических реакций. Более экономичен по сравнению с животным
- 27. Скачать презентацию










 Функциональное значение желез внутренней секреции
Функциональное значение желез внутренней секреции Особенности роста и развития растений
Особенности роста и развития растений Презентация на тему "Голосеменные" - скачать презентации по Биологии
Презентация на тему "Голосеменные" - скачать презентации по Биологии Кормление косули в естественных условиях и в условиях зоопарка
Кормление косули в естественных условиях и в условиях зоопарка Передача информации в живой природе
Передача информации в живой природе Презентация на тему ЦВЕТОК .
Презентация на тему ЦВЕТОК .  Сравнительная характеристика гончих в СССР и в настоящее время
Сравнительная характеристика гончих в СССР и в настоящее время Лекарственные растения Донбасса
Лекарственные растения Донбасса Типы листа по форме его верхушки
Типы листа по форме его верхушки Биосфера— оболочка Земли
Биосфера— оболочка Земли Влияние минеральной воды на рост и развитие корней и листьев лука
Влияние минеральной воды на рост и развитие корней и листьев лука Ливенская порода свиней
Ливенская порода свиней Надкласс Рыбы
Надкласс Рыбы Презентация на тему "Клонирование человека" - скачать презентации по Биологии
Презентация на тему "Клонирование человека" - скачать презентации по Биологии Факультет биотехнологии и биологии 2022
Факультет биотехнологии и биологии 2022 Презентация Слуховой анализатор. Гигиена слуха
Презентация Слуховой анализатор. Гигиена слуха Профессия кинолог
Профессия кинолог Хромосомные синдромы, выявляемые в первые годы жизни ребенка. Психические отклонения при хромосомных болезнях
Хромосомные синдромы, выявляемые в первые годы жизни ребенка. Психические отклонения при хромосомных болезнях Филогенез скелета позвоночных животных
Филогенез скелета позвоночных животных Кожа, строение и функции
Кожа, строение и функции Теории происхождения жизни
Теории происхождения жизни Конвертируемые формы энергии
Конвертируемые формы энергии ВЕНЕРОЛОГИЯ История развития (2011 г.)
ВЕНЕРОЛОГИЯ История развития (2011 г.)  Презентация на тему МАТЬ-И-МАЧЕХА
Презентация на тему МАТЬ-И-МАЧЕХА  Звери и птицы весной
Звери и птицы весной Пищеварительная система
Пищеварительная система Круговорот веществ в биосфере
Круговорот веществ в биосфере Нервная система человека. 4 класс
Нервная система человека. 4 класс