Значение биохимии в фармацевтической практике. Принципы структурной и функциональной организации белков. Ферменты
Содержание
- 2. Что является предметом биохимии? Молекулярный уровень процессов рождения, развития и функционирования живых организмов. Биохимия изучает структуру
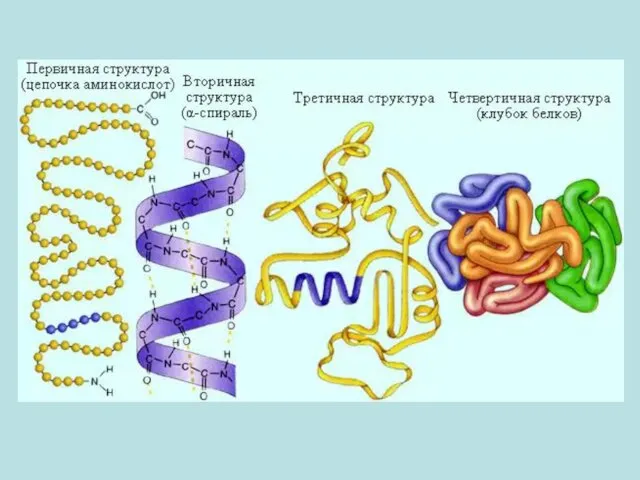
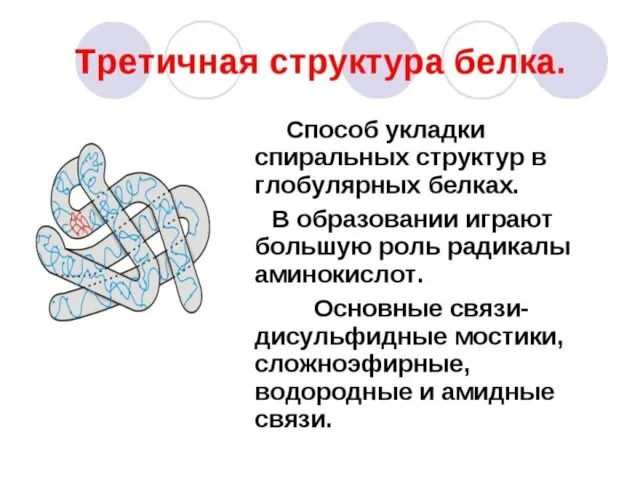
- 3. 1.Статическая биохимия изучает химический состав живых организмов и структуру биомолекул (белков, аминокислот,нуклеиновых кислот, нуклеотидов, углеводов, липидов,
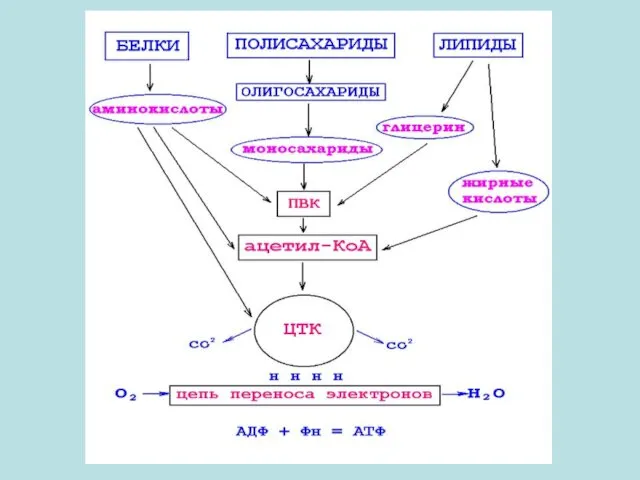
- 5. Обмен веществ невозможен без резкого ускорения реакций, на которых он основан, без согласования во времени и
- 6. Энзимология – это наука, которая изучает структуру, свойства и механизм действия ферментов. Ферменты – это биологические
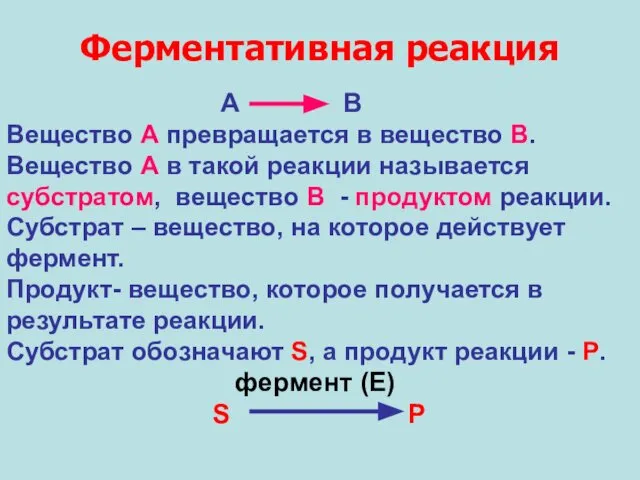
- 10. Ферментативная реакция А В Вещество А превращается в вещество В. Вещество А в такой реакции называется
- 11. Ферментативная реакция протекает внутри специальной полости в ферменте. Эта полость – главный функциональный участок фермента -активный
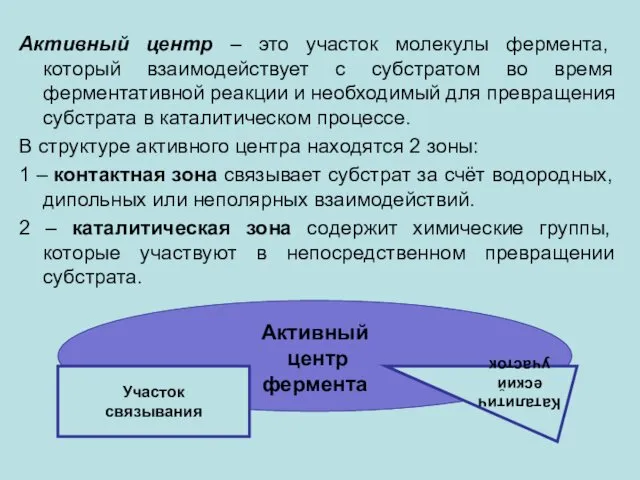
- 12. Активный центр – это участок молекулы фермента, который взаимодействует с субстратом во время ферментативной реакции и
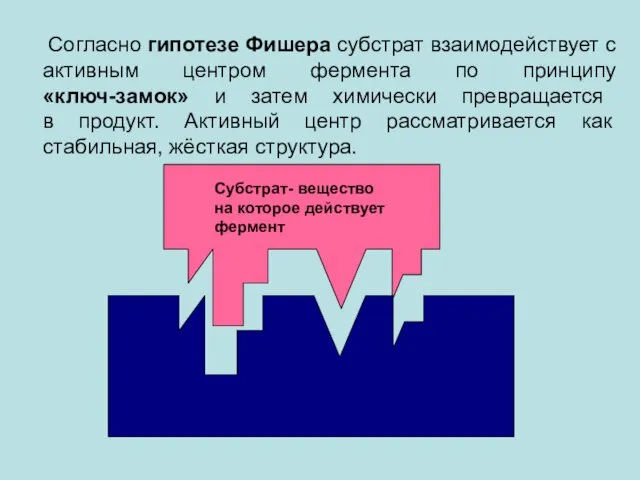
- 13. Согласно гипотезе Фишера субстрат взаимодействует с активным центром фермента по принципу «ключ-замок» и затем химически превращается
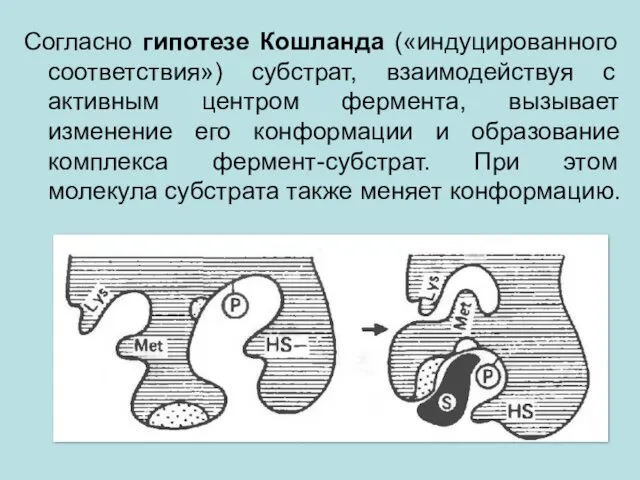
- 14. Согласно гипотезе Кошланда («индуцированного соответствия») субстрат, взаимодействуя с активным центром фермента, вызывает изменение его конформации и
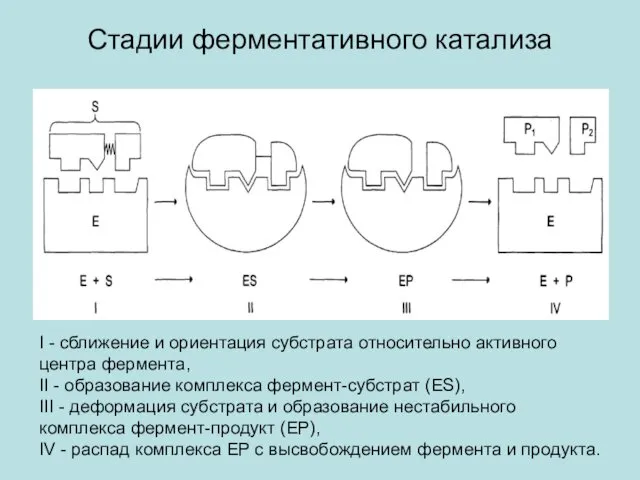
- 15. Стадии ферментативного катализа I - сближение и ориентация субстрата относительно активного центра фермента, II - образование
- 16. Ферменты ускоряют реакцию за счет понижения энергии активации субстрата 1.Для взаимодействия молекул нужна энергия. Молекулы взаимодействуют
- 17. Ферменты имеют свойства, характерные только для биологических катализаторов: 1.Высокую эффективность действия. Ускоряют реакции в тысячи и
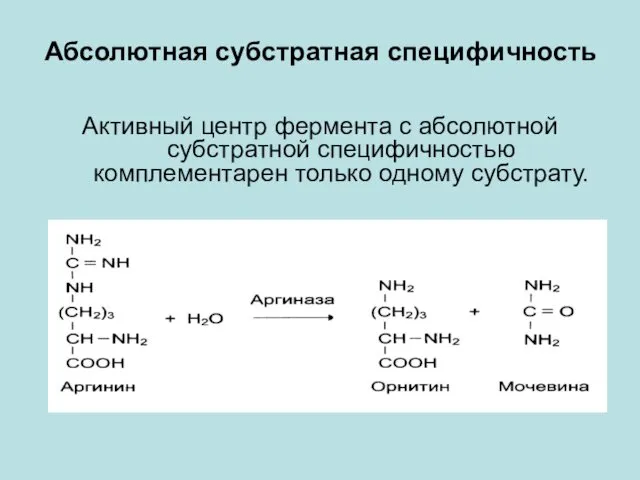
- 18. Абсолютная субстратная специфичность Активный центр фермента с абсолютной субстратной специфичностью комплементарен только одному субстрату.
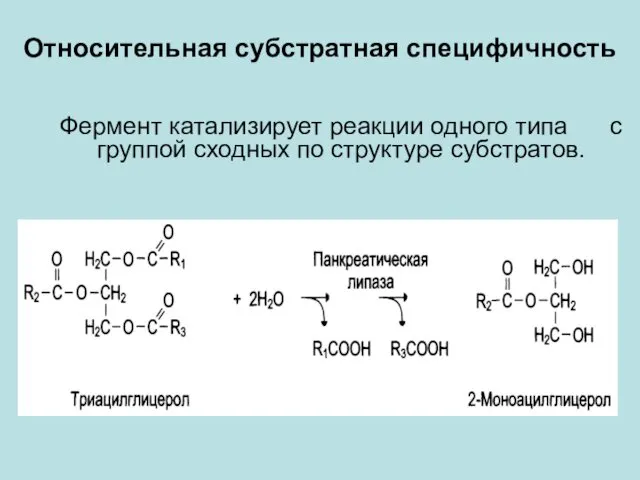
- 19. Относительная субстратная специфичность Фермент катализирует реакции одного типа с группой сходных по структуре субстратов.
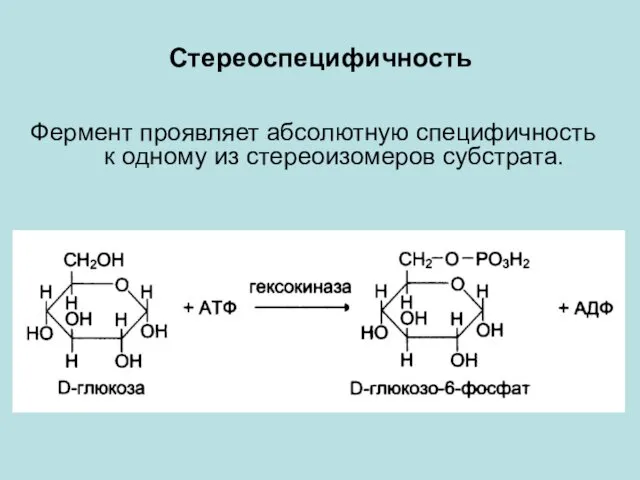
- 20. Стереоспецифичность Фермент проявляет абсолютную специфичность к одному из стереоизомеров субстрата.
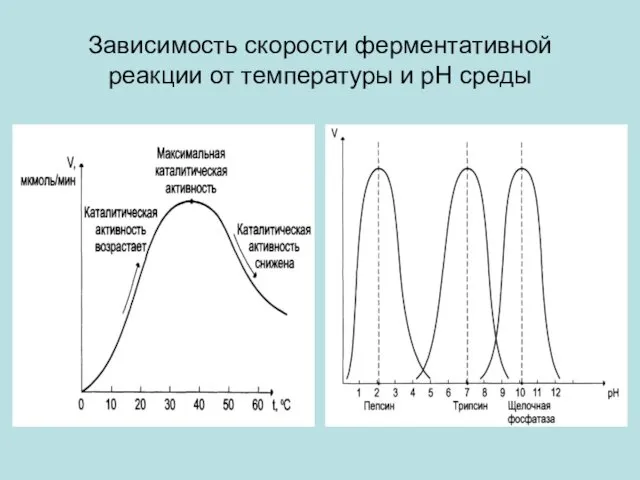
- 21. Зависимость скорости ферментативной реакции от температуры и рН среды
- 22. Зависимость скорости реакции от концентрации субстрата Уравнение зависимости V от [S] называется уравнением Михаэлиса-Ментен, где Vmax-максимальная
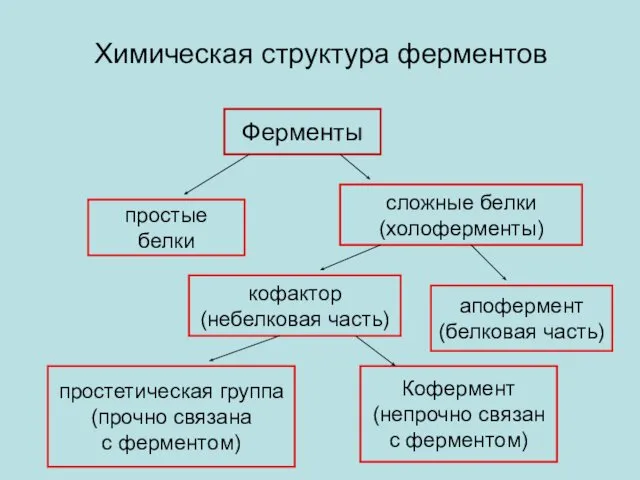
- 23. Химическая структура ферментов Ферменты простые белки сложные белки (холоферменты) кофактор (небелковая часть) апофермент (белковая часть) простетическая
- 24. Классификация кофакторов по химической природе: производные витамина В1 – тиаминдифосфат (ТДФ); производные витамина В2 – флавинадениндинуклеотид
- 25. Классификация ферментов
- 26. Шифр фермента – четырёхзначное цифровое обозначение, где первая цифра обозначает класс фермента, вторая цифра (подкласс) уточняет
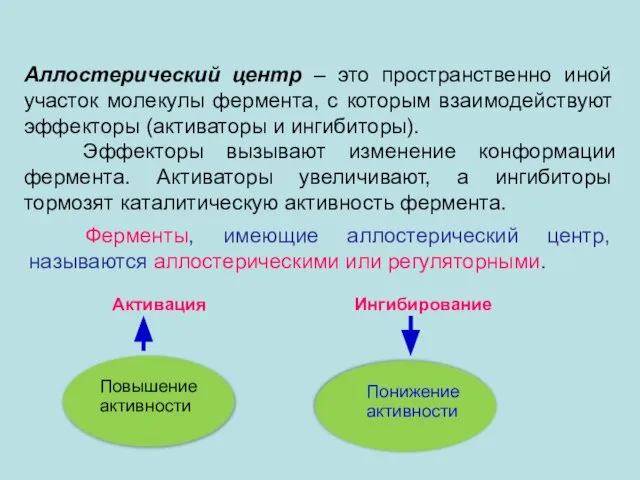
- 27. Аллостерический центр – это пространственно иной участок молекулы фермента, с которым взаимодействуют эффекторы (активаторы и ингибиторы).
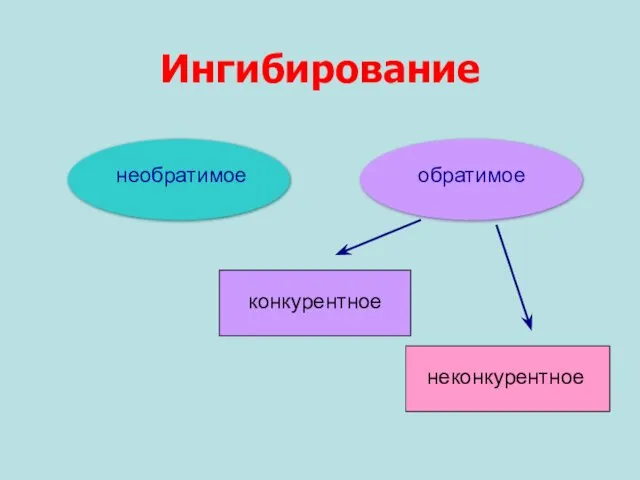
- 28. Ингибирование необратимое обратимое конкурентное неконкурентное
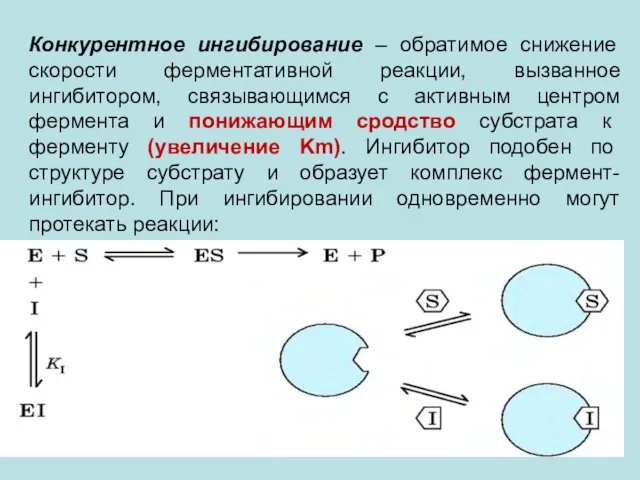
- 29. Конкурентное ингибирование – обратимое снижение скорости ферментативной реакции, вызванное ингибитором, связывающимся с активным центром фермента и
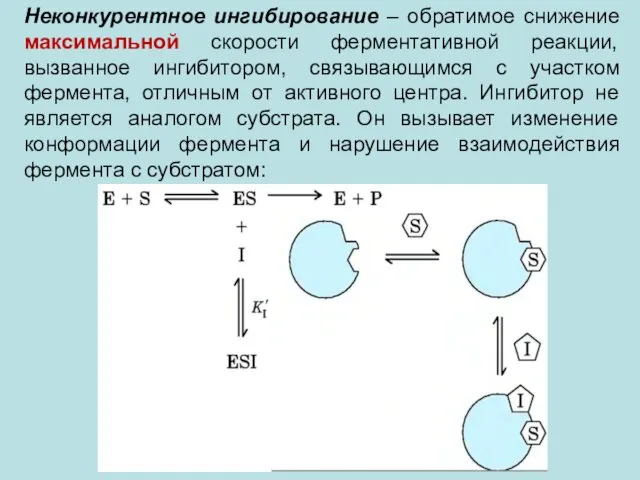
- 30. Неконкурентное ингибирование – обратимое снижение максимальной скорости ферментативной реакции, вызванное ингибитором, связывающимся с участком фермента, отличным
- 31. Необратимое ингибирование наблюдают в случае образования стабильных ковалентных связей между ингибитором и ферментом. Чаще всего модификации
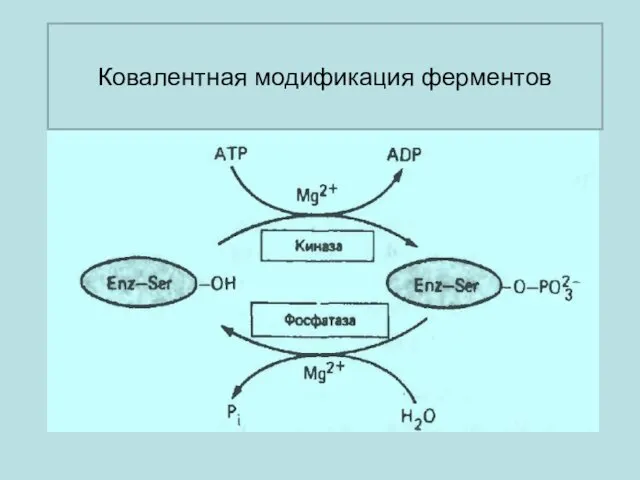
- 32. Регуляция активности ферментов 1. Аллостерическая 2. Частичный протеолиз 3. Ковалентная модификация (фосфорилирование-дефосфорилирование, метилирование, аденилирование, АДФ-рибозилирование) 4.
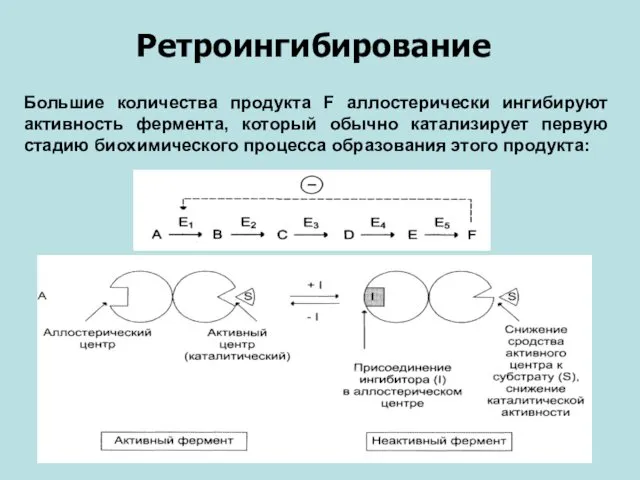
- 33. Ретроингибирование Большие количества продукта F аллостерически ингибируют активность фермента, который обычно катализирует первую стадию биохимического процесса
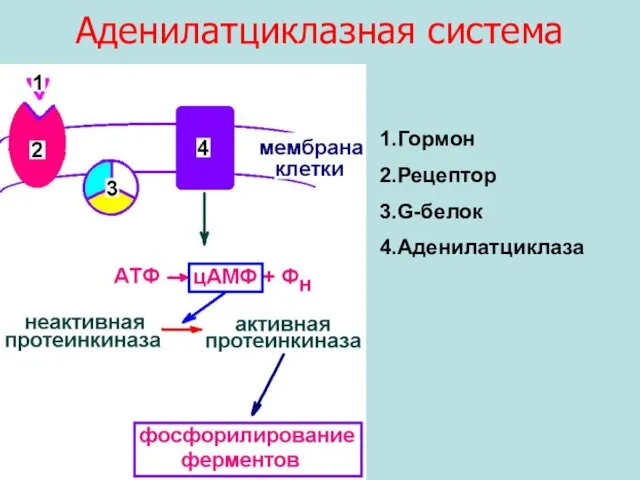
- 34. Аденилатциклазная система Передает сигнал от гормона, который не может проникнуть внутрь клетки, на внутри-клеточные ферменты. Гормон
- 35. Аденилатциклазная система 1.Гормон 2.Рецептор 3.G-белок 4.Аденилатциклаза
- 36. Фосфорилирование ферментов изменяет их активность. Одни ферменты становятся активными, а другие ферменты становятся неактивными.
- 37. Ковалентная модификация ферментов
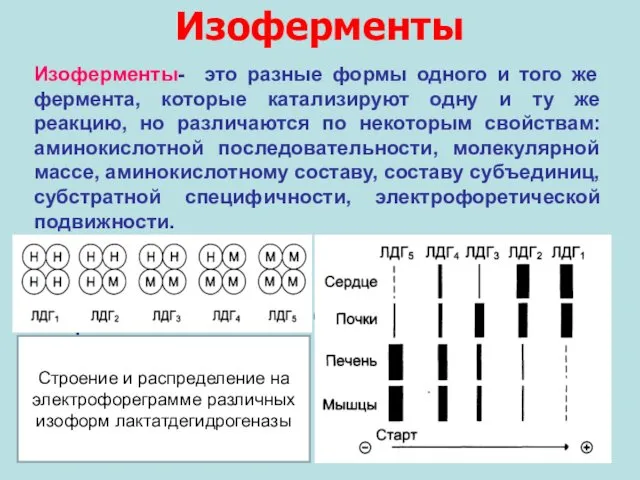
- 38. Изоферменты Изоферменты- это разные формы одного и того же фермента, которые катализируют одну и ту же
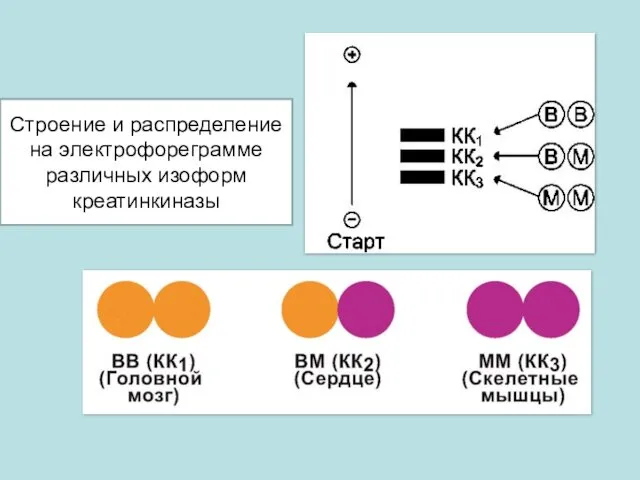
- 39. Строение и распределение на электрофореграмме различных изоформ креатинкиназы
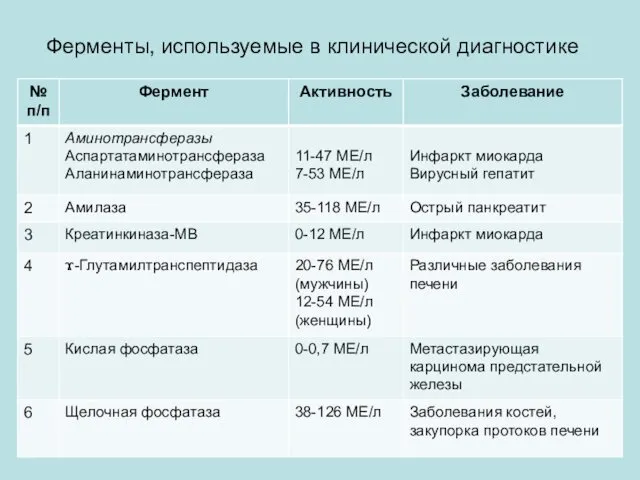
- 40. Ферменты, используемые в клинической диагностике
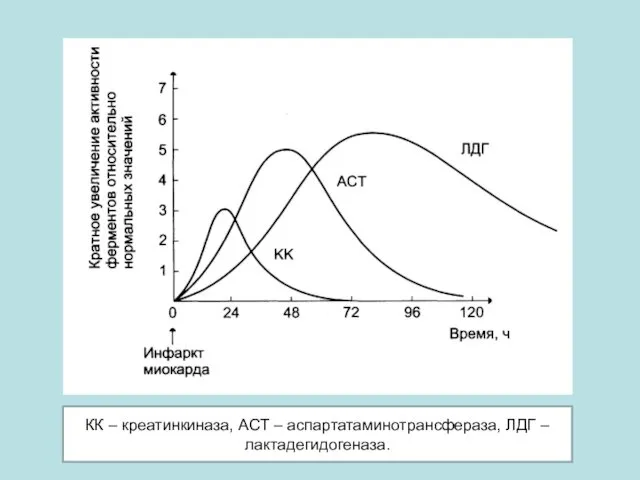
- 41. КК – креатинкиназа, АСТ – аспартатаминотрансфераза, ЛДГ – лактадегидогеназа.
- 42. Ферментные средства Пептидазы: ацидин-пепсин. 2. Протеазы: химотрипсин, химопсин. 3. Нуклеазы: рибонуклеаза, дезоксирибонуклеаза. 4. Фибринолитические ферменты: альтеплаза
- 44. Скачать презентацию








![Зависимость скорости реакции от концентрации субстрата Уравнение зависимости V от [S]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/496249/slide-21.jpg)








 Як спілкуються тварини
Як спілкуються тварини Тема урока: «Приспособленность организмов к условиям внешней среды, как результат действия естественного отбора».
Тема урока: «Приспособленность организмов к условиям внешней среды, как результат действия естественного отбора». Зоогигиенические условия содержания животных в неволе 2
Зоогигиенические условия содержания животных в неволе 2 Презентация почвенное питание растений как важнейшего процесса жизнедеятельности.
Презентация почвенное питание растений как важнейшего процесса жизнедеятельности. Низшие хордовые
Низшие хордовые Транспорт веществ и сигналов через мембрану
Транспорт веществ и сигналов через мембрану Импринтинг. Нарушения импринтинга как причина наследственной патологии. Семинар 7
Импринтинг. Нарушения импринтинга как причина наследственной патологии. Семинар 7 Самые необычные птицы
Самые необычные птицы Грибы. Строение гриба
Грибы. Строение гриба Home Sapiens-тің пайда болуы
Home Sapiens-тің пайда болуы Шоюн Александр Саноолович — поэт, прозаик
Шоюн Александр Саноолович — поэт, прозаик Біосфера. Унікальна система
Біосфера. Унікальна система  Методы и средства защиты растений от болезней
Методы и средства защиты растений от болезней Строение клеток прокариот и эукариот
Строение клеток прокариот и эукариот Онтогенез человека. Репродуктивное здоровье
Онтогенез человека. Репродуктивное здоровье Мигрирующие генетические элементы
Мигрирующие генетические элементы Презентация на тему "Строение клетки 5 класс" - скачать презентации по Биологии
Презентация на тему "Строение клетки 5 класс" - скачать презентации по Биологии Презентация на тему "Питательные вещества и их значение для организма" - скачать презентации по Биологии
Презентация на тему "Питательные вещества и их значение для организма" - скачать презентации по Биологии Презентация на тему Вредные привычки и их влияние на здоровье человека.
Презентация на тему Вредные привычки и их влияние на здоровье человека.  Влияние витаминов на организм человека Презентация ученицы 11 «Б» класса Марии Бельски
Влияние витаминов на организм человека Презентация ученицы 11 «Б» класса Марии Бельски ТЕМА: «Значение листа в жизни растений» Цель: Изучить основные функции листьев Задачи урока: 1. Изучить процессы фотосинтеза, испа
ТЕМА: «Значение листа в жизни растений» Цель: Изучить основные функции листьев Задачи урока: 1. Изучить процессы фотосинтеза, испа Оболочки мозга
Оболочки мозга Эпителиальные ткани. Железы
Эпителиальные ткани. Железы Гидронефроз (клинический случай)
Гидронефроз (клинический случай) Модульная единица 4. Тип Плоские Черви. Plathelminthes
Модульная единица 4. Тип Плоские Черви. Plathelminthes Обмен нуклеотидов
Обмен нуклеотидов Гистология, цитология, эмбрионология
Гистология, цитология, эмбрионология Выявление изменчивости у организмов. Лабораторная работа
Выявление изменчивости у организмов. Лабораторная работа