Содержание
- 2. Жоспар Кіріспе Негізгі бөлім Атомның кванты ~ механикалық моделі Квант сандары Қорытынды Пайдаланылған әдебиеттер
- 3. Кіріспе Кванттық ұғымдарды алғаш рет 1900 жылы М. Планк қызған денелердің жылулық сәуле шығаруын толық түсіндіретін
- 4. Негізгі бөлім Кванттық механика, толқындық механика – микробөлшектердің яғни (элементар бөлшектердің, атомдардың, молекулалардың, атом ядроларының) және
- 5. Квант Квант(нем. Quant, лат. quantum – қанша) – 1) табиғаты дискретті (үзілісті) физикалық шаманың мүмкін болатын
- 6. Электронды сипаттау үшін квантты механикалық (деңгейде орналасқан электрон) теория бойынша 4 квант саны қолданылады. Атом құрылысының
- 7. Атомдағы электронның кез келген тұрақты күйі белгілі квант сандарының мәнімен сипатталады. Квант сандарының белгілі мәндеріне сәйкес
- 8. Бас квант саныn-- кез-келген энергетикалық деңгейде орналасқан элетронның энергиясын сипаттайды немесе атомның радиусын көрсетеді. N=1,2,3….7 Бас
- 9. Магнит квант саны Me белгілі бір деңгейшеде орналасқан электрон бұлтының кеңістікте орналасу бағытын сипаттайды. M=-l….0+l L=0(s)
- 10. Спин квант саны ms – электронның ішкі қозғаласын сипаттайды. Оның мәні: +1/2 және -1/2.
- 12. Кванттық механика Атомдық деңгейдегі бөлшектердің қозғалысы мен əсерлесулерінің жалпы заңдылықтарын зерттейді жəне осы заңдылықтарға сүйене отырып
- 13. Кванттық механиканың көмегімен көптеген физикалық құбылыстарды түсіндіруге болады. Оны негізге ала отырып, атомдық спектрлердің, молекулалар құрылысының,
- 14. Элементтер атомдарындағы электрондардың атомдық орбитальдарда орналасуы үш жағдаймен анықталады: Паули принципі Хунда ережелері. Клечковский
- 15. Паули принципі Атомды квант сандарының мәндері бірдей болып келген екі электрон болмайды, ең келгенде бір квант
- 16. Клечковский ережелері Клечковкийдің бірінші ережесі. Энергетикалық деңгейлер энергияның жоғарылау бағытында толтырылады. Е=n+1 E1s=1+0=1 E2s=2+0=2 1
- 17. Клечковскийдің екінші ережесі. Егер деңгейшелердің энергиялары бірдей болса толтырылу реті бас квант саны бойынша анықталады.
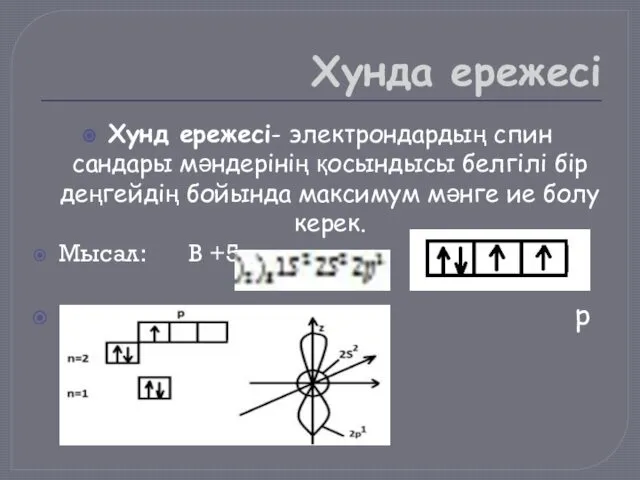
- 18. Хунда ережесі Хунд ережесі- электрондардың спин сандары мәндерінің қосындысы белгілі бір деңгейдің бойында максимум мәнге ие
- 19. Элементтердің S - және p- топтамалары. Атом құрылысының s-элементтерде сыртқы деңгейдің s-орбиталіне электрон тола бастайды. S-Орбиталіне
- 20. Элементтердің d-және f- топтамалары. d-элементтер сырттан санағанда 2-ші деңгейдің d-орбитальдары электронға тола басталады. Периодтық жүйеде қазір
- 21. Қорытынды Атомның энергия деңгейлері әр түрлі физикалық шамалармен сипатталатын төрт кванттық сандармен таныстып білдім және электрондар
- 23. Скачать презентацию


















 Электричество и магнетизм. Теорема Гаусса в дифференциальной форме. (Лекция 3)
Электричество и магнетизм. Теорема Гаусса в дифференциальной форме. (Лекция 3) Равномерное движение по окружности
Равномерное движение по окружности Исследовательская работа по теме: «Познай самого себя.» Цель работы: Рассчитать механические характеристики человека: объём т
Исследовательская работа по теме: «Познай самого себя.» Цель работы: Рассчитать механические характеристики человека: объём т Презентация по физике "Ломоносов" - скачать бесплатно
Презентация по физике "Ломоносов" - скачать бесплатно Научные фокусы. Электрические тени
Научные фокусы. Электрические тени Физика
Физика Создание источника тока А.Вольта
Создание источника тока А.Вольта Исследование баллистического движения
Исследование баллистического движения Сведения о технологии и условиях выполнения работ по техническому обслуживанию и ремонту
Сведения о технологии и условиях выполнения работ по техническому обслуживанию и ремонту Как работает насос
Как работает насос Виды топлива
Виды топлива Основные понятия и аксиомы
Основные понятия и аксиомы Механика. Основные понятия кинематики
Механика. Основные понятия кинематики Настройка автомодели для дрифтинга
Настройка автомодели для дрифтинга История паровых машин
История паровых машин Магнітне поле
Магнітне поле Расположение панелей и описание схемы ВЛ-80с
Расположение панелей и описание схемы ВЛ-80с Презентация по физике Сила тяжести
Презентация по физике Сила тяжести  Электрический ток в вакууме
Электрический ток в вакууме Физические основы воздействия на атмосферные процессы. Реагенты
Физические основы воздействия на атмосферные процессы. Реагенты Глава IV. Векторы в пространстве
Глава IV. Векторы в пространстве ОПТИКА Подготовка к ЕГЭ Учитель: Попова И.А. МОУ СОШ № 30 Белово 2010
ОПТИКА Подготовка к ЕГЭ Учитель: Попова И.А. МОУ СОШ № 30 Белово 2010 Диагностирование, техническое обслуживание и ремонт ходовой части ГАЗ 3307
Диагностирование, техническое обслуживание и ремонт ходовой части ГАЗ 3307 Интерференция света
Интерференция света Исследование симплектических интеграторов в применении к ограниченной круговой задаче трёх тел
Исследование симплектических интеграторов в применении к ограниченной круговой задаче трёх тел Давление. Кроссворд
Давление. Кроссворд В каком мире жили наши предки?
В каком мире жили наши предки?  Машинная игла
Машинная игла