Содержание
- 2. ПЛАН 9.1 Дисперсные системы и их классификация. 9.2 Получение и очистка коллоидных растворов. 9.3 Строение мицелл
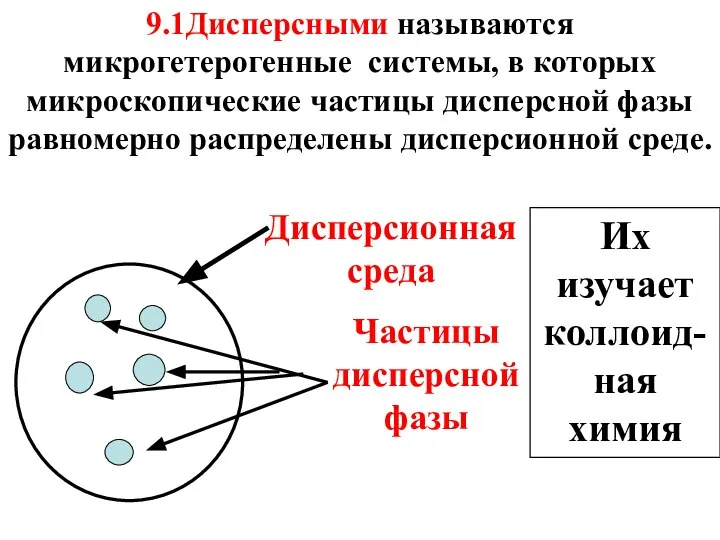
- 3. Дисперсионная среда Частицы дисперсной фазы 9.1Дисперсными называются микрогетерогенные системы, в которых микроскопические частицы дисперсной фазы равномерно
- 4. Классификация дисперсных систем 1) По степени дисперсности Коллоидно-дисперсные 10‾9 Грубо- дисперсные 10‾7 α- диаметр частицы дисперсной
- 5. 2) По степени взаимодействия дисперсной фазы и дисперсионной среды Под их взаимодействием понимают образование сольватных оболочек
- 6. Лиофильные - это системы, в которых сильно выражен эффект сольватации (растворы ВМС и ПАВ). Они устойчивы;
- 7. 3) По отсутствию или наличию межмолекулярного взаимодействия между частицами дисперсной фазы Свободно-дисперсные – частицы не связаны
- 8. 4) По агрегатному состоянию дисперсной фазы и дисперсионной среды
- 11. 9.2 Для получения коллоидных растворов используют: 1)метод диспергирования, 2)метод конденсации
- 12. Метод диспергирования– дробление крупных частиц до коллоидной степени дисперсности.
- 13. Диспергирование можно осуществлять : а) механическим дроблением (шаровые, коллоидные мельницы); б) электрическим распылением в вольтовой дуге
- 14. г) метод пептизации- дробление свежеприготовленных осадков на отдельные коллоидные частицы при добавлении небольшого количества электролита-пептизатора в
- 15. Ионы электролита-пептизатора адсорбируются на поверхности частиц осадка, сообщая им одноименный электрический заряд и способствуя переходу во
- 16. Пептизация имеет большое биологическое значение: рассасывание атеросклеротических бляшек, почечных и печеночных камней происходит под воздействием лекарственных
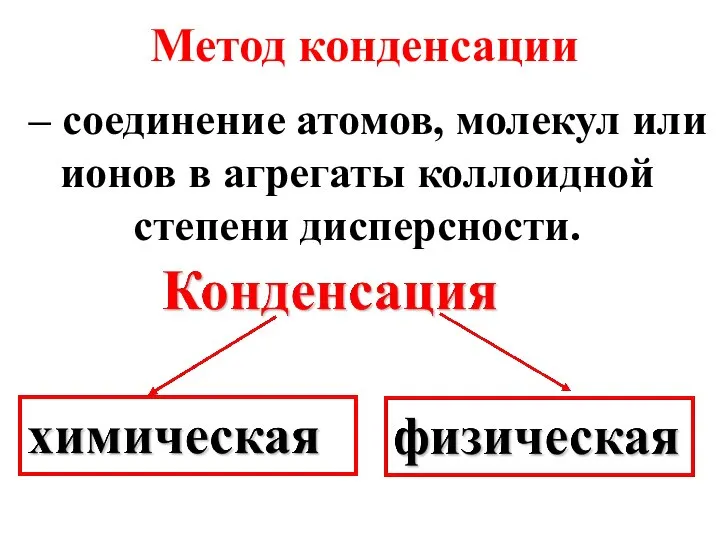
- 17. Метод конденсации – соединение атомов, молекул или ионов в агрегаты коллоидной степени дисперсности.
- 18. В основе химической конденсации лежат химические реакции, протекающие с образованием труднорастворимых соединений.
- 19. ОВР H[AuCl4] + 3 H2O2 → 2 Au ↓+ + 8 HCl + 3 O2 получение
- 20. гидролиз FeCl3 + 3 H2O ⮀ Fe(OH)3↓ + 3 HCl ионный обмен AgNO3 + KI →
- 21. Получение дисперсных систем методом физической конденсации выполняют: (а)путем замены растворителя (в раствор добавляют жидкость, в которой
- 22. В организме превалирующим является конденсационный метод. Одним из немногих примеров диспергирования является эмульгирование жиров в кишечнике.
- 23. Методы очистки золей Диализ и электродиализ– очистка золей от электролитов Ультрафильтрация-отделение дисперсной фазы от дисперсионной среды
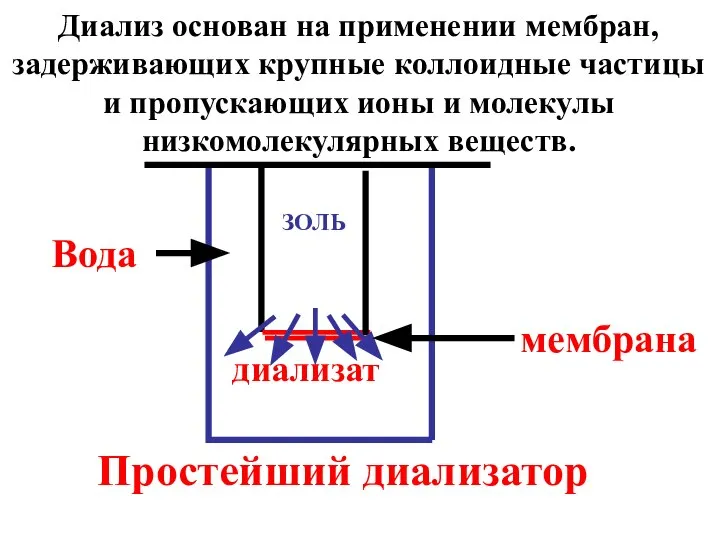
- 24. диализат ЗОЛЬ мембрана Простейший диализатор Вода Диализ основан на применении мембран, задерживающих крупные коллоидные частицы и
- 25. Диализ протекает медленно, но он может быть ускорен путем пропускания электрического тока через золь, подлежащий очистке.
- 26. Ультрафильтрация осуществляется путем продавливания золя через плотные фильтры, непроницаемые для частиц дисперсной фазы.
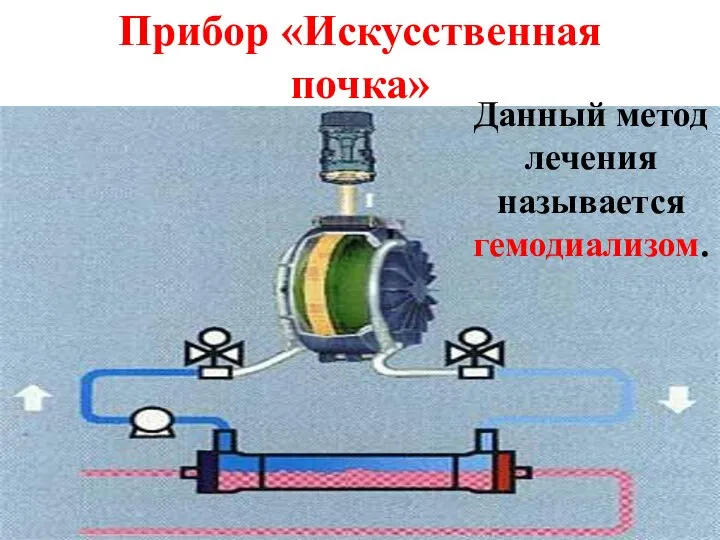
- 27. Процесс ультрафильтрации лежит в основе работы почек. Примером сочетания диализа и ультрафильтрации является аппарат "искусственная почка",
- 28. Прибор «Искусственная почка» Данный метод лечения называется гемодиализом.
- 29. 9.3 Согласно мицеллярной теории, золь состоит из мицелл и интермицеллярной жидкости.
- 30. Мицелла – это электронейтральная частица дисперсной фазы, окруженная двойным электрическим слоем ионов. Интермицеллярная жидкость – это
- 31. Основу мицеллы составляют микрокристаллы трудно-растворимого вещества, называемые агрегатом. В результате избирательной адсорбции на поверхности агрегата адсорбируются
- 32. Пример. Рассмотрим строение мицеллы золя AgI, образующегося в результате реакции: AgNO3 + KI → AgI +
- 33. Электролит в избытке (AgNO3) является стабилизатором т.к. сообщает устойчивость коллоидным частицам. Из его ионов формируется двойной
- 34. Формула мицеллы AgI {[m AgI] n Ag+ (n - x)NO3-}x+x NO3- агрегат ПОИ ПРИ ПРИ ядро
- 35. ПОИ – потенциалопредляющие ионы, адсорбирующиеся на поверхности агрегата, ПРИ – противоионы, адсорбирующиеся на поверхности ядра; они
- 36. Коллоидная частица (гранула) – это часть мицеллы, состоящая из агрегата и адсорбционного слоя. Заряд гранулы рассчитывают
- 37. Образование двойного электрического слоя (ДЭС) приводит к тому, что на поверхности раздела адсорбционного и диффузного слоя
- 38. ξ– потенциал служит мерой устойчивости коллоидных частиц, мерой размеров межклеточных пространств in vivo.
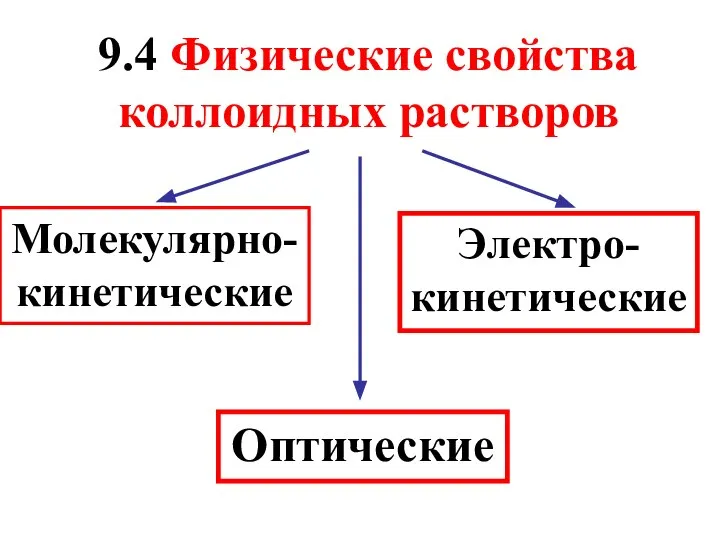
- 39. 9.4 Физические свойства коллоидных растворов Молекулярно-кинетические Оптические Электро-кинетические
- 40. Важнейшие молекулярно-кинетические свойства 1) Броуновское движение – хаотическое движение частиц дисперсной фазы под воздействием ударов молекул
- 41. 2) Диффузия – самопроизвольный процесс выравнивания концентраций частиц по всему объему раствора в результате броуновского движения.
- 42. Особые оптические свойства дисперсных систем обусловлены тем, что размеры коллоидных частиц сопоставимы с длиной волны видимого
- 43. Если луч света направить на коллоидный раствор, то его путь будет обнаруживаться на темном фоне в
- 44. Электрокинетическими явлениями называются процессы, протекающие в золях под воздействием внешнего электрического поля. К ним относят электрофорез
- 45. Электрофорез- это направленное движение коллоидных частиц под действием внешнего электрического поля относительно неподвижной дисперсионной среды (был
- 46. Электрофорез применяется для диагностики и контроля за ходом болезни. Его используют для введения лекарственных веществ в
- 47. Электроосмос – это движение дисперсионной среды относительно неподвижной дисперсной фазы через полупроницаемую мембрану во внешнем электрическом
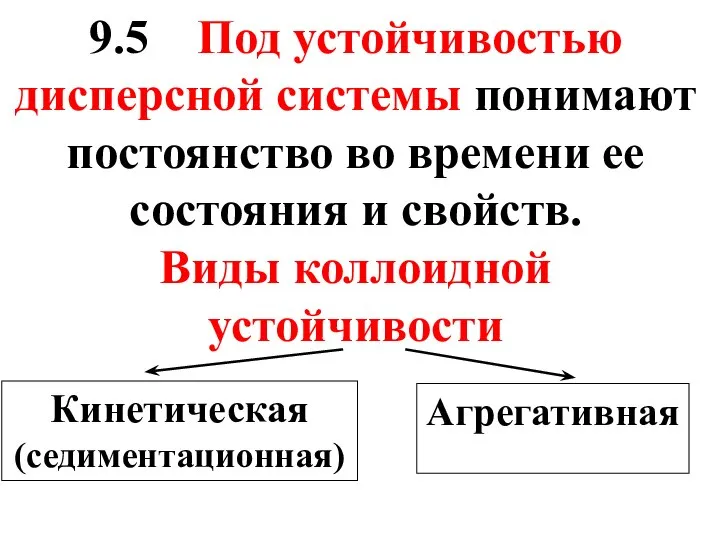
- 48. 9.5 Под устойчивостью дисперсной системы понимают постоянство во времени ее состояния и свойств. Виды коллоидной устойчивости
- 49. Причиной кинетической устойчивости является броуновское движение, которое противодействует оседанию частиц под действием силы тяжести.
- 50. Агрегативная устойчивость золей обусловлена наличием у коллоидных частиц одноименных электрических зарядов, препятствующих их слипанию при столкновении.
- 51. Чем больше заряд частицы, тем выше ее электрокинетический потенциал и стабильнее золь.
- 52. При нарушении агрегативной устойчивости золей происходит их коагуляция.
- 53. Коагуляция - процесс объединения коллоидных частиц в более крупные агрегаты вследствие полной или частичной потери электрических
- 54. Коагуляцию может вызывать: (а) изменение температуры, (б) увеличение концентрации дисперсной фазы, (в) механическое воздействие, (г) добавление
- 55. Коагуляция электролитами протекает в живом организме, т.к. коллоидные растворы клеток находятся в соприкосновении с электролитами, содержащимися
- 56. Все сильные электролиты вызывают коагуляцию золей при увеличении их концентрации в растворе до некоторого значения, называемого
- 57. Порог коагуляции (γ) – это минимальное количество электролита, которое надо добавить к 1 л золя, чтобы
- 58. Коагулирующие действие электролитов описывается правилом Шульце – Гарди: коагуляцию вызывают ионы, заряд которых противоположен заряду гранулы.
- 59. Дерягин и Ландау показали, что γI : γII : γIII = 1 1 1 16 26
- 60. Правило Шульце - Гарди носит приблизительный характер, т.к. не учитывает влияние ионных радиусов на коагулирующую способность
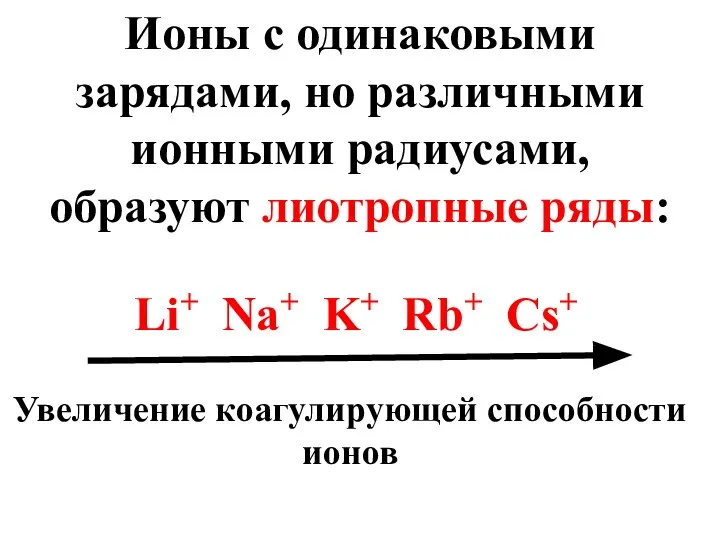
- 61. Ионы с одинаковыми зарядами, но различными ионными радиусами, образуют лиотропные ряды: Li+ Na+ K+ Rb+ Cs+
- 62. Процесс коагуляции золя характеризуется определенной величиной скорости коагуляции, которую можно определить как изменение числа коллоидных частиц
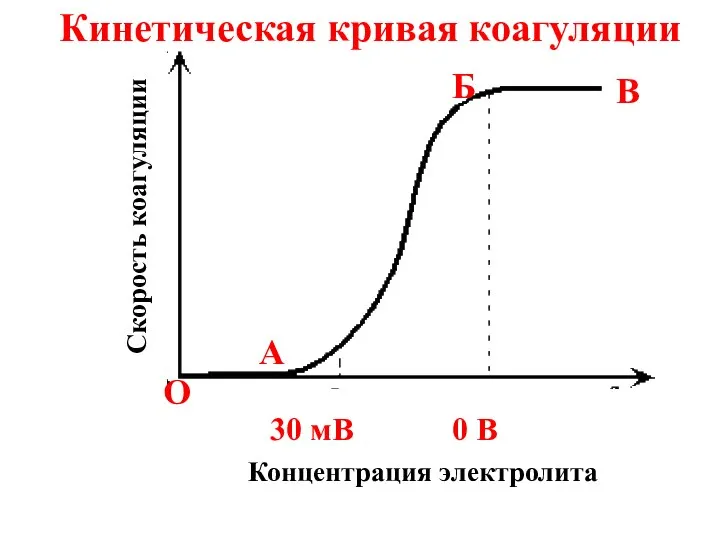
- 63. Кинетическая кривая коагуляции Скорость коагуляции Концентрация электролита 0 В 30 мВ O A Б B
- 64. Отрезок ОА отвечает периоду скрытой коагуляции, при которой золь сохраняет свою устойчивость.
- 65. В точке А начинается явная коагуляция, которая соответствует уменьшению ξ-потенциала коллоидных частиц до 30 мВ.
- 66. На участке БВ скорость коагуляции достигает максимального значения; этот отрезок кинетической кривой соответствует периоду быстрой коагуляции(ζ-потенциал
- 67. При коагуляции золя смесью электролитов можно наблюдать: а) явление аддитивности - суммирование коагулирующего действия ионов; б)
- 68. в) явление синергизма - усиление коагулирующего действия одного иона в присутствии другого.
- 69. Коагуляция может происходить при смешении золей с различными знаками заряда их частиц (взаимная коагуляция).
- 70. Такой тип коагуляции применяется в санитарно-гигиенической практике при очистке воды от взвешенных коллоидных частиц.
- 72. Скачать презентацию















![ОВР H[AuCl4] + 3 H2O2 → 2 Au ↓+ + 8](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1479196/slide-18.jpg)












![Формула мицеллы AgI {[m AgI] n Ag+ (n - x)NO3-}x+x NO3-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1479196/slide-33.jpg)
































 Применение лазеров в нанотехнологиях
Применение лазеров в нанотехнологиях Тепловые двигатели и нагнетатели. Компрессоры
Тепловые двигатели и нагнетатели. Компрессоры Презентация Радиоактивные отходы
Презентация Радиоактивные отходы  Плавление и отвердевание кристаллических тел
Плавление и отвердевание кристаллических тел А.С.Попов. Устройство и принцип действия первого приёмника.
А.С.Попов. Устройство и принцип действия первого приёмника.  Техносфера. Теплообмен тела человека с окружающей средой
Техносфера. Теплообмен тела человека с окружающей средой Закон Гей-Люссака
Закон Гей-Люссака Тема 3 -БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
Тема 3 -БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ ВОЗДЕЙСТВИЯ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ  Основные законы идеального газа
Основные законы идеального газа Физика в нашей жизни
Физика в нашей жизни Механизм деления ядер урана
Механизм деления ядер урана Физика в космосе
Физика в космосе Законы Ньютона для тел и жидкости. Аэрогидродинамика
Законы Ньютона для тел и жидкости. Аэрогидродинамика Домашнее задание «Кинематика». (Подготовка к контрольной работе)
Домашнее задание «Кинематика». (Подготовка к контрольной работе) Физика. Вопросы. Практическая работа
Физика. Вопросы. Практическая работа Плазма Электрический ток в плазме
Плазма Электрический ток в плазме  Магнитное поле
Магнитное поле Сила Лоренца
Сила Лоренца Презентация по физике "Естественный ядерный реактор Окло" - скачать
Презентация по физике "Естественный ядерный реактор Окло" - скачать  Өлшеу қателіктері
Өлшеу қателіктері Идеальный газ в МКТ
Идеальный газ в МКТ  Устройство приёмника А. С. Попова (11 класс)
Устройство приёмника А. С. Попова (11 класс) Метапредметный подход в преподавании физики
Метапредметный подход в преподавании физики Электростатическое поле в вакууме
Электростатическое поле в вакууме Муниципальное общеобразовательное учреждение средняя общеобразовательная школа № 5 г.
Муниципальное общеобразовательное учреждение средняя общеобразовательная школа № 5 г.  Протонно-нейтронная модель ядра. Физический смысл зарядового и массового чисел. Изотопы
Протонно-нейтронная модель ядра. Физический смысл зарядового и массового чисел. Изотопы Механические колебания
Механические колебания Физика 11
Физика 11