Содержание
- 2. Задание к этой лекции Подготовить ответы на вопросы: Опытные законы идеального газа (Бойля-Мариотта, Гей-Люссака). Изопроцессы и
- 3. Опытные законы, описывающие переходы газа из одних состояний в другие: Закон Бойля-Мариотта (1662 и 1676): произведение
- 4. Шкала Кельвина Изменив начало отсчета температуры переходим к абсолютной температуре. Нуль этой шкалы соответствует называется абсолютным
- 5. Границы применимости Эти законы справедливы для газов, в которых средние расстояния между молекулами значительно превышают диаметры
- 6. Закон А. Авогадро: моли любых газов при одинаковых температуре и давлении занимают одинаковые объемы (при н.у.
- 7. Идеальный газ Опр.1. Идеальным газом наз. газ, подчиняющийся законам Гей-Люссака и Бойля Мариотта. Опр.2. Уравнение, связывающее
- 8. Французский физик и инженер Б. Клапейрон вывел уравнение состояния идеального газа, объединив законы Бойля-Мариотта и Гей-Люссака.
- 9. Уравнение Клапейрона
- 10. Уравнение Менделеева Менделеев объединил уравнение Клапейрона с законом Авогадро, отнеся его к 1 молю и взяв
- 11. Уравнение Клапейрона-Менделеева Для произвольной массы газа: Опр.2′. Газ, свойства которого описываются этим уравнением состояния, называется идеальным.
- 12. Границы применимости При нормальной температуре уравнение М-К запишется так: Это отражает суть закона Бойля-Мариотта: произведение PV
- 13. Границы применимости На рис. 5.1 видно, что приведенное утверждение расходится с экспериментом, так как для различных
- 14. Модель МКТ использует атомно-молекулярную модель идеального газа. В этой модели идеальный газ представляется совокупностью хаотически движущихся
- 15. Вопрос на засыпку Что называется идеальным газом?
- 16. Ответ: Смотря с какой точки зрения: Феноменологический подход Теоретический (модельный) подход Иной взгляд (ваш!)
- 17. Две точки зрения Между точкой зрения феноменологической и точкой зрения МКТ есть соответствие: состояние газа характеризуется
- 18. Давление идеального газа. Основное уравнение МКТ. Давление. Поместим некоторую массу газа в сосуд под поршень площадью
- 19. 2 формы основного ур-я МКТ
- 20. Температура с молекулярно-кинетической точки зрения Температура. Понятие «температура» занимает центральное место в учении о тепловых процессах.
- 21. Опр. Соприкосновение тел, при котором возможна лишь передача тепла от одного тела к другому, будем наз.
- 22. В замкнутой системе всегда устанавливается состоянии теплового равновесия. Равновесие сопровождается одинаковой температурой любой части системы и
- 23. Верно ли утверждение??? Если температура частей системы не одинакова, то система не находится в термодинамическом равновесии.
- 24. Вывод: Существует пропорциональность между средней кинетической энергией теплового движения молекул и температурой t.
- 25. Основное уравнение МКТ Опираясь на опыт, можно записать Θ - некая температура Например, нормальная температура человеческого
- 26. Смысл температуры Отсюда средняя кинетическая энергия поступательного движения одной молекулы идеального газа
- 27. Вывод термодинамическая температура является мерой средней кинетической энергии поступательного движения молекул идеального газа. молекулярно-кинетический смысл понятия
- 28. Следствие: при одинаковой температуре средние кинетические энергии молекул всех газов одинаковы, несмотря на различие масс молекул
- 29. Вопрос на засыпку: Чему равна средняя кинетическая энергия молекулы газа при абсолютном нуле?
- 30. Ответ: При абсолютном нуле система находится в состоянии с наименьшей возможной энергией.
- 31. Термометрия Разработка и развитие методов измерения температуры привели к созданию специального раздела физики, который называется термометрией.
- 32. Вопросы на раздумье: Что можно взять в качестве термометрического тела? Какая величина может быть принята за
- 33. Ответ: В простейших и наиболее распространенных термометрах в качестве термометрического тела используется газ или жидкость, а
- 34. Термометрические шкалы Увеличение объема термического тела при нагревании и дает косвенную информацию об изменении температуры. Если
- 35. Эмпирическая температура известна точно лишь для реперных точек. Промежуточные температуры зависят от того, каким образом изменяется
- 36. Вопросы на засыпку: Температура газа равна 20 0С. Чему равна температура одного моля этого газа? Чему
- 37. Ответ на второй вопрос: Температура — макроскопическая характеристика термодинамических систем и для отдельной молекулы смысла не
- 38. 3-я форма основного уравнения МКТ
- 39. На заметку Основное уравнение МКТ идеального газа хорошо выполняется и для реальных достаточно разреженных газов несмотря
- 40. Задание Выведите из основного уравнения МКТ: Уравнение состояния идеального газа. Формулу для средней квадратичной скорости
- 41. Задание на следующую лекцию Среднее число столкновений и длина свободного пробега молекул газа. Явления переноса: диффузия,
- 43. Скачать презентацию








































 Ультразвуковий метод контролю дефектів у матеріалах і виробах
Ультразвуковий метод контролю дефектів у матеріалах і виробах Презентация по физике "Трение" - скачать бесплатно
Презентация по физике "Трение" - скачать бесплатно Реактивное движение
Реактивное движение Презентация по физике "Отчёт о методической работе за 2008-09 учебный год" - скачать
Презентация по физике "Отчёт о методической работе за 2008-09 учебный год" - скачать 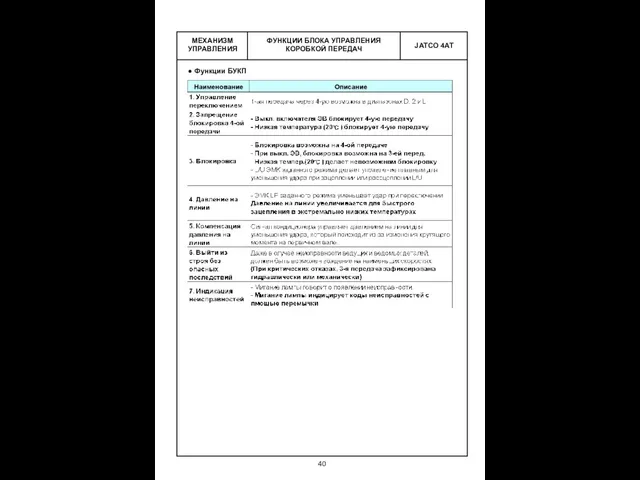 Механизм управления функции блока управления коробкой передач
Механизм управления функции блока управления коробкой передач Проверочная работа №1
Проверочная работа №1 Поляризация света
Поляризация света Уравнения поступательного движения
Уравнения поступательного движения Магнитное поле катушки с током. Электромагниты
Магнитное поле катушки с током. Электромагниты Методы определения массовых характеристик полимеров. вискозиметрия, гельхромотография. Методы фракционирования
Методы определения массовых характеристик полимеров. вискозиметрия, гельхромотография. Методы фракционирования Методы анализа элементного состава материалов
Методы анализа элементного состава материалов Презентация История создания тепловых двигателей
Презентация История создания тепловых двигателей  Техническое обслуживание и ремонт автотранспорта МДК 01.01. Устройство автомобилей
Техническое обслуживание и ремонт автотранспорта МДК 01.01. Устройство автомобилей Оптика полупроводников
Оптика полупроводников Получение и передача переменного электрического тока. Трансформатор
Получение и передача переменного электрического тока. Трансформатор Электрический заряд Закон Кулона
Электрический заряд Закон Кулона Lasers. Tutorial 2
Lasers. Tutorial 2 Основные сведения о переходном процессе в электроэнергетике в электрической дуге
Основные сведения о переходном процессе в электроэнергетике в электрической дуге Основы радиосвязи
Основы радиосвязи Исследование влияния трансмембранного потенциала на свойства клеток Hela
Исследование влияния трансмембранного потенциала на свойства клеток Hela Електризація тіл. Види електризації
Електризація тіл. Види електризації Постоянный электрический ток. Электрический ток, сила и плотность тока
Постоянный электрический ток. Электрический ток, сила и плотность тока Теплоотдача при вынужденном движении
Теплоотдача при вынужденном движении Ядерный реактор холодного ядерного синтеза
Ядерный реактор холодного ядерного синтеза Последовательное соединение проводников. Особенности последовательного соединения проводников
Последовательное соединение проводников. Особенности последовательного соединения проводников История создания ядерного оружия. Испытания ядерного оружия.
История создания ядерного оружия. Испытания ядерного оружия. 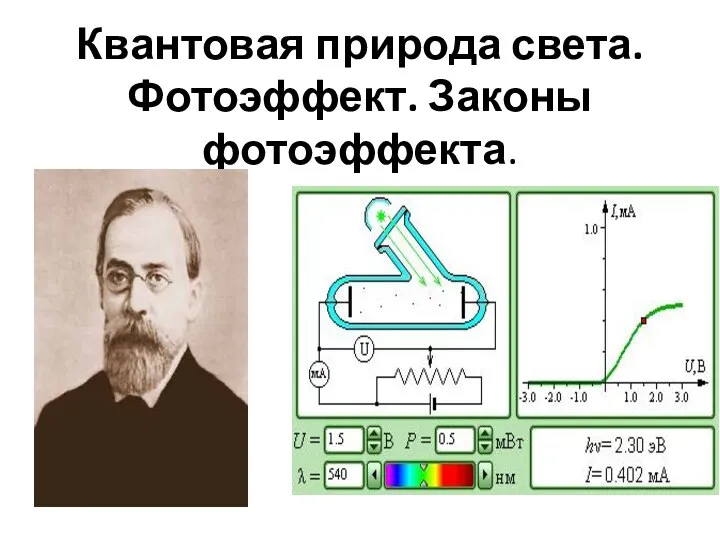 Квантовая природа света. Фотоэффект. Законы фотоэффекта
Квантовая природа света. Фотоэффект. Законы фотоэффекта Плоское движение тела
Плоское движение тела