Глава 27. Теория атома водорода по Бору Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г.
Содержание
- 2. Модель атома Дж. Дж. Томсона (1903) Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом
- 3. Ядерная (планетарная) модель атома Резерфорда (1911) Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze (Z
- 4. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид Уравнение (208.1)
- 5. Из выражения (208.1) следует, что при r ≈ 10-10 м скорость движения электронов v ≈ 106
- 6. § 209. Линейчатый спектр атома водорода Швейцарский ученый И. Бальмер (1825—1898) подобрал эмпирическую формулу, описывающую все
- 7. В дальнейшем (в начале XX в.) в спектре атома водорода было обнаружено еще несколько серий. В
- 8. В инфракрасной области спектра были также обнаружены: серия Пашена серия Брэкета серия Пфунда серия Хэмфри
- 9. Все приведенные выше серии в спектре атома водорода могут быть описаны одной формулой, называемой обобщенной формулой
- 10. § 210. Постулаты Бора Первый постулат Бора (постулат стационарных состояний): в атоме существуют стационарные (не изменяющиеся
- 11. Второй постулат Бора (правило частот): при переходе электрона с одной стационарной орбиты на другую излучается (поглощается)
- 12. На рисунке изображены стационарные орбиты атома водорода согласно модели Бора, а также условно изображены переходы электрона
- 13. § 211. Опыты Франка и Герца Немецкие физики Д. Франк и Г. Герц, изучая столкновения электронов
- 14. § 212. Спектр атома водорода по Бору Постулаты, выдвинутые Бором, позволили рассчитать спектр атома водорода и
- 15. Для атома водорода (Z = l) радиус первой орбиты электрона при n = 1, называемый первым
- 16. Учитывая квантованные для радиуса n-й стационарной орбиты значения (212.1), получим, что энергия электрона может принимать только
- 17. Целое число n в выражении (212.3), определяющее энергетические уровни атома, называется главным квантовым числом. Энергетическое состояние
- 18. Возможные уровни энергии, схематически представленные на рисунке 294.
- 19. Согласно второму постулату Бора (см. (210.2)), при переходе атома водорода (Z = l) из стационарного состояния
- 20. Спектр поглощения атома водорода является линейчатым, но содержит только серию Лаймана. Он также объясняется теорией Бора.
- 22. Скачать презентацию



















 Задачи на движение
Задачи на движение Кипение. Удельная теплота парообразования
Кипение. Удельная теплота парообразования Аттестационная работа. План проведения дистанционной недели физики в Ленинском муниципальном районе Московской области
Аттестационная работа. План проведения дистанционной недели физики в Ленинском муниципальном районе Московской области 15 минут про структуру атома
15 минут про структуру атома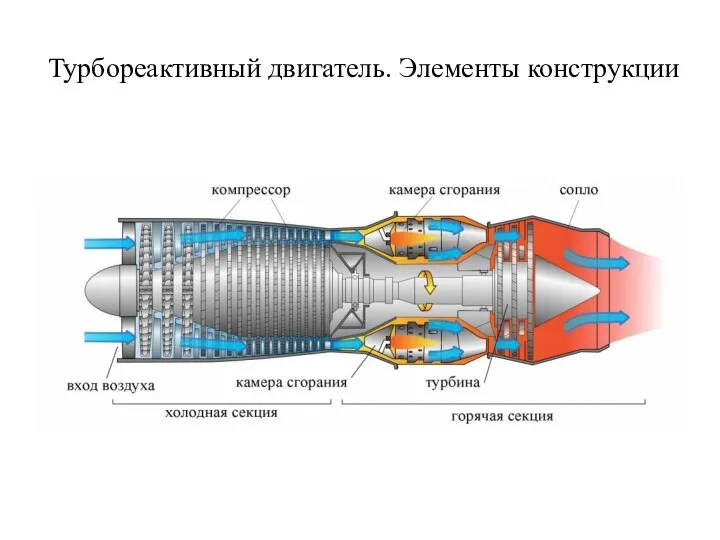 Турбореактивный двигатель. Элементы конструкции
Турбореактивный двигатель. Элементы конструкции Становление и развитие паротурбинных установок. (Тема 4)
Становление и развитие паротурбинных установок. (Тема 4) 1. ОСНОВНЫЕ СВЕТОТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ 2. ВИДЫ ОСВЕЩЕНИЯ 3. НОРМИРОВАНИЕ 4. ИСТОЧНИКИ СВЕТА И СВЕТИЛЬНИКИ
1. ОСНОВНЫЕ СВЕТОТЕХНИЧЕСКИЕ ХАРАКТЕРИСТИКИ 2. ВИДЫ ОСВЕЩЕНИЯ 3. НОРМИРОВАНИЕ 4. ИСТОЧНИКИ СВЕТА И СВЕТИЛЬНИКИ Познавательная сейсмология. Научно-популярные материалы
Познавательная сейсмология. Научно-популярные материалы Технологический колледж сервиса Государственное образовательное учреждение высшего профессионального образования Южно-Уральс
Технологический колледж сервиса Государственное образовательное учреждение высшего профессионального образования Южно-Уральс Улугбек, Галилей и Гук Мирза Мухаммед ибн Шахрух ибн Тимур Улугбек Гураган (1394-1449) -внук Тамерлана. Известен как выдающийся астр
Улугбек, Галилей и Гук Мирза Мухаммед ибн Шахрух ибн Тимур Улугбек Гураган (1394-1449) -внук Тамерлана. Известен как выдающийся астр Презентация по физике "Интерференция" - скачать
Презентация по физике "Интерференция" - скачать  Трансформаторы. Устройство однофазного трансформатора
Трансформаторы. Устройство однофазного трансформатора Путешествие по стране физика
Путешествие по стране физика Молекулярная физика
Молекулярная физика  Объяснение электрических явлений
Объяснение электрических явлений Презентация по физике "Закон ома для цепи" - скачать
Презентация по физике "Закон ома для цепи" - скачать  Корпускулярно-волновой дуализм
Корпускулярно-волновой дуализм Аттестационная работа. На тему: Методическая разработка занятия Что такое магнит?
Аттестационная работа. На тему: Методическая разработка занятия Что такое магнит? Спектроскопические методы анализа
Спектроскопические методы анализа Швартовное устройство
Швартовное устройство Mechacnics. Molecular physics and Thermodynamics. Electricity. Magnetism
Mechacnics. Molecular physics and Thermodynamics. Electricity. Magnetism Экстраполяция. Динамика полёта и пилотирование самолётов
Экстраполяция. Динамика полёта и пилотирование самолётов ПОЛУЧЕНИЕ РАДИОАКТИВНЫХ ИЗОТОПОВ И ИХ ПРИМЕНЕНИЕ
ПОЛУЧЕНИЕ РАДИОАКТИВНЫХ ИЗОТОПОВ И ИХ ПРИМЕНЕНИЕ Лазеры. Лазерное излучение
Лазеры. Лазерное излучение Дисперсия света. Использование в технике
Дисперсия света. Использование в технике Голография и ее применение
Голография и ее применение Нагревание проводников электрическим током. Закон Джоуля-Ленца
Нагревание проводников электрическим током. Закон Джоуля-Ленца Презентация на тему "Спектры"
Презентация на тему "Спектры"