Содержание
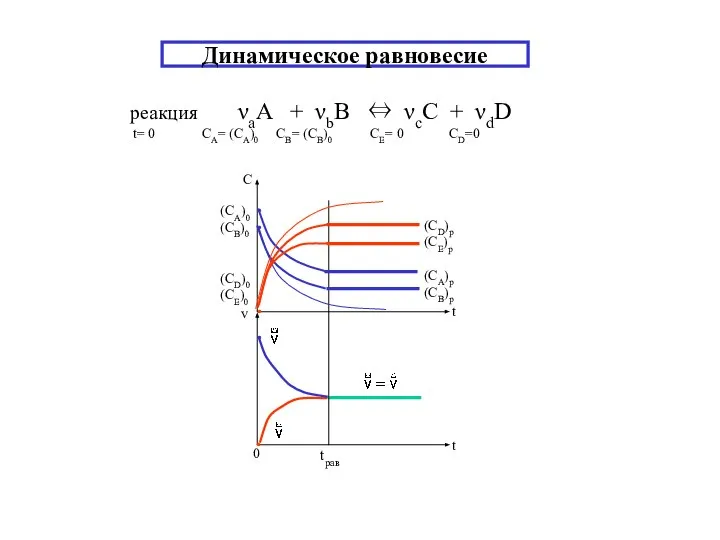
- 2. Динамическое равновесие реакция νаA + νbB ⇔ νсC + νdD t= 0 CA= (CA)0 CB= (CB)0
- 3. Константа равновесия К, её размерность. Связь между К (кинетич.) и стандартной К 0 (термодинам.) К≡KX -
- 4. Расчет равновесного состава(концентраций) газовой смеси 1. Расчет К0(Т) Для определенной Т рассчитывают → ΔrG0(T)=ΔrH0(T) –Т·ΔrS0(T). Затем
- 5. Пример. Диссоциация АВ при Р -const и температуре Т АВ = А + В ni САВ-z
- 6. Равновесие в растворах(дисперсных системах)
- 7. Электролитическая диссоциация С0 α → 1 КД → ∞
- 8. Ионное произведение воды H2O ⇔ H+ + OH- Нейтральная среда [H+] = [OH–] = 10-7 [моль/л]
- 9. Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7 Кислая среда pH Щелочная среда pH
- 10. Растворы кислот и оснований МеOH ⇔ Ме+ + OH- Слабые электролиты α →0 Сильные электролиты α
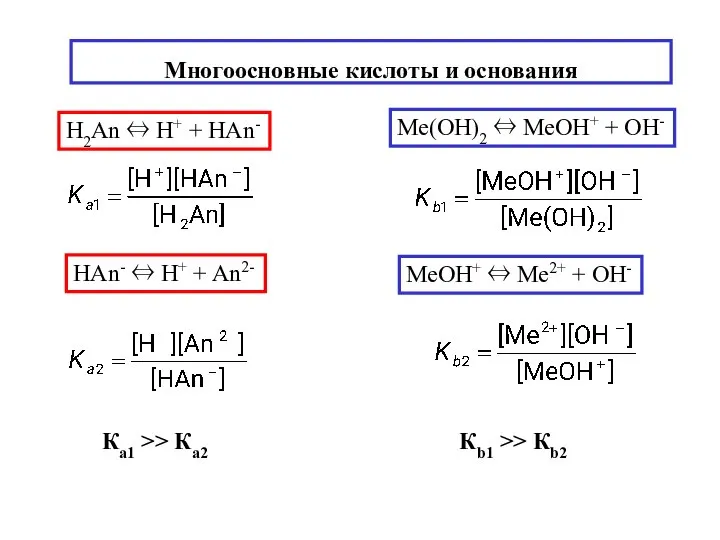
- 11. Многоосновные кислоты и основания H2An ⇔ H+ + НAn- HAn- ⇔ H+ + An2- Ка1 >>
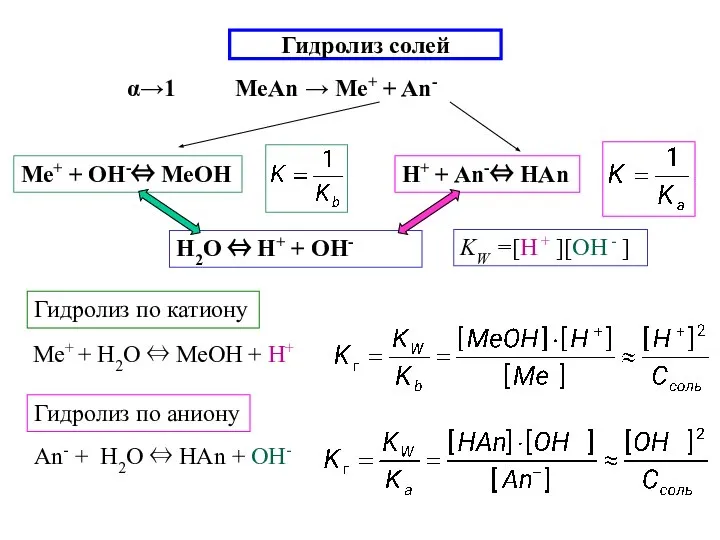
- 12. Гидролиз солей α→1 МеAn → Ме+ + An- Гидролиз по катиону Гидролиз по аниону
- 13. Примеры гидролиза солей 1) Kb→0; Ka→ ∞ CuSO4 → Cu2+ + SO42- 2 CuSO4+ 2 H2O
- 14. Произведение растворимости - ПР [Kat+] = x·S [моль/л] [An-] = y·S [моль/л]
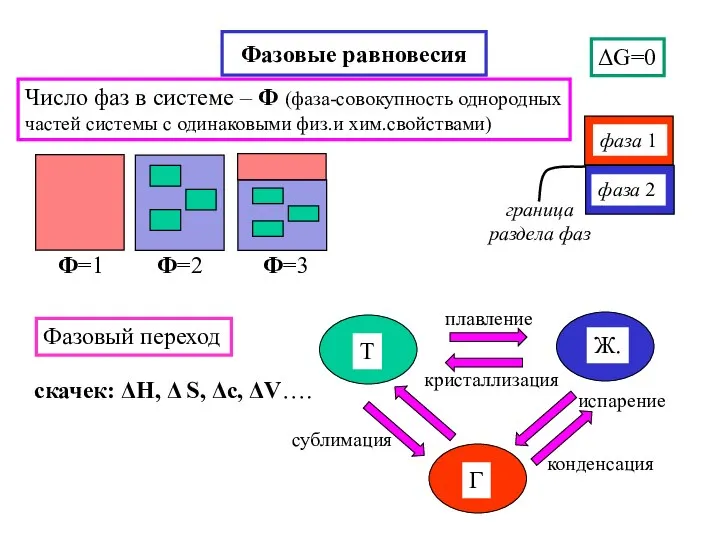
- 15. Фазовые равновесия ΔG=0 Фазовый переход скачек: ΔH, Δ S, Δc, ΔV…. Число фаз в системе –
- 16. Число компонентов – К (независимые составные части системы) Число видов молекул, необходимое и достаточное для образования
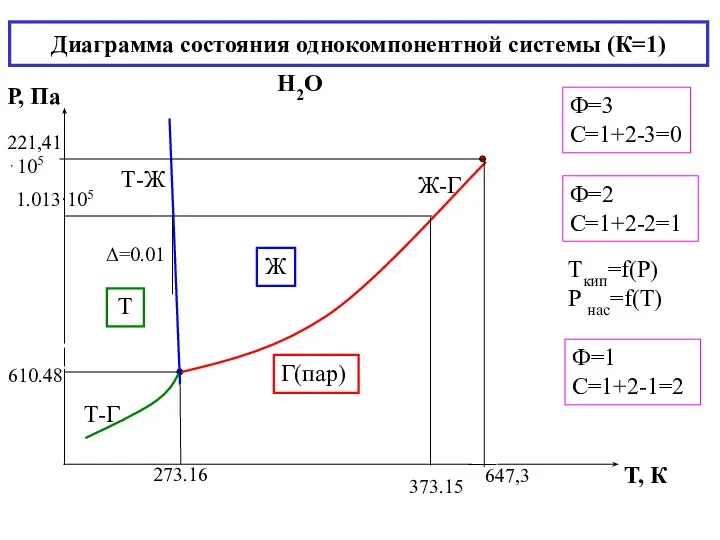
- 17. Диаграмма состояния однокомпонентной системы (К=1) Н2О Ф=2 С=1+2-2=1 Ф=3 С=1+2-3=0 Ф=1 С=1+2-1=2 Ж Г(пар) Т Tкип=f(Р)
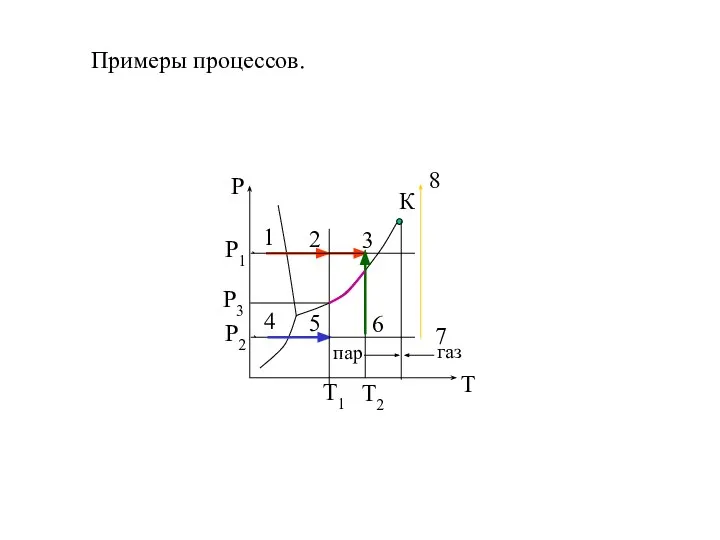
- 18. Примеры процессов.
- 19. Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. α→ 0 p 0–давление насыщенного пара (Н2Опар )
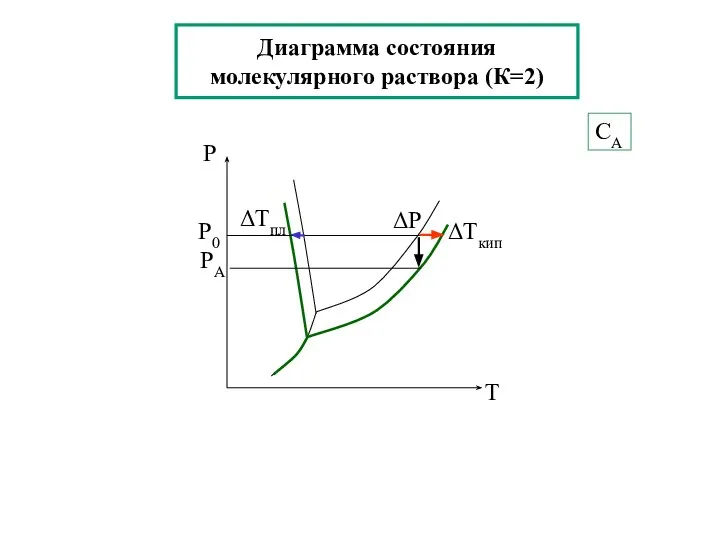
- 20. Диаграмма состояния молекулярного раствора (К=2) СА
- 21. Кипение и кристаллизация растворов Повышение температуры кипения раствора по сравнению с чистым растворителем (ΔТкип) прямо пропорционально
- 22. Эбуллиоскопические и криоскопические постоянные некоторых растворителей
- 24. Скачать презентацию





![Ионное произведение воды H2O ⇔ H+ + OH- Нейтральная среда [H+]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/629253/slide-7.jpg)
![Водородный показатель pH = –lg[H+] Нейтральная среда pH = 7 Кислая](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/629253/slide-8.jpg)


![Произведение растворимости - ПР [Kat+] = x·S [моль/л] [An-] = y·S [моль/л]](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/629253/slide-13.jpg)

![Двухкомпонентная система [К=2(вода+ растворенное вeщество А)], молекулярный раствор. α→ 0 p](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/629253/slide-18.jpg)


 Электромагнитные излучения
Электромагнитные излучения Общая характеристика АФУ телекоммуникационных систем
Общая характеристика АФУ телекоммуникационных систем Дослідження фізичних характеристик світлодіодів
Дослідження фізичних характеристик світлодіодів Основные сведения об электромагнитных переходных процессах
Основные сведения об электромагнитных переходных процессах Использование фотохромных превращений центров окраски в кристаллах фторида кальция для создания голографической среды
Использование фотохромных превращений центров окраски в кристаллах фторида кальция для создания голографической среды Открытие радиоактивности
Открытие радиоактивности Оптичне явище - міражі
Оптичне явище - міражі Електричний струм – упорядковий рух зарядженних частинок
Електричний струм – упорядковий рух зарядженних частинок Регулирование скорости вращения электроприводов с асинхронным двигателем (лекция 7)
Регулирование скорости вращения электроприводов с асинхронным двигателем (лекция 7) Электромагнитные волны
Электромагнитные волны Презентация по физике "Задачи на движение. Движение протяженных тел" - скачать
Презентация по физике "Задачи на движение. Движение протяженных тел" - скачать  Виртуальный практикум. Гамма спектрометрия
Виртуальный практикум. Гамма спектрометрия «Совет мудрецов» Учитель: Цинадзе Олеся Валентиновна МБОУ «Гимназия №4» г.о. Дзержинский. 5 декабря , 2011
«Совет мудрецов» Учитель: Цинадзе Олеся Валентиновна МБОУ «Гимназия №4» г.о. Дзержинский. 5 декабря , 2011 Мәліметтерді тутынушуға электр байланыс арқылы жеткізу үшін сигналдар қолданылады
Мәліметтерді тутынушуға электр байланыс арқылы жеткізу үшін сигналдар қолданылады Теория относительности
Теория относительности Спектральные методы анализа
Спектральные методы анализа ИСААК НЬЮТОН 1643-1727
ИСААК НЬЮТОН 1643-1727 Физические величины в электроэнергетике, их размерности
Физические величины в электроэнергетике, их размерности Расчет установившихся режимов простейших электрических сетей. (Глава 6)
Расчет установившихся режимов простейших электрических сетей. (Глава 6) Презентация по физике Законы Ньютона
Презентация по физике Законы Ньютона  Rol_fiziki_v_fotonikeLektsia1
Rol_fiziki_v_fotonikeLektsia1 Механические колебания 11 класс - Презентация_
Механические колебания 11 класс - Презентация_ Презентация по физике "Трение" - скачать бесплатно
Презентация по физике "Трение" - скачать бесплатно Электродинамика (повторение)
Электродинамика (повторение) Электромагнитное поле
Электромагнитное поле Физика глазами литераторов.
Физика глазами литераторов. Свободное падение
Свободное падение Насосные станции водоотведения. (Лекция 5)
Насосные станции водоотведения. (Лекция 5)