Химическое превращение. Стехиометрическое уравнение. Термодинамический анализ химических превращений. (Тема 4.1-4.2)
Содержание
- 2. Химическое превращение Стехиометрическое уравнение Термодинамический анализ химических превращений: Направленность реакции и химическое равновесие Изменение равновесного превращения
- 3. Целью исследований химического процесса на уровне химической реакции является построение кинетической модели - зависимости скорости реакции
- 4. Химическое превращение Химической реакцией считается любое изменение вещества, при котором образуются или разрываются связи между атомами.
- 5. Химическое превращение В газовой фазе при обычных условиях молекулы занимают лишь менее 1 % объема фазы
- 6. Химическое превращение Вероятность возникновения реакции при столкновении зависит от кинетической энергии соударяющихся молекул. Реагировать будут только
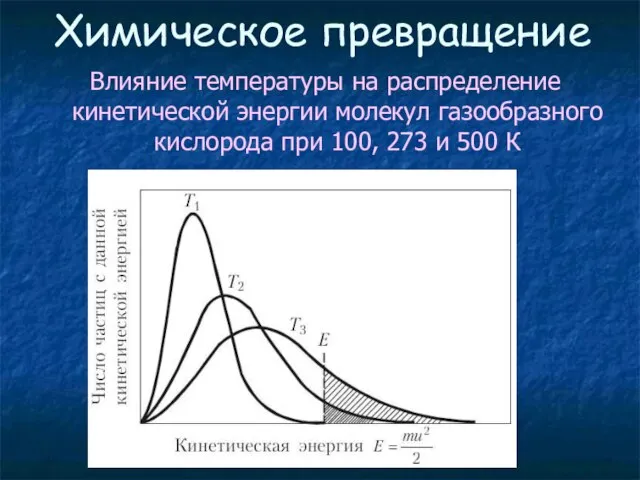
- 7. Химическое превращение Влияние температуры на распределение кинетической энергии молекул газообразного кислорода при 100, 273 и 500
- 8. Химическое превращение Возможность прохождения реакции между веществами в общем случае зависит: От энергии столкновения От надлежащей
- 9. Химическое превращение Вероятность того, что столкнувшиеся молекулы будут иметь достаточную для реакции энергию, пропорциональна Вероятность их
- 10. Стехиометрическое уравнение Стехиометрические уравнения составляются на основе фундаментальных законов природы: - закон сохранения массы - закон
- 11. Стехиометрическое уравнение Простая реакция (реакция окисления диоксида серы): SO2 + 0,5O2 = SO3 но сложная по
- 12. Стехиометрическое уравнение Базисная система стехиометрических уравнений, однозначно и полно описывающая баланс процесса, должна содержать число стехиометрически
- 13. Стехиометрическое уравнение Стехиометрически независимыми считаются уравнения, которые не могут быть получены линейной комбинацией других . При
- 14. Стехиометрическое уравнение Концентрация i-го компонента в реагирующей смеси при изменении объема реакционной смеси Концентрация i-го компонента
- 15. Химическое превращение Пример: конверсия метана СН4 + Н2О = СО + 3Н2; СО + Н2О =
- 16. Химическое превращение Пример: конверсия метана Концентрации компонентов (в мольных долях) ; ;
- 17. Направленность реакции Δ Gр,Т Δ Gр,Т > 0 - реакция не возможна Δ Gр,Т = 0
- 18. Направленность реакции Изменение химического состава реагирующей смеси приводит к изменению ее энтальпии (теплосодержания) ΔНТ. При отсутствии
- 19. Направленность реакции Если [(ΔНТ)обр]прод qр ~ - ΔНТ – реакция экзотермическая. Если [(ΔНТ)обр]прод > [(ΔНТ)обр] исх
- 20. Направленность реакции Тепловой эффект реакции В справочной литературе тепловой эффект реакции обычно относят к 1 молю
- 21. Химическое равновесие Изотерма химической реакции (уравнение Вант-Гоффа) В условиях равновесия
- 22. Химическое равновесие Изотерма химической реакции при равновесии Тогда или
- 23. Химическое равновесие Для идеальных газовых смесей и жидкостей Кр зависит: - от природы реагентов и температуры
- 24. Химическое равновесие Например: при синтезе аммиака при 450 °С по реакции N2+ЗН2 2NH3 при увеличении давления
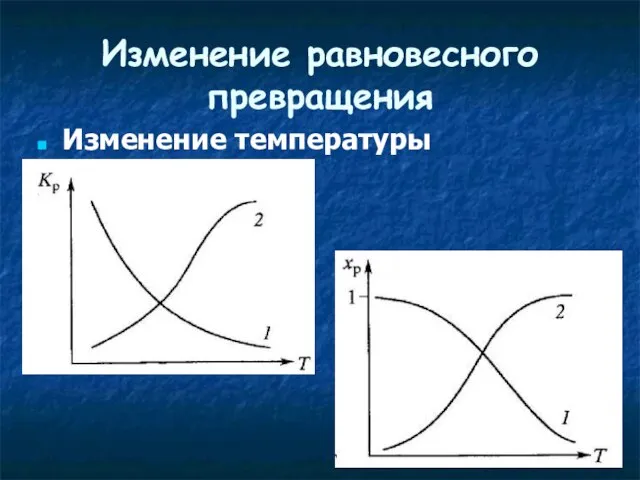
- 25. Изменение равновесного превращения Изменения химического равновесия достигают, изменяя внешние условия процесса. Направленность влияния способов управления определяется
- 26. Изменение равновесного превращения Изменение температуры
- 27. Изменение равновесного превращения Изменение давления При увеличении давления в газовой системе происходит уменьшение объема системы и
- 28. Изменение равновесного превращения Разбавление реакционной смеси инертным веществом Эффект от разбавления инертным веществом равнозначен уменьшению давления
- 30. Скачать презентацию
















![Направленность реакции Если [(ΔНТ)обр]прод qр ~ - ΔНТ – реакция экзотермическая.](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/524532/slide-18.jpg)








 Физические и химические явления
Физические и химические явления Организация работы ремонтного электровозного депо (на примере СЛД-83 Чита) в условия увеличения пропускной способности
Организация работы ремонтного электровозного депо (на примере СЛД-83 Чита) в условия увеличения пропускной способности «Производство и использование электрической энергии»
«Производство и использование электрической энергии»  Получение и передача переменного электрического тока
Получение и передача переменного электрического тока Работа и энергия. (Тема 4)
Работа и энергия. (Тема 4) Двухполюсники и четырехполюсники
Двухполюсники и четырехполюсники Работа газа и пара при расширении. Двигатель внутреннего сгорания
Работа газа и пара при расширении. Двигатель внутреннего сгорания Ультрафиолетовое излучение
Ультрафиолетовое излучение Измерение показателя преломления и дисперсии на гониометре. Измерение показателя преломления и дисперсии на рефрактометре
Измерение показателя преломления и дисперсии на гониометре. Измерение показателя преломления и дисперсии на рефрактометре Измерение массы
Измерение массы Исследование динамики развития плазмы вакуумной искры методом высокоскоростной фоторегистрации
Исследование динамики развития плазмы вакуумной искры методом высокоскоростной фоторегистрации Эволюция вселенной
Эволюция вселенной БиОлОГиЧеСкИе ДеЙстВиЯ РаДиОаКтИвНыХ иЗлУчЕнИй На ЖиВоТнЫй МиР…
БиОлОГиЧеСкИе ДеЙстВиЯ РаДиОаКтИвНыХ иЗлУчЕнИй На ЖиВоТнЫй МиР… Алгоритм Евклида Составила: Антонова Е.П. 2009г.
Алгоритм Евклида Составила: Антонова Е.П. 2009г. Дифракция света
Дифракция света Плотность вещества, масса и объем. Решение задач
Плотность вещества, масса и объем. Решение задач Презентация по физике "Історія вивчення атома." - скачать бесплатно
Презентация по физике "Історія вивчення атома." - скачать бесплатно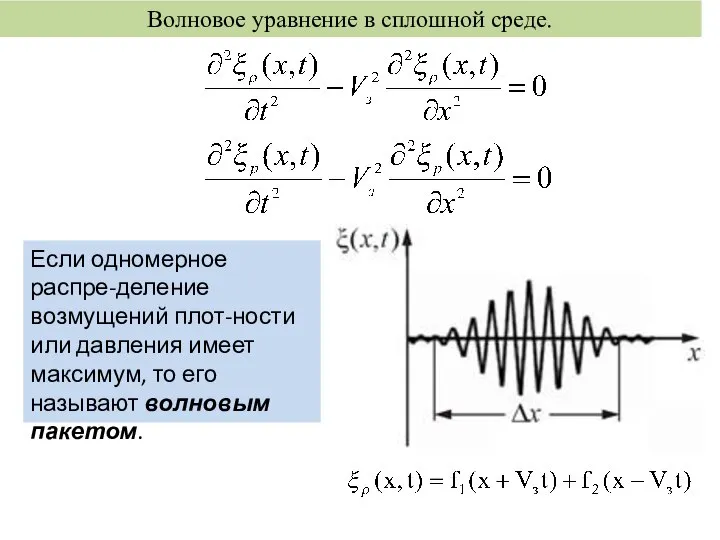 Волновое уравнение в сплошной среде
Волновое уравнение в сплошной среде Закони Ньютона
Закони Ньютона  Молниезащита. (Лекция 9)
Молниезащита. (Лекция 9) Теплоемкости газов. Термодинамические процессы
Теплоемкости газов. Термодинамические процессы Продольные и поперечные волны. Уравнение плоской гармонической волны. Стоячие волны
Продольные и поперечные волны. Уравнение плоской гармонической волны. Стоячие волны Теплопередача. Виды теплопередачи
Теплопередача. Виды теплопередачи Влияние механических и тепловых воздействий на механические свойства материалов (прочность и пластичность)
Влияние механических и тепловых воздействий на механические свойства материалов (прочность и пластичность) электродинамика Лекция 10
электродинамика Лекция 10  Тепловое излучение
Тепловое излучение Аттестационная работа. Проведение энергетического исследования на предприятиях и учреждениях ЖКХ
Аттестационная работа. Проведение энергетического исследования на предприятиях и учреждениях ЖКХ Углеродные нанообъекты. Способы создания нанообъектов
Углеродные нанообъекты. Способы создания нанообъектов