Содержание
- 2. Закон сохранения энергии Энергия в природе не возникает из ничего и не исчезает: количество энергии неизменно,
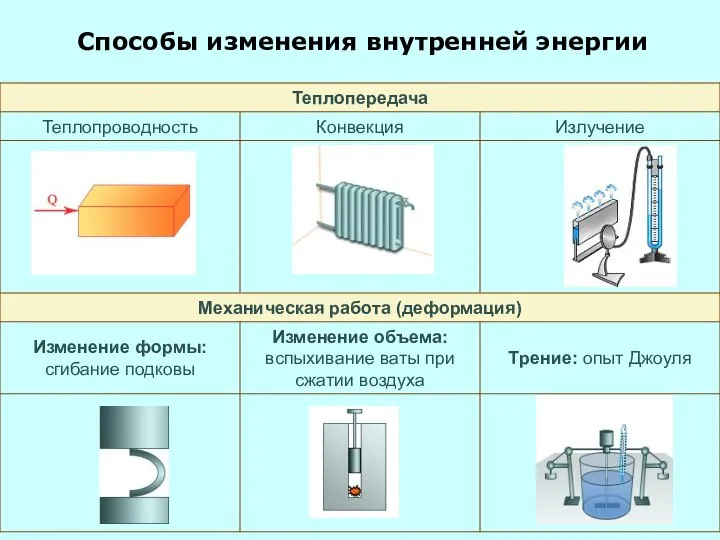
- 3. Способы изменения внутренней энергии
- 4. I закон термодинамики внутренняя энергия определяется только состоянием системы, причем изменение внутренней энергии системы при переходе
- 5. Если при нагревании газ расширяется и при этом совершает работу A, то первый закон термодинамики можно
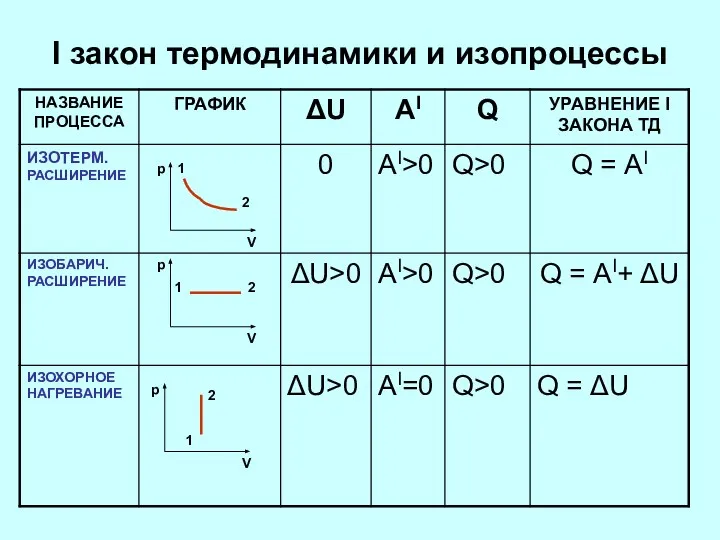
- 6. I закон термодинамики и изопроцессы
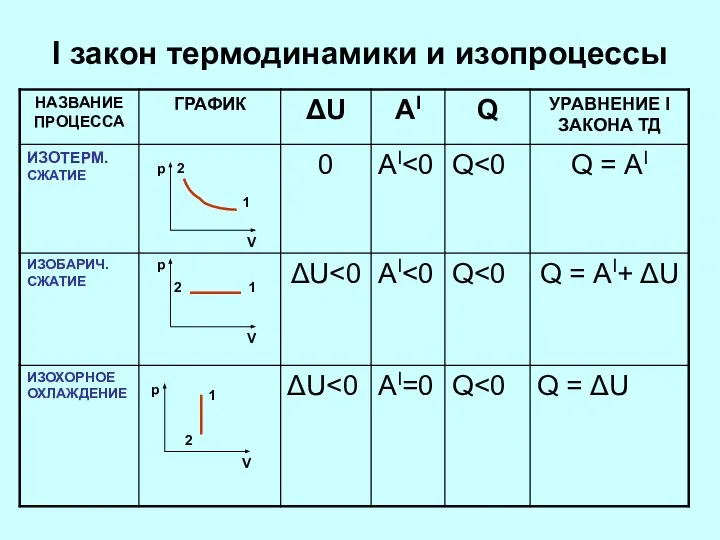
- 7. I закон термодинамики и изопроцессы
- 8. Адиабатный процесс – это модель термодинамического процесса, происходящего в системе без теплообмена с окружающей средой. Линия
- 9. I закон термодинамики и изопроцессы V р 1 2 ИЗОТЕРМА АДИАБАТА V р 2 1
- 10. ВТОРОЕ НАЧАЛО ТЕРМОДИНАМИКИ
- 11. НЕОБРАТИМОСТЬ ТЕПЛОВЫХ ПРОЦЕССОВ ЗАКОН СОХРАНЕНИЯ ЭНЕРГИИ УТВЕРЖДАЕТ, ЧТО КОЛИЧЕСТВО ЭНЕРГИИ ПРИ ЛЮБЫХ ЕЕ ПРЕВРАЩЕНИЯХ ОСТАЕТСЯ НЕИЗМЕННЫМ.
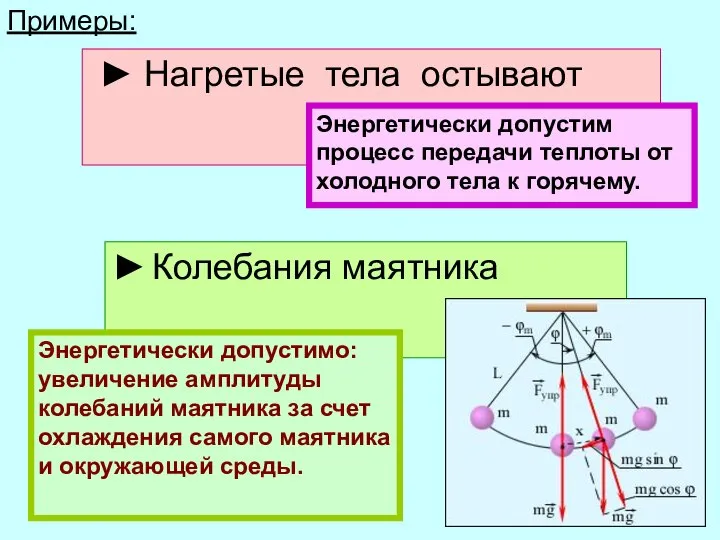
- 12. Примеры: ► Нагретые тела остывают ► Колебания маятника Энергетически допустимо: увеличение амплитуды колебаний маятника за счет
- 13. НЕОБРАТИМЫМ называется процесс, обратный которому может протекать только как одно из звеньев более сложного процесса. Передача
- 14. ИЛЛЮСТРАЦИЯ НЕОБРАТИМОСТИ ЯВЛЕНИЙ В ПРИРОДЕ ПРОСМОТР КИНОФИЛЬМА В ОБРАТНОМ НАПРАВЛЕНИИИ «ПАДЕНИЕ ХРУСТАЛЬНОЙ ВАЗЫ СО СТОЛА» Соединение
- 15. ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ Указывает направление возможных энергетических превращений, выражая необратимость процессов в природе Установлен путем обобщения
- 16. ФОРМУЛИРОВКА КЛАУЗИУСА Невозможно перевести тепло от более холодной системы к более горячей при отсутствии одновременных изменений
- 17. ФОРМУЛИРОВКА КЕЛЬВИНА 1851 г Невозможно осуществить такой периодический процесс, единственным результатом которого было бы получение работы
- 18. Самопроизвольные процессы в изолированной системе всегда происходят направлении перехода от маловероятного состояния в более вероятное
- 19. КЛАУЗИУС (Clausius) Рудольф Юлиус Эмануэль ( 1822 - 1888), немецкий физик, один из основателей термодинамики и
- 20. ТОМСОН Уильям (1824-1907) (с 1892 за научные заслуги получил титул лорда КЕЛЬВИНа - Kelvin) английский физик,
- 21. На основании любой из формулировок второго закона термодинамики могут быть доказаны следующие утверждения, которые называются теоремами
- 22. Любой участок цикла Карно и весь цикл в целом может быть пройден в обоих направлениях. Обход
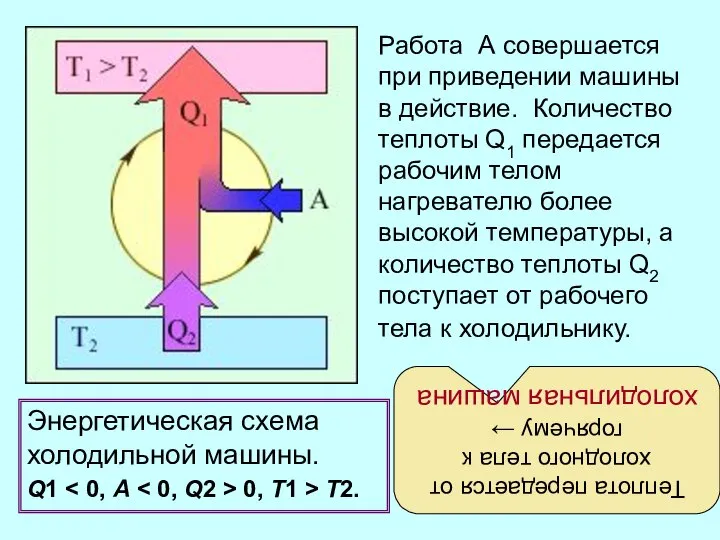
- 23. Энергетическая схема холодильной машины. Q1 0, T1 > T2. Работа А совершается при приведении машины в
- 24. Если полезным эффектом является отбор некоторого количества тепла |Q2| от охлаждаемых тел (например, от продуктов в
- 25. Если полезным эффектом является передача некоторого количества тепла |Q1| нагреваемым телам (например, воздуху в помещении), то
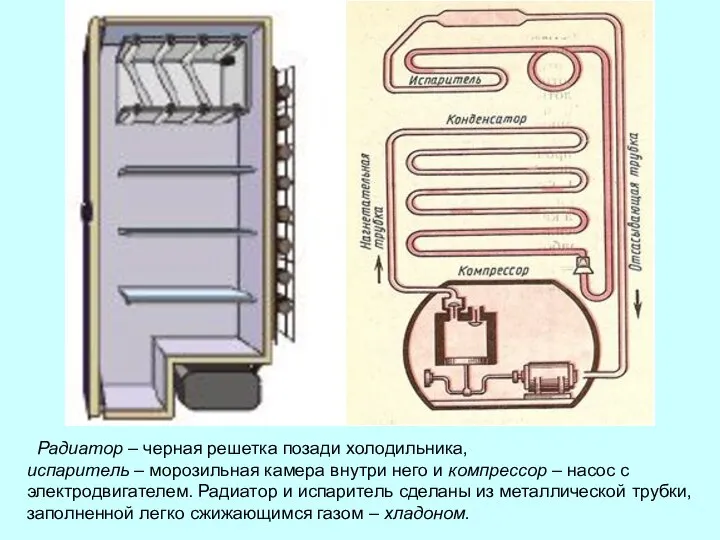
- 26. Радиатор – черная решетка позади холодильника, испаритель – морозильная камера внутри него и компрессор – насос
- 28. Скачать презентацию



















 Гидродинамика. Полная диаграмма циркуляции воды в трубе
Гидродинамика. Полная диаграмма циркуляции воды в трубе ВКР: Технологический процесс изготовления гребного винта
ВКР: Технологический процесс изготовления гребного винта Законы Ньютона
Законы Ньютона Презентация по физике "Виды движения" - скачать
Презентация по физике "Виды движения" - скачать  Презентация по физике "Способы теплопередачи" - скачать
Презентация по физике "Способы теплопередачи" - скачать  Термодинамика
Термодинамика Лекция №21. Опыты холостого хода и короткого замыкания. Потери и КПД трансформатора. Регулирование напряжения трансформатора
Лекция №21. Опыты холостого хода и короткого замыкания. Потери и КПД трансформатора. Регулирование напряжения трансформатора Нанотехнологии. Лекция 7. Классификация способов получения наноматериалов
Нанотехнологии. Лекция 7. Классификация способов получения наноматериалов Fluorescence lyman-alpha stratospheric hygrometer (flash): application on meteorological balloons, long duration balloons
Fluorescence lyman-alpha stratospheric hygrometer (flash): application on meteorological balloons, long duration balloons Нове застосування лінз Нове застосування лінз
Нове застосування лінз Нове застосування лінз 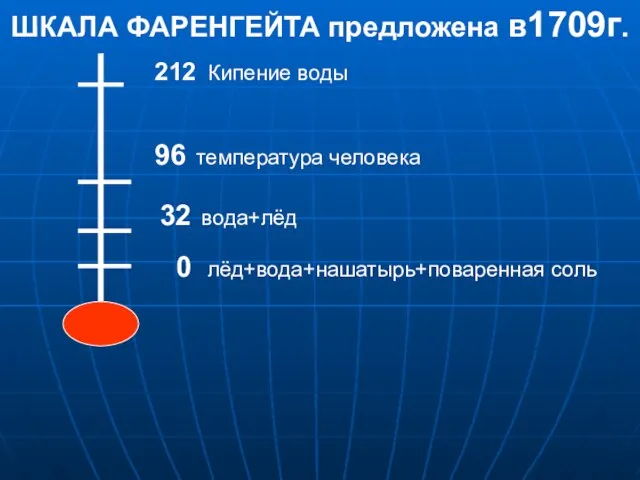 Презентация по физике "Шкала Фаренгейта предложена в 1709г" - скачать
Презентация по физике "Шкала Фаренгейта предложена в 1709г" - скачать  Сила Ампера і сила Лоренца
Сила Ампера і сила Лоренца Агрегатное состояние вещества
Агрегатное состояние вещества Архитектурная акустика Лекция №2
Архитектурная акустика Лекция №2  Краткая история развития радиосвязи
Краткая история развития радиосвязи Классификация магнитных материалов и их применение в микро- и наноэлектронике. (Лекция 13)
Классификация магнитных материалов и их применение в микро- и наноэлектронике. (Лекция 13) Лабораторные работы по физике. 7 класс
Лабораторные работы по физике. 7 класс Импульс. Закон сохранения импульса. Энергия. Закон сохранения механической энергии
Импульс. Закон сохранения импульса. Энергия. Закон сохранения механической энергии ТЕПЛОМАССОПЕРЕНОС В ЯДЕРНО-ЭНЕРГЕТИЧЕСКИХ УСТАНОВКАХ
ТЕПЛОМАССОПЕРЕНОС В ЯДЕРНО-ЭНЕРГЕТИЧЕСКИХ УСТАНОВКАХ  Напівпровідникові прилади та їх застосування
Напівпровідникові прилади та їх застосування Теория автоматического управления
Теория автоматического управления Надпровідність
Надпровідність Брейн-ринг «Юные знатоки физики»
Брейн-ринг «Юные знатоки физики» Прямой метод решения уравнений в матричной форме. Организация итерационного процесса. Проблема сходимости численных схем
Прямой метод решения уравнений в матричной форме. Организация итерационного процесса. Проблема сходимости численных схем Презентация по физике "Действие магнитного поля" - скачать
Презентация по физике "Действие магнитного поля" - скачать  Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей. Проводники и диэлектрики
Электрическое поле. Напряженность электрического поля. Принцип суперпозиции полей. Проводники и диэлектрики Факторы возникновения световой волны. Фотометрические величины и единицы их измерения
Факторы возникновения световой волны. Фотометрические величины и единицы их измерения Вибрации и колебания
Вибрации и колебания