Содержание
- 2. Размеры молекул малы по сравнению с расстояниями между ними Силы взаимодействия проявляются только в момент соударений.
- 3. Реальный газ можно считать идеальным, если он сильно разрежен и хорошо нагрет
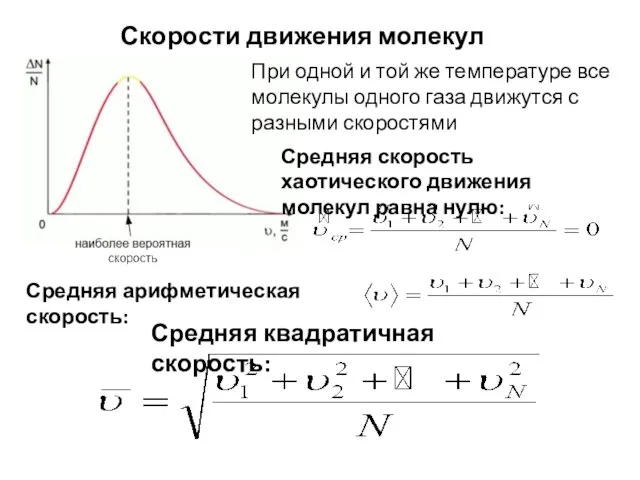
- 4. Скорости движения молекул При одной и той же температуре все молекулы одного газа движутся с разными
- 5. Микропараметры (характеризуют одну молекулу) Макропараметры (можно измерить приборами)
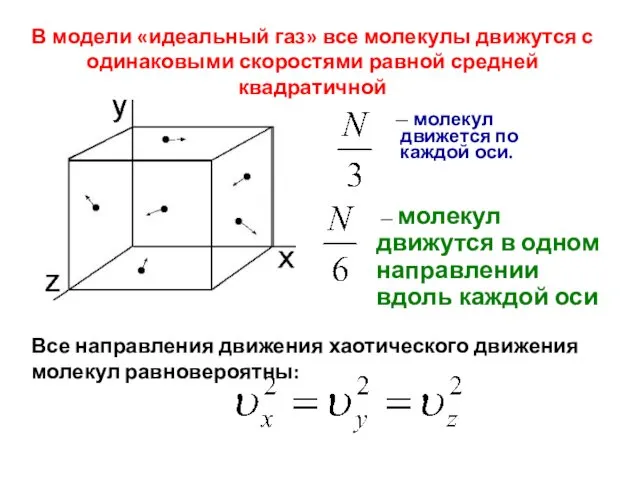
- 6. В модели «идеальный газ» все молекулы движутся с одинаковыми скоростями равной средней квадратичной — молекул движется
- 7. Давление газа создается ударами молекул малые силы отдельных ударов складываются в постоянную силу давления
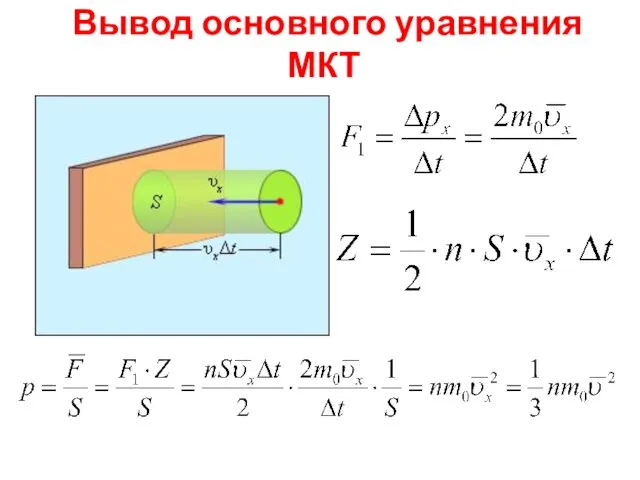
- 8. Основное уравнение МКТ -связывает микро и макро параметры
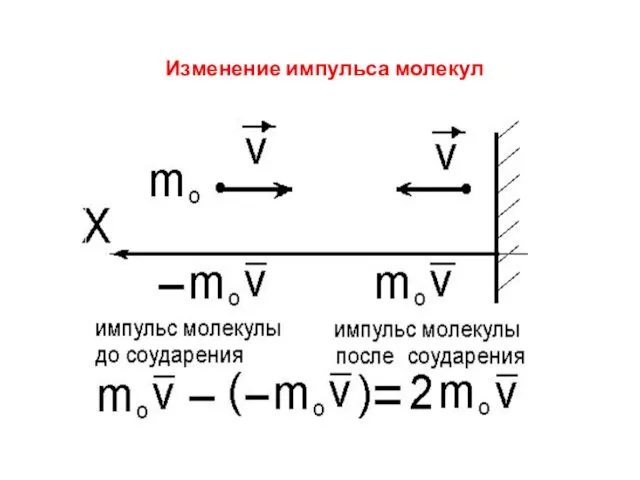
- 9. Изменение импульса молекул
- 11. Вывод основного уравнения МКТ
- 12. Основное уравнение МКТ
- 14. Тепловым равновесием называют такое состояние, при котором все макроскопические параметры сколь угодно долго остаются неизменными. Температура
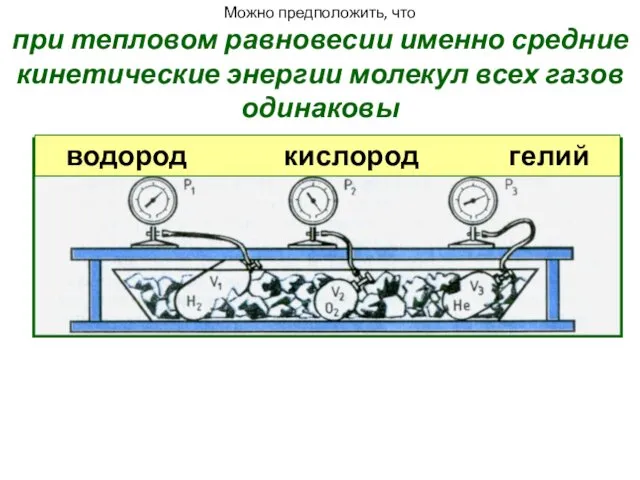
- 15. Можно предположить, что при тепловом равновесии именно средние кинетические энергии молекул всех газов одинаковы водород кислород
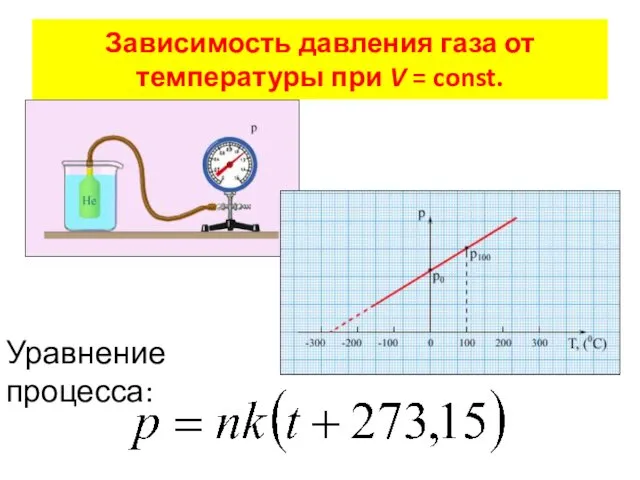
- 16. Зависимость давления газа от температуры при V = const. Уравнение процесса:
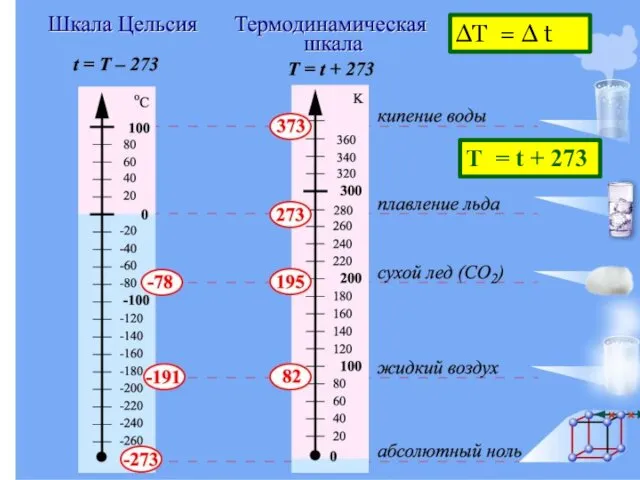
- 17. ШКАЛА КЕЛЬВИНА Английский физик У. Кельвин в 1848 г. предложил использовать точку нулевого давления газа для
- 19. Температура – мера средней кинетической энергии молекул За абсолютный ноль принимают температуру при которой прекращается поступательное
- 20. ΔТ = Δ t Т = t + 273
- 21. - температура в энергетических единицах Т - абсолютная температура [K] k - постоянная Больцмана, связывает температуру
- 22. При одной и той же температуре средние кинетические энергии движения молекул всех газов равны
- 23. Универсальная газовая постоянная
- 24. Нормальные условия р0 = 100 кПа = 105 Па Т0 = 273 К
- 25. 1. При одинаковых давлениях и температурах концентрация молекул у всех газов одинакова 2. Для смеси газов
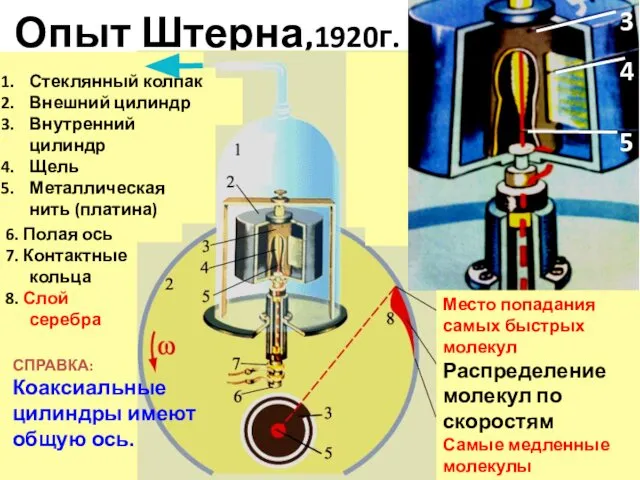
- 26. Принцип опыта по определению скоростей молекул Молекул много, они очень малы. Следовательно, мишень не должна быстро
- 27. Опыт Штерна,1920г. Место попадания самых быстрых молекул Распределение молекул по скоростям Самые медленные молекулы Стеклянный колпак
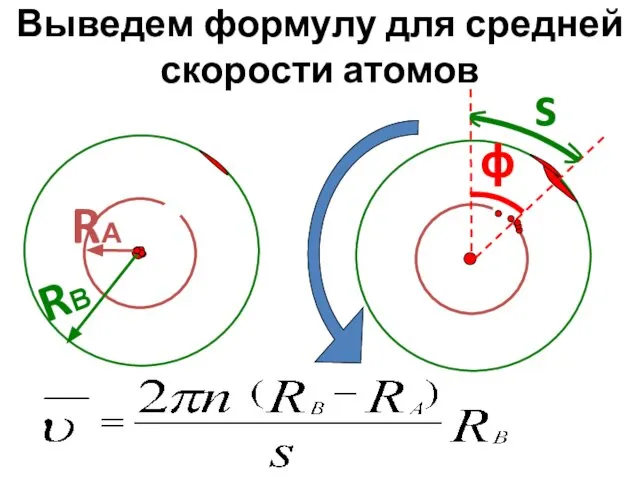
- 28. Выведем формулу для средней скорости атомов RВ RА ϕ s
- 30. Скачать презентацию












![- температура в энергетических единицах Т - абсолютная температура [K] k](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/471704/slide-20.jpg)





 Корпускулярные свойства рентгеновского излучения
Корпускулярные свойства рентгеновского излучения Внимательно изучите условие задачи, поймите физическую сущность явлений и процессов, рассматриваемых в задаче, уясните основной в
Внимательно изучите условие задачи, поймите физическую сущность явлений и процессов, рассматриваемых в задаче, уясните основной в Скалярное поле. Поверхности и линии уровня. Градиент скалярного поля. Лекция 30
Скалярное поле. Поверхности и линии уровня. Градиент скалярного поля. Лекция 30 Голограмма – чудо современной оптики
Голограмма – чудо современной оптики Колебания. Общие понятия
Колебания. Общие понятия Экспериментальные методы регистрации ионизирующих излучений 11 класс Подготовили: Гаськова М. Яремич В. учитель
Экспериментальные методы регистрации ионизирующих излучений 11 класс Подготовили: Гаськова М. Яремич В. учитель Простые механизмы. Рычаг. Равновесие сил на рычаге
Простые механизмы. Рычаг. Равновесие сил на рычаге Курс лекций. Электрический привод
Курс лекций. Электрический привод Тема 3. Движение квазичастиц электронов в электрическом поле
Тема 3. Движение квазичастиц электронов в электрическом поле Расчет на выносливость по контактным напряжениям
Расчет на выносливость по контактным напряжениям Способы установки и закрепления заготовок при обработке
Способы установки и закрепления заготовок при обработке Кинематика вращательного движения твёрдого тела
Кинематика вращательного движения твёрдого тела Презентация по физике на тему: «Двигатель внутреннего сгорания»
Презентация по физике на тему: «Двигатель внутреннего сгорания»  Презентация по физике "Электроизмерительные приборы" - скачать
Презентация по физике "Электроизмерительные приборы" - скачать  Становление механики © В.Е. Фрадкин, СПб АППО, 2006
Становление механики © В.Е. Фрадкин, СПб АППО, 2006 Тема: Решение задач по теме: «Давление твердых тел , жидкостей и газов»
Тема: Решение задач по теме: «Давление твердых тел , жидкостей и газов» Разряд в неоднородном электрическом поле. Корона. Сценарии разрядных процессов в коаксиале. (Лекция 3)
Разряд в неоднородном электрическом поле. Корона. Сценарии разрядных процессов в коаксиале. (Лекция 3) Кинематический анализ
Кинематический анализ Векторлар өрісінің циркуляциясы, роторы
Векторлар өрісінің циркуляциясы, роторы Принцип плавания судов
Принцип плавания судов Физика на кухне
Физика на кухне Теоретическая прочность в сравнении с реальной. Дислокации и дисклинации. Лекция 1
Теоретическая прочность в сравнении с реальной. Дислокации и дисклинации. Лекция 1 Системы, элементы, сигналы Составила Антонова Е.П. 2010г.
Системы, элементы, сигналы Составила Антонова Е.П. 2010г. Квалификационный экзамен по ПМ 04 Слесарь по ремонту дорожно-строительных машин и тракторов
Квалификационный экзамен по ПМ 04 Слесарь по ремонту дорожно-строительных машин и тракторов Изоляторы ЛЭП. Линейные изоляторы
Изоляторы ЛЭП. Линейные изоляторы Электричество. Электростатика
Электричество. Электростатика Термодинамика. Тепловая машина. (Лекция 7)
Термодинамика. Тепловая машина. (Лекция 7) Введение в физику. Механика
Введение в физику. Механика