Содержание
- 2. План: Титрование сильной кислоты сильным основанием (или наоборот). Кривая титрования слабой одноосновной кислоты. сильным основанием. Кривая
- 3. HCl + NaOH ↔ NаCl + H2O Исходный раствор: [H+] = [HCl] = 1.10-1 рН= -lg[HCl]
- 4. Кривая титрования 0,1 М раствора HCl 0,1 М раствором NaOH
- 5. Кривая титрования раствора HCl раствором NaOH: 1 – 1 М растворы, 2 – 0,1 М растворы,
- 6. Температура раствора С повышением температуры увеличивается ионное произведение воды (при 25°С Кw=1,00∙10-14; при 100°С Кw=55,00∙10-14), сужается
- 7. Силы титруемой кислоты или основания (Ка, Кb) Можно оттитровать вещества, у которых Ка, Кb ≥ 5·10-8
- 8. СH3COOH + NaOH ↔ СH3COONa + H2O СH3COOH + OH- ↔ СH3COO- + H2O Kа (СH3COOH)
- 9. Точка начала скачка титрования. Раствор недотитрован на 0,1%: Точка эквивалентности: pН = 7 + ½ рКа
- 10. Точка конца скачка титрования. Раствор перетитрован на 0,1% рН = –lg[H+] = –lg10-10 = 10,0
- 11. Кривая титрования 0,1 М раствора CH3COOH 0,1 М раствором NaOH
- 12. NH3·H2O + HCl ↔ NH4Cl + H2O NH3·H2O + H+ ↔ NH4+ + H2O Кb (NH3)
- 13. Точка полунейтрализации (оттитровано 50% NH3·H2O): Точка начала скачка титрования (оттитровано 99,9% NH3·H2O): Точка эквивалентности (оттитровано 100%
- 14. Точка конца скачка титрования (перетитровано на 0,1 %): рН = –lg[H+] = –lg10-4 = 4
- 15. Кривая титрования 0,1 М раствора NH4OH 0,1 М раствором HCl
- 16. Н3РО4 + ОН- ↔ Н2РО4- + Н2О Н2РО4- + ОН- ↔ НРО42- + Н2О НРО42- +
- 17. Константы титрования рКт1 = рКа2 – рКа1 = 7,21 – 2,15 = 5,06 рКт2 =рКа3 –
- 18. рH1 = ½(рКа1 + рКа2) = ½(2,15 + 7,21) = 4,68 fэ(Н3РО4) = 1 рН2 =
- 19. Кривая титрования 0,1 М раствора H3PO4 0,1 М раствором NaOH
- 20. Для щавелевой кислоты Ка1=5,6.10-2 (рКа1 = 1,25), Ка2=5,4.10-5 (рКа2 = 4,27). рКт1 = 4,27-1,25 = 3,02
- 21. H2CO3 ↔ HCO3- + H+ Ка1 = 4,5∙10-7 рКа1 = 6,35 HCO3- ↔ CO32- + Н+
- 22. Na2CO3 + HCl ↔ NaHCO3 + NaCl NaHCO3 + HCl ↔ H2CO3 + NaCl
- 23. pH = 7 + ½ pKa2 + ½ lgCb= 7 + ½.10,32 + ½ lg0,1 =
- 24. При титровании Na2СO3 с метиловым оранжевым fэ(Na2CO3) = ½, при титровании с фенолфталеином fэ(Na2CO3) = 1.
- 26. Скачать презентацию

![HCl + NaOH ↔ NаCl + H2O Исходный раствор: [H+] =](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/645467/slide-2.jpg)






![Точка конца скачка титрования. Раствор перетитрован на 0,1% рН = –lg[H+] = –lg10-10 = 10,0](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/645467/slide-9.jpg)



![Точка конца скачка титрования (перетитровано на 0,1 %): рН = –lg[H+] = –lg10-4 = 4](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/645467/slide-13.jpg)










 Рентгеновское излучение и его использование в медицине. (Лекция 14)
Рентгеновское излучение и его использование в медицине. (Лекция 14) Эффект Зеемана. Эффект Штарка. Электронный парамагнитный резонанс (ЭПР)
Эффект Зеемана. Эффект Штарка. Электронный парамагнитный резонанс (ЭПР) ОСНОВЫ МКТ ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (молекулярная физика)
ОСНОВЫ МКТ ОСНОВНЫЕ ПОЛОЖЕНИЯ МКТ (молекулярная физика) Редукторы. Общие сведения. Назначение редукторов. Основные типы редукторов. Ремонт редуктора
Редукторы. Общие сведения. Назначение редукторов. Основные типы редукторов. Ремонт редуктора Електричний заряд. Електричне поле. Закон Кулона
Електричний заряд. Електричне поле. Закон Кулона Процесс газообмена в ДВС
Процесс газообмена в ДВС Ких-фильтры с линейной фчх
Ких-фильтры с линейной фчх Симметричный вибратор. Антенно-фидерные устройства и распространение радиоволн. Лекция № 4
Симметричный вибратор. Антенно-фидерные устройства и распространение радиоволн. Лекция № 4 Линзы. Оптическая сила линзы
Линзы. Оптическая сила линзы Основные уравнения классической динамики
Основные уравнения классической динамики Лекция 2. Тепловой баланс помещения. Тепловая мощность системы отопления
Лекция 2. Тепловой баланс помещения. Тепловая мощность системы отопления ЕГЭ ФИЗИКА
ЕГЭ ФИЗИКА Энергия & Люди
Энергия & Люди Топливно-энергетические ресурсы
Топливно-энергетические ресурсы Датчики – элемент измерительного, сигнального, регулирующего или управляющего устройства
Датчики – элемент измерительного, сигнального, регулирующего или управляющего устройства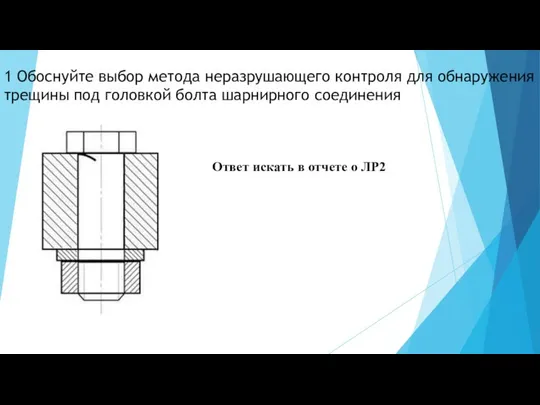 Методы неразрушающего контроля
Методы неразрушающего контроля Молекулярная физика и термодинамика
Молекулярная физика и термодинамика Измерения температуры
Измерения температуры Кузова
Кузова Векрорные диаграммы
Векрорные диаграммы Электричество и магнетизм
Электричество и магнетизм Нильс Хенрик Давид Бор
Нильс Хенрик Давид Бор Состав атомных ядер. Ядерная физика
Состав атомных ядер. Ядерная физика Строительная акустика. Санитарно-гигиеническая вредность шума
Строительная акустика. Санитарно-гигиеническая вредность шума Презентация по физике "Испарение Конденсация" - скачать
Презентация по физике "Испарение Конденсация" - скачать  Розвиток фізики як науки
Розвиток фізики як науки Мультиплексная (MPX) система передачи данных: электронные блоки управления
Мультиплексная (MPX) система передачи данных: электронные блоки управления Лекция 15. Тема: Закон Био-Савара - Лапласа
Лекция 15. Тема: Закон Био-Савара - Лапласа