Содержание
- 2. Основы методов Молекулярно-абсорбционная спектроскопия в УФ- и видимой областях основана на избирательном поглощении веществами излучения. Поглощение
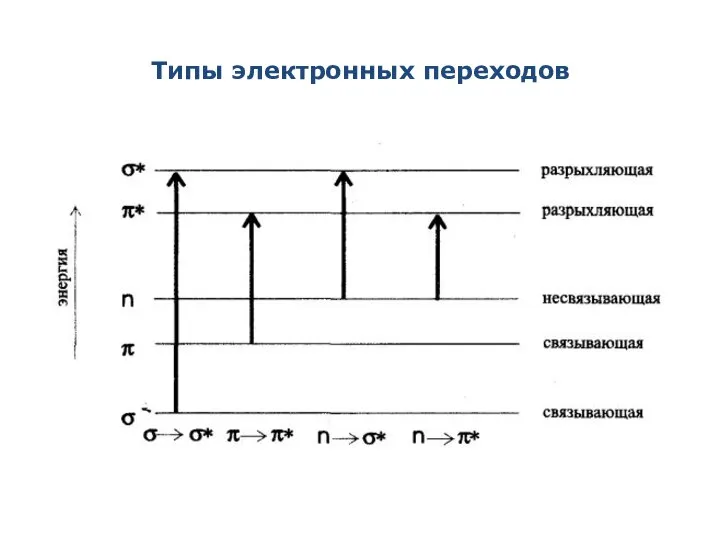
- 3. Типы электронных переходов
- 4. Типы электронных переходов σ→σ*-переходы - связаны с самыми большими изменениями энергии. Наблюдаются в вакуумной УФ- области
- 5. π → π * - переходы - требуют еще меньшей энергии, полосы поглощения, соответствующие этим переходам,
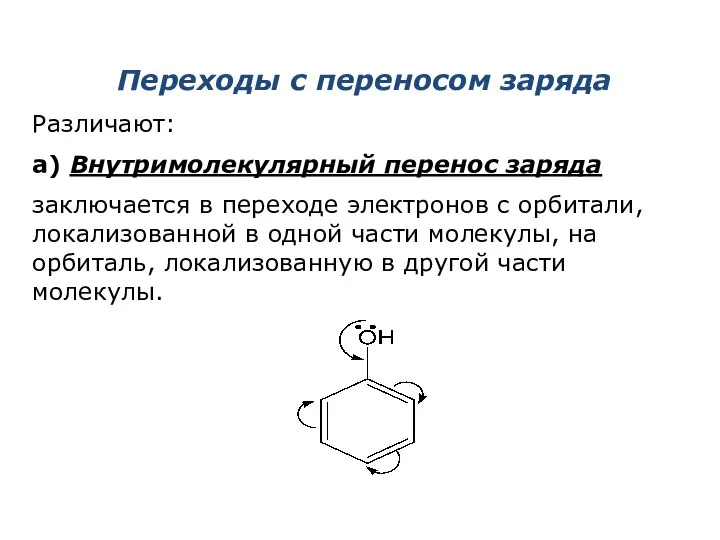
- 6. Переходы с переносом заряда Различают: а) Внутримолекулярный перенос заряда заключается в переходе электронов с орбитали, локализованной
- 7. Переходы с переносом заряда б) Комплекс с переносом заряда Две частицы (молекулы или ионы) образуют новую
- 8. Фотоэлектроколориметрия
- 9. Основы метода Фотоэлектроколориметрия основана на избирательном поглощении немонохроматического излучения в видимой области спектра, приводящее к изменению
- 10. Схема фотоэлектроколориметра (с однолучевой системой освещения)
- 11. Условия проведения фотоэлектроколориметрического анализа Проведение фотометрической реакции. В видимой области поглощают только окрашенные вещества. Фотометрическая реакция
- 12. Требования к фотометрическим реакциям Чувствительность- реакция считается чувствительной, если величина молярного коэффициента поглощения образующегося окрашенного соединения
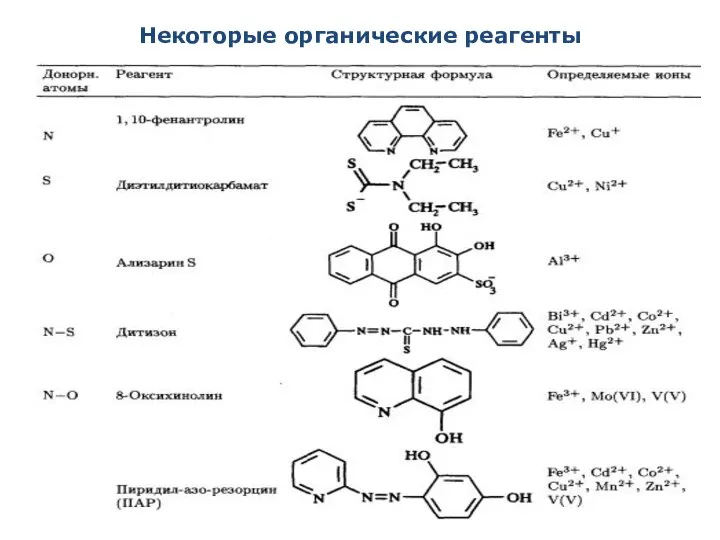
- 13. Некоторые органические реагенты
- 14. Фотометрические реакции Экстракционная фотометрия – гибридный метод анализа, в котором после проведения фотометрической реакции, образующийся ее
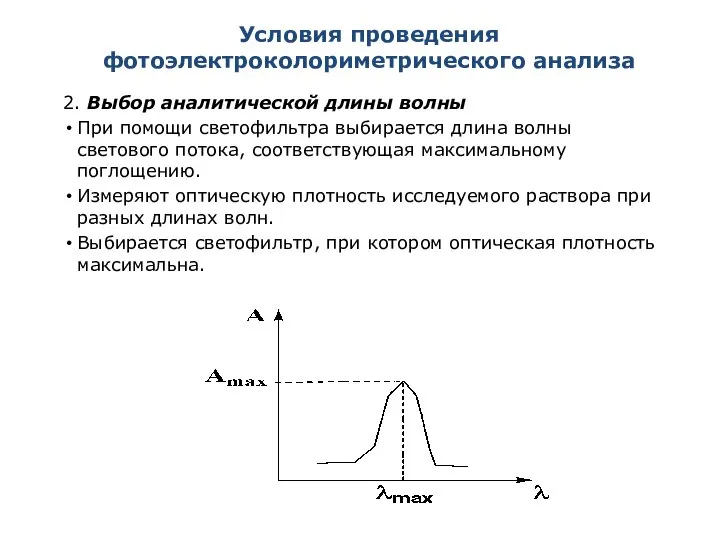
- 15. Условия проведения фотоэлектроколориметрического анализа 2. Выбор аналитической длины волны При помощи светофильтра выбирается длина волны светового
- 16. Условия проведения фотоэлектроколориметрического анализа 3. Диапазон концентраций анализируемых растворов Оптимальный диапазон оптических плотностей в фотоэлектроколориметрии 0.12
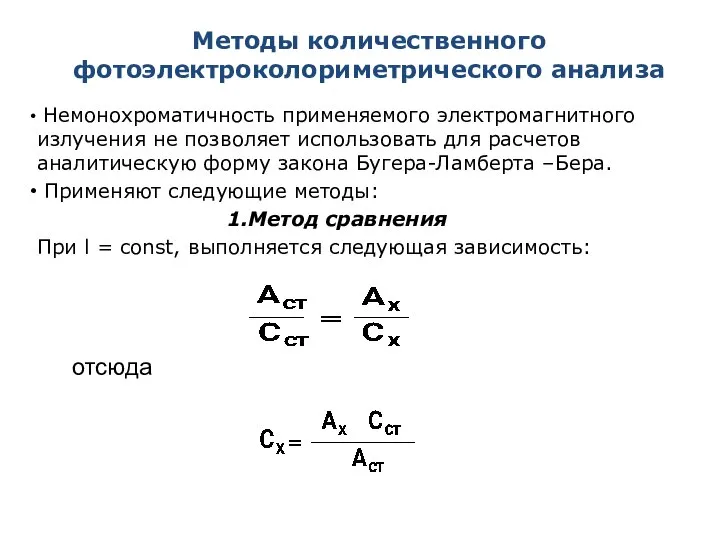
- 17. Методы количественного фотоэлектроколориметрического анализа Немонохроматичность применяемого электромагнитного излучения не позволяет использовать для расчетов аналитическую форму закона
- 18. Методы количественного фотоэлектроколориметрического анализа 2. Метод градуировочного графика Готовят серию стандартных растворов анализируемого вещества, охватывающую область
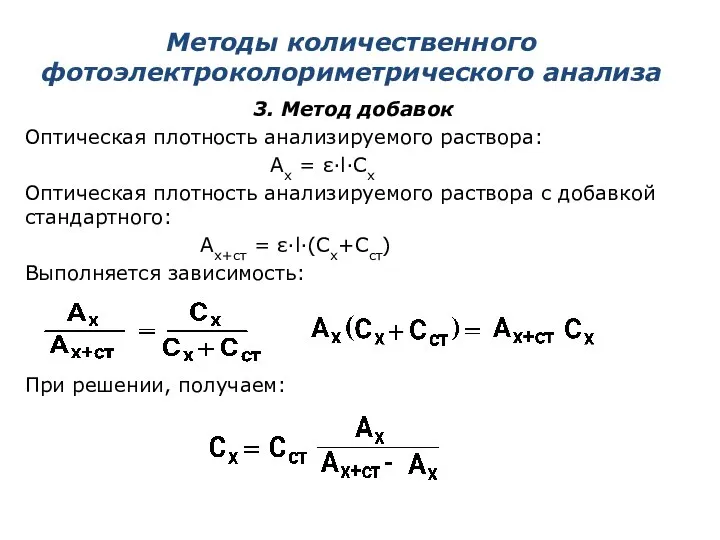
- 19. Методы количественного фотоэлектроколориметрического анализа 3. Метод добавок Оптическая плотность анализируемого раствора: Ax = ε·l·Cx Оптическая плотность
- 20. УФ – СПЕКТРОСКОПИЯ (СПЕКТРОФОТОМЕТРИЯ В УФ – И ВИДИМОЙ ОБЛАСТИ)
- 22. Схема спектрофотометра
- 23. Спектофотометрические определения Определения содержания веществ можно проводить непосредственно, а также с использованием специальных фотометрических реагентов. Определения
- 24. Методы количественного спектрофотометрического анализа Метод сравнения. Метод градуировочного графика. Метод добавок. Метод молярного (удельного) коэффициента поглощения
- 25. Дифференциальная фотометрия Метод отношения пропусканий В качестве раствора сравнения используют раствор известной концентрации С0 (причем, С0
- 26. Дифференциальная фотометрия 2. Метод анализа следов Используют при анализе растворов с низкой оптической плотностью. Границы оптической
- 27. Многоволновая спектрофотометрия (метод Фирордта) Метод применяют для анализа растворов, содержащих несколько светопоглощающих частиц. Основой метода является
- 28. Производная спектрофотометрия Аналитическим сигналом является производная оптической плотности n-порядка. А- электронный спектр; Б –его первая производная;
- 29. Фотометрическое титрование Титриметрические методы анализа, где конечную точку титрования обнаруживают по изменению оптической плотности раствора. 1-
- 30. Применение спектроскопии в УФ- и видимой областях в фармацевтическом анализе. Оценка подлинности лекарственных веществ Идентификация на
- 31. Применение спектроскопии в УФ- и видимой областях в фармацевтическом анализе. Идентификация на основании коэффициента поглощения Например,
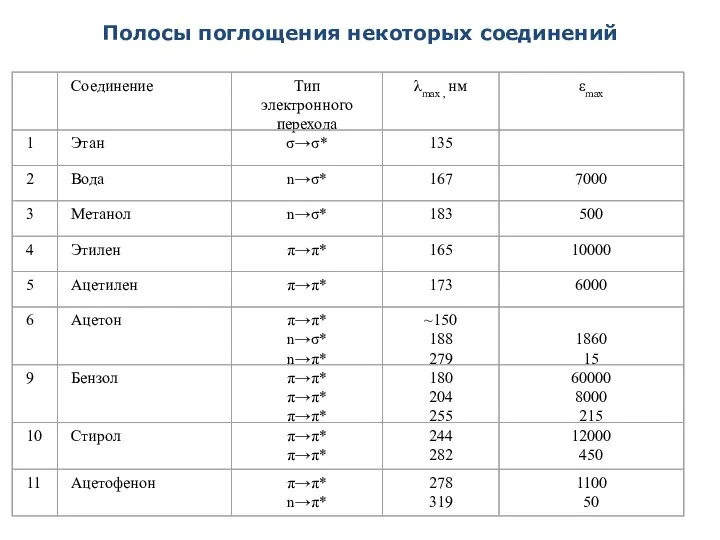
- 32. Связь УФ – спектров со строением органических соединений Хромофоры – это структурные группы, содержащие изолированные и
- 33. Полосы поглощения некоторых соединений
- 34. Основные понятия Ауксохромы - электронодонорные заместители, (−ОН, −ОR, −NН2 -NHR, галогены). Батохромный сдвиг (или красный сдвиг)
- 35. Качественный анализ на основе электронных спектров 1. Идентификация органических соединений Осуществляется сравнением спектра исследуемого соединения со
- 36. Качественный анализ на основе электронных спектров 2. Изучение пространственного строения С помощью электронной спектроскопии можно различить
- 37. Качественный анализ на основе электронных спектров В сопряжённых системах, содержащих объёмные заместители, может происходить нарушение сопряжения.
- 38. Качественный анализ на основе электронных спектров 3. Изучение кинетики и контроль за ходом реакции Осуществляется в
- 39. Качественный анализ на основе электронных спектров 4. Исследование равновесий в растворах Используется при изучении таутомерных превращений,
- 40. Электронные спектры поглощения отдельных классов органических соединений АЛКАНЫ В алканах возможны только σ→σ* электронные переходы. Эти
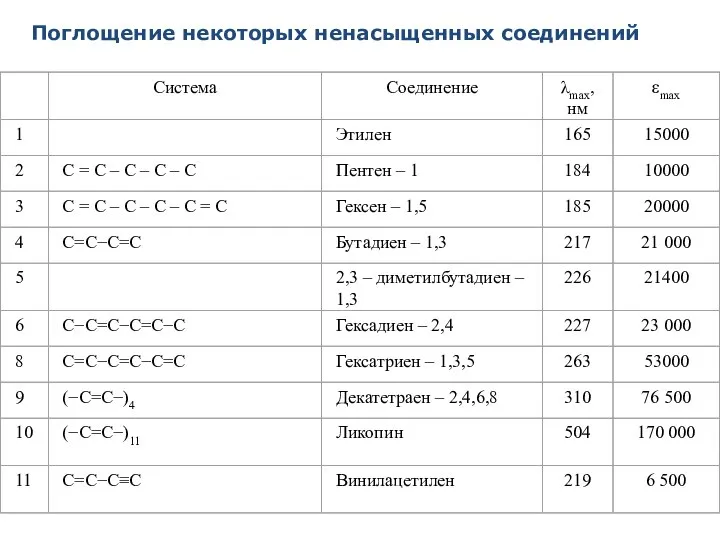
- 41. АЛКЕНЫ Изолированные двойные углерод-углеродные связи имеют интенсивную полосу поглощения, обусловленную π→π* переходом, в области 165 –
- 42. Поглощение некоторых ненасыщенных соединений
- 43. АЛКИНЫ Для ацетиленовых углеводородов с изолированной С≡С связью наблюдается полоса поглощения π→π* перехода. Ацетилен λmax =
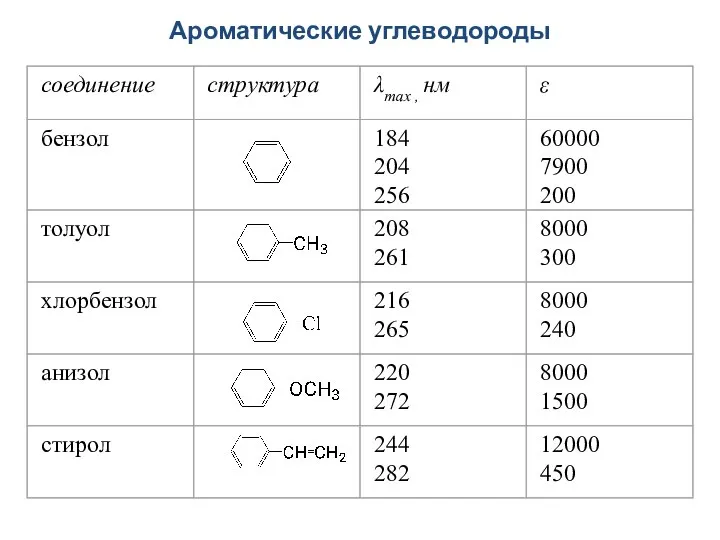
- 44. Ароматические углеводороды
- 47. Альдегиды, кетоны Насыщенные и несопряжённые альдегиды и кетоны имеют в УФ-спектре малоинтенсивную полосу поглощения λmax 270–290
- 48. В сопряжённых карбонильных соединениях происходит батохромное смещение полос поглощения.
- 49. Карбоновые кислоты Алифатические карбоновые кислоты и их функциональные производные имеют слабые полосы поглощения в области 204–235
- 51. Скачать презентацию







































 СТАЛЬНЫЕ КОЛОННЫ
СТАЛЬНЫЕ КОЛОННЫ  Трансформаторы тока
Трансформаторы тока Презентация по физике "Строение ядра" - скачать
Презентация по физике "Строение ядра" - скачать  Заземляющие устройства электроустановок
Заземляющие устройства электроустановок Лекция 8. Расчет статически неопределимых систем методом сил (продолжение)
Лекция 8. Расчет статически неопределимых систем методом сил (продолжение) Вечный двигатель
Вечный двигатель История проекторов
История проекторов Атомно-абсорбционная спектроскопия
Атомно-абсорбционная спектроскопия Законы постоянного тока (задачи для повторения)
Законы постоянного тока (задачи для повторения) Из истории изучения электрических явлений
Из истории изучения электрических явлений Лауреат Нобелевской премии Артур Эшкин
Лауреат Нобелевской премии Артур Эшкин Надпровідність. Перспективи та застосування. Надпровідники. Лампа, діод, транзистор. Електричний струм у металах
Надпровідність. Перспективи та застосування. Надпровідники. Лампа, діод, транзистор. Електричний струм у металах Наноматериалы и нанотехнологии. Галогенидосеребряные светочувствительные материалы
Наноматериалы и нанотехнологии. Галогенидосеребряные светочувствительные материалы Источники оптического когерентного излучения для информационных систем 13
Источники оптического когерентного излучения для информационных систем 13 Презентация по физике "Масса тела" - скачать бесплатно
Презентация по физике "Масса тела" - скачать бесплатно Измерение параметров волоконно-оптических кабелей, Рефлектограмма
Измерение параметров волоконно-оптических кабелей, Рефлектограмма Повторение курса физики. 8 класс
Повторение курса физики. 8 класс Основное электрооборудование станций и подстанций. (Лекция 2)
Основное электрооборудование станций и подстанций. (Лекция 2) Динамический расчет ферм
Динамический расчет ферм Элементы квантовой механики
Элементы квантовой механики Аналіз показників ефективності роботи суднового дизелю
Аналіз показників ефективності роботи суднового дизелю Элементы квантовой физики. Тепловое излучение
Элементы квантовой физики. Тепловое излучение Физика волн. (Лекция 12)
Физика волн. (Лекция 12) Өлшеу қателіктері
Өлшеу қателіктері Гидравлика. Закон Архимеда
Гидравлика. Закон Архимеда Презентация на тему "Электризация"
Презентация на тему "Электризация" Греет ли снег?
Греет ли снег? Дифракція світла
Дифракція світла