Содержание
- 2. Атом (от др.-греч. ἄτομος — неделимый, неразрезаемый) — частица вещества микроскопических размеров и массы, наименьшая часть
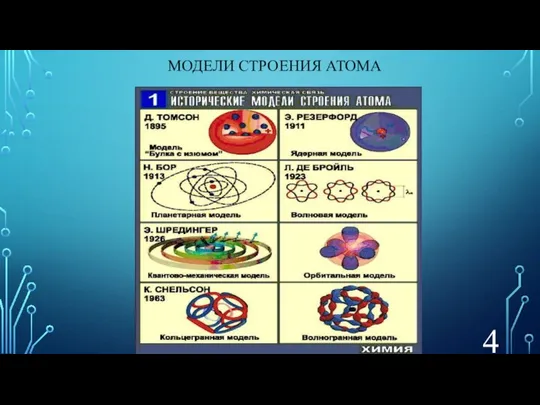
- 4. МОДЕЛИ СТРОЕНИЯ АТОМА
- 6. Согласно модели атома Бора, электрон перескакивает на более высокую орбиту при поглощении фотона и соскакивает на
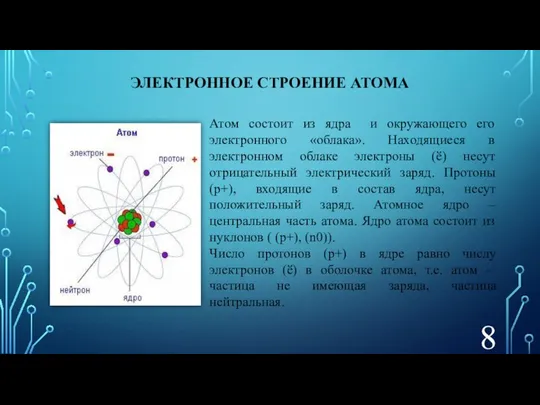
- 8. ЭЛЕКТРОННОЕ СТРОЕНИЕ АТОМА Атом состоит из ядра и окружающего его электронного «облака». Находящиеся в электронном облаке
- 9. Уровни подразделяются на подуровни (на первом уровне – 1 подуровень, на втором уровне – 2 подуровня,
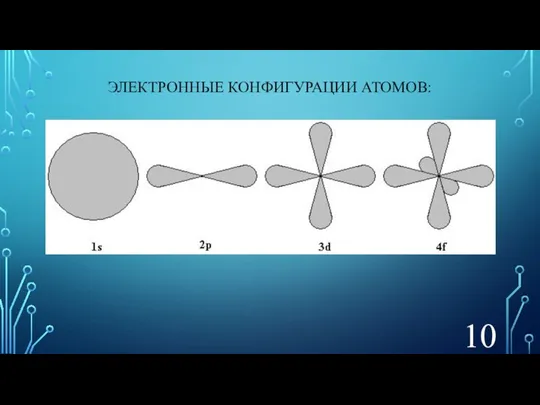
- 10. ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ АТОМОВ:
- 11. ЗАПОЛНЕНИЕ АТОМНЫХ ОРБИТАЛЕЙ: на первом энергетическом уровне максимально может быть – 2 электрона на втором энергетическом
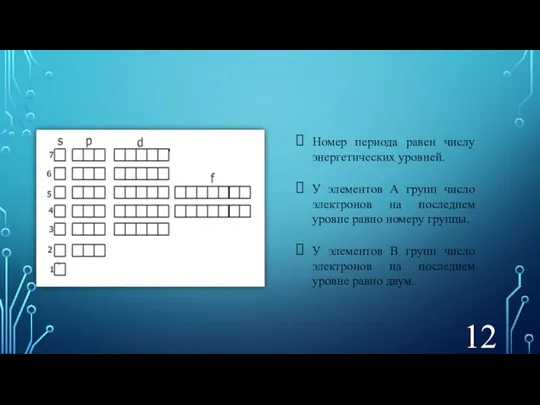
- 12. Номер периода равен числу энергетических уровней. У элементов А групп число электронов на последнем уровне равно
- 13. ПРИМЕР:
- 15. заполнение лектронных орбиталей азота
- 17. Скачать презентацию










 Динамика материальной точки
Динамика материальной точки Презентація на тему:
Презентація на тему:  Удельная теплота парообразования
Удельная теплота парообразования Методы получения изображений видимого излучения
Методы получения изображений видимого излучения Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой
Двухтактный преобразователь постоянного напряжения с трансформаторной развязкой Явление тяготения. Сила тяжести
Явление тяготения. Сила тяжести Электрическое поле. Общие сведения. Тема 1
Электрическое поле. Общие сведения. Тема 1 Биологическое воздействие радиоактивного излучения. Ученица 8 “2” класса Киевич Диана.
Биологическое воздействие радиоактивного излучения. Ученица 8 “2” класса Киевич Диана. Самоіндукція. Індуктивність. Енергія магнітного поля
Самоіндукція. Індуктивність. Енергія магнітного поля Перенапряжения в трансформаторах
Перенапряжения в трансформаторах Введение
Введение Вимірювальні перетворювачі світлового випромінювання
Вимірювальні перетворювачі світлового випромінювання Электротехника. Основные понятия и законы. (лекция 2)
Электротехника. Основные понятия и законы. (лекция 2) Сила трения. Виды трения. Способы изменения трения
Сила трения. Виды трения. Способы изменения трения Презентация по физике "«Источники электрического тока»" - скачать
Презентация по физике "«Источники электрического тока»" - скачать  Мікротрон
Мікротрон  Создание большого азимутального телескопа БТА
Создание большого азимутального телескопа БТА Презентация по физике "Ток в полупроводниках" - скачать бесплатно
Презентация по физике "Ток в полупроводниках" - скачать бесплатно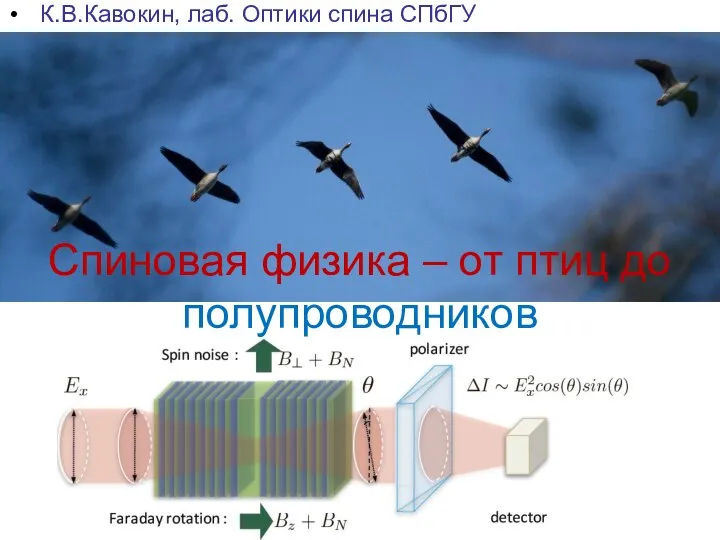 Спиновая физика – от птиц до полупроводников
Спиновая физика – от птиц до полупроводников Параметры и свойства средств измерительной техники
Параметры и свойства средств измерительной техники Первый закон термодинамики
Первый закон термодинамики Кинетическая теория газов Расстояние между молекулами вещества, находящегося в газовой фазе обычно значительно больше, чем р
Кинетическая теория газов Расстояние между молекулами вещества, находящегося в газовой фазе обычно значительно больше, чем р Газотурбинные двигатели
Газотурбинные двигатели Последовательное и параллельное соединение проводников
Последовательное и параллельное соединение проводников Кипение. Влажность воздуха. Способы определения влажности воздуха
Кипение. Влажность воздуха. Способы определения влажности воздуха Преобразователи постоянного напряжения
Преобразователи постоянного напряжения Управление частотой вращения - регулируемая планетарная передача
Управление частотой вращения - регулируемая планетарная передача Термодинамика. Фазовые переходы
Термодинамика. Фазовые переходы