Содержание
- 2. Введение Теплотехника - наука, которая изучает методы получения, преобразования, передачи и использования теплоты, а также принципы
- 3. Теоретическими разделами теплотехники являются техническая термодинамика, изучающая законы превращения теплоты и основы теплообмена, в которых исследуются
- 4. Понятие термодинамической системы Термодинамическая система преставляет собой совокупность материальных тел, находящихся в материальном и тепловом взаимодействии
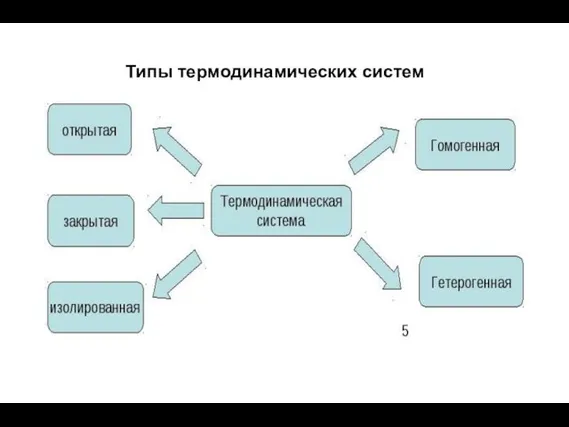
- 5. Типы термодинамических систем
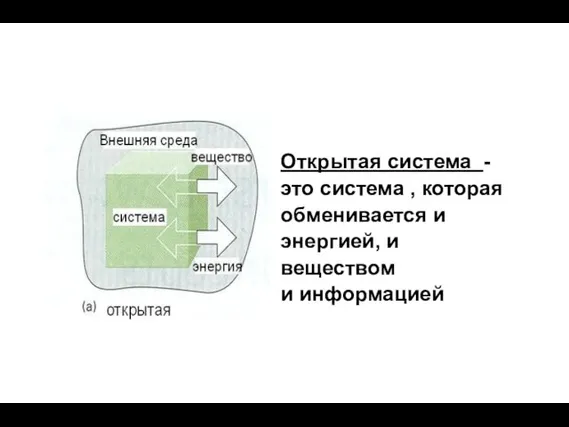
- 6. Открытая система - это система , которая обменивается и энергией, и веществом и информацией
- 7. Закрытая система - система в которой есть обмен только с энергией .
- 8. Замкнутая (изолированная) система - это система в которой нет обмена с внешними телами ни энергией ,
- 9. Однородная термодинамическая система (как по составу, так и по физическому строению), внутри которой нет поверхностей раздела,
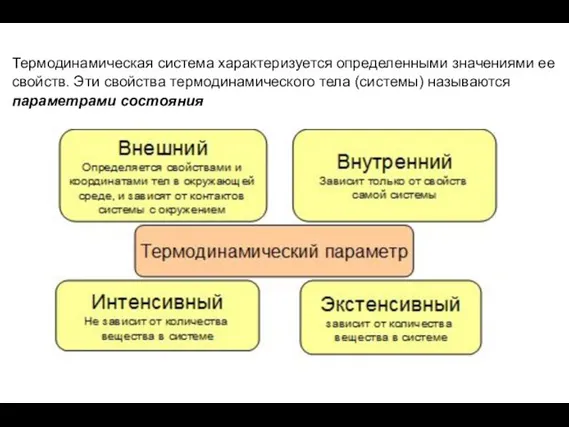
- 10. Термодинамическая система характеризуется определенными значениями ее свойств. Эти свойства термодинамического тела (системы) называются параметрами состояния
- 11. Интенсивные – которые не зависят от количества вещества и при взаимодейтсвии тел выравниваются (температура, давление и
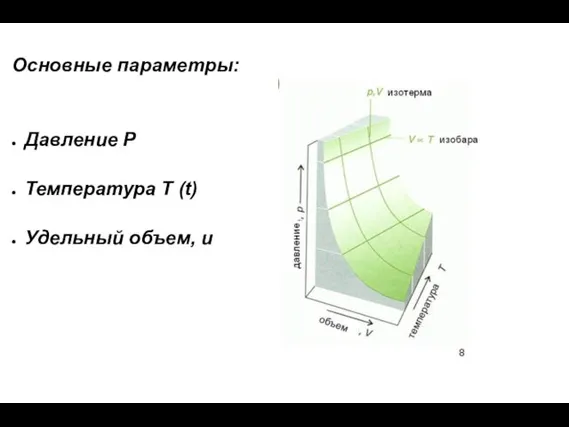
- 12. Основные параметры: Давление Р Температура Т (t) Удельный объем, u
- 13. Давление Р - сила, действующая на единицу поверхности, называется удельным давлением В системе СИ за единицу
- 15. Температура Т (t) – мера средней кинетической энергии поступательного движения молекул. Температуру измеряют по двум шкалам:
- 16. Удельный объём. Объём в 1м3, заполненный однородным телом массой в 1 кг, называют удельным объёмом. u
- 18. Для равновесной термодинамической системы существует функциональная связь между параметрами состояния, которая называется уравнением состояния. Опыт показывает,
- 19. Термодинамические процессы часто изображаются на графиках состояния, где по осям отложены параметры состояния. Точки, на плоскости
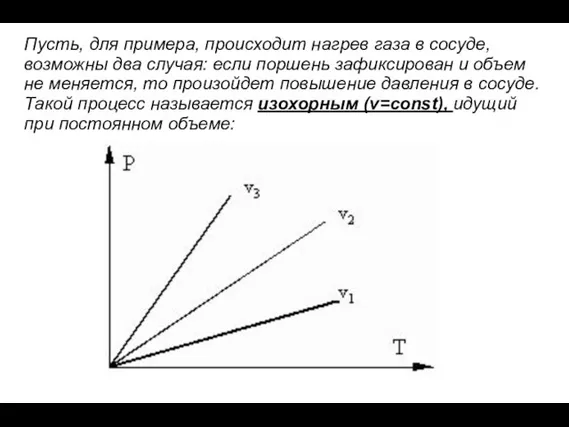
- 20. Пусть, для примера, происходит нагрев газа в сосуде, возможны два случая: если поршень зафиксирован и объем
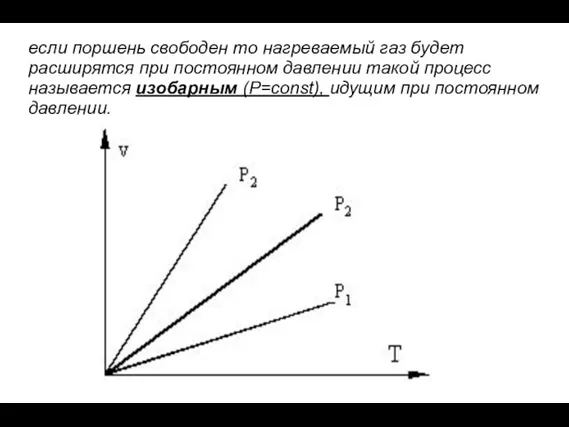
- 21. eсли поршень свободен то нагреваемый газ будет расширятся при постоянном давлении такой процесс называется изобарным (P=const),
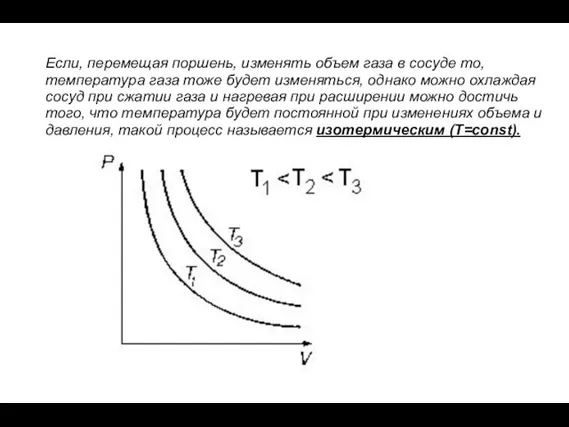
- 22. Если, перемещая поршень, изменять объем газа в сосуде то, температура газа тоже будет изменяться, однако можно
- 24. Скачать презентацию














 Потенциальная и кинетическая энергия
Потенциальная и кинетическая энергия Векрорные диаграммы
Векрорные диаграммы Принципиальные и монтажные электрические схемы (8 класс)
Принципиальные и монтажные электрические схемы (8 класс) СИЛЫ ТРЕНИЯ
СИЛЫ ТРЕНИЯ  Гидростатика. Давление в жидкости
Гидростатика. Давление в жидкости Конвертированные двигатели. Схемы турбокомпрессорной части современных авиационных ТРДД
Конвертированные двигатели. Схемы турбокомпрессорной части современных авиационных ТРДД Электромагнитное взаимодействие
Электромагнитное взаимодействие Қазақстанда ядролық сынақ жүргізу
Қазақстанда ядролық сынақ жүргізу Радиоактивность. Человек и радиация
Радиоактивность. Человек и радиация Дислокации. Механизмы размножения и движения дислокаций
Дислокации. Механизмы размножения и движения дислокаций Внутренняя энергия. Термодинамика
Внутренняя энергия. Термодинамика Спектры и спектральные аппараты
Спектры и спектральные аппараты Электроэнергетика
Электроэнергетика  Электронагревательные приборы на кухне Презентация по физике Ученицы 10 класса Елагиной М.В. МОУ КСОШ №13 Педагог: Васильева
Электронагревательные приборы на кухне Презентация по физике Ученицы 10 класса Елагиной М.В. МОУ КСОШ №13 Педагог: Васильева  Импульс тела и импульс силы
Импульс тела и импульс силы Электрический ток
Электрический ток Презентация по физике "Внутренняя энергия. Количество теплоты" - скачать
Презентация по физике "Внутренняя энергия. Количество теплоты" - скачать  Презентация по физике СИЛЫ ВСЕМИРНОГО ТЯГОТЕНИЯ Силы в механике
Презентация по физике СИЛЫ ВСЕМИРНОГО ТЯГОТЕНИЯ Силы в механике  Электрический ток
Электрический ток Коллиматор. Разновидности коллиматоров. Виды тест-объектов. Зрительная труба. Диоптрийная трубка
Коллиматор. Разновидности коллиматоров. Виды тест-объектов. Зрительная труба. Диоптрийная трубка Дыбыс тербелістері
Дыбыс тербелістері Применение лазера в медицине
Применение лазера в медицине Второй закон термодинамики
Второй закон термодинамики Презентация по физике "Реакция электролиза" - скачать
Презентация по физике "Реакция электролиза" - скачать  Строение атома
Строение атома Производство электроэнергии Авторы работы: Рыпакова Елизавета, Кузнецова Анна, ученицы «11А» кл. Руководитель работы : Минина О
Производство электроэнергии Авторы работы: Рыпакова Елизавета, Кузнецова Анна, ученицы «11А» кл. Руководитель работы : Минина О Аксиально-поршневые гидромашины. (Лекция 5)
Аксиально-поршневые гидромашины. (Лекция 5) Жылулық сәулелену. Абсолют қара дене. Стефан – Больцман заңы
Жылулық сәулелену. Абсолют қара дене. Стефан – Больцман заңы