Содержание
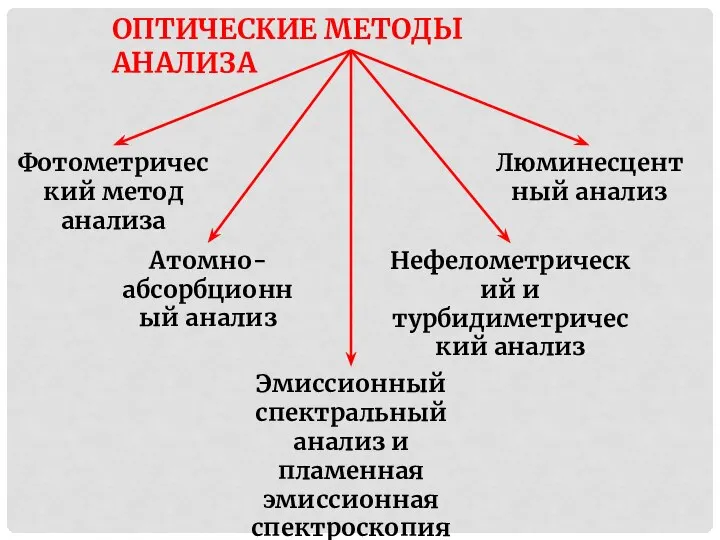
- 2. ОПТИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Фотометрический метод анализа Эмиссионный спектральный анализ и пламенная эмиссионная спектроскопия Атомно-абсорбционный анализ Нефелометрический
- 3. Закон Бугера-Ламберта-Бера: А = e l c где: А = –lg (I / I0) = –lg
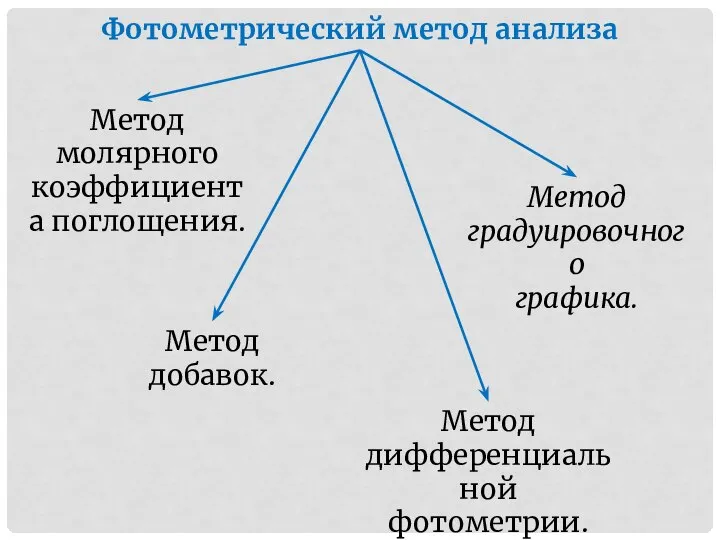
- 4. Фотометрический метод анализа Метод молярного коэффициента поглощения. Метод градуировочного графика. Метод добавок. Метод дифференциальной фотометрии.
- 5. Метод молярного коэффициента поглощения. Фотометрический метод анализа При работе по этому методу определяют оптическую плотность нескольких
- 6. Фотометрический метод анализа Метод градуировочного графика. Готовят серию разведений стандартного раствора, измеряют их поглощение, строят график
- 7. Фотометрический метод анализа Метод добавок. Этот метод применяют при анализе растворов сложного состава, так как он
- 8. Фотометрический метод анализа Метод добавок. Оптическая плотность Ах анализируемого раствора равна: Ах = ε l cх,
- 9. Фотометрический метод анализа Метод дифференциальной фотометрии. Фотометрическим методом можно определять также компоненты смеси двух и более
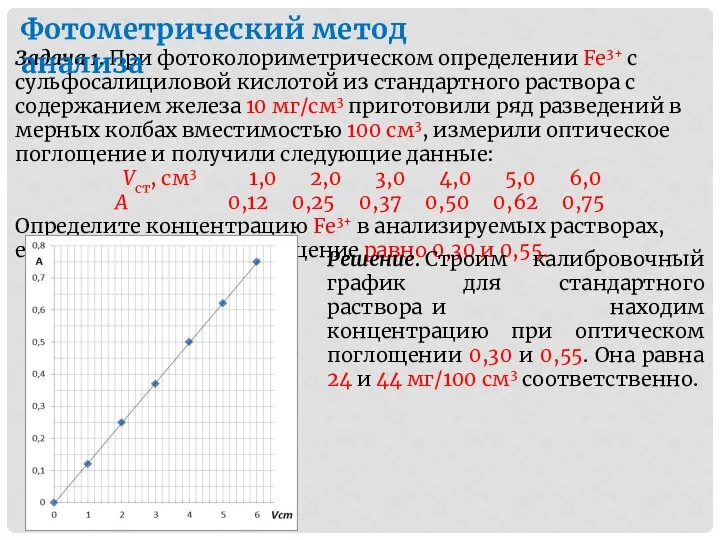
- 10. Задача 1. При фотоколориметрическом определении Fe3+ с сульфосалициловой кислотой из стандартного раствора с содержанием железа 10
- 11. Фотометрический метод анализа Задача 2. После растворения 0,2500 г стали раствор разбавили до 100,0 мл. В
- 12. Эмиссионный спектральный анализ и пламенная эмиссионная спектроскопия Эмиссионный спектральный анализ. Эмпирическое уравнение Б.Б. Ломакина: I =
- 13. Пламенная эмиссионная спектроскопия Количественные определения проводят методом калибровочного графика и методом добавок по формуле: сх =
- 14. Эмиссионный спектральный анализ и пламенная эмиссионная спектроскопия Задача 1. Для определения длины волны интересующей линии λх
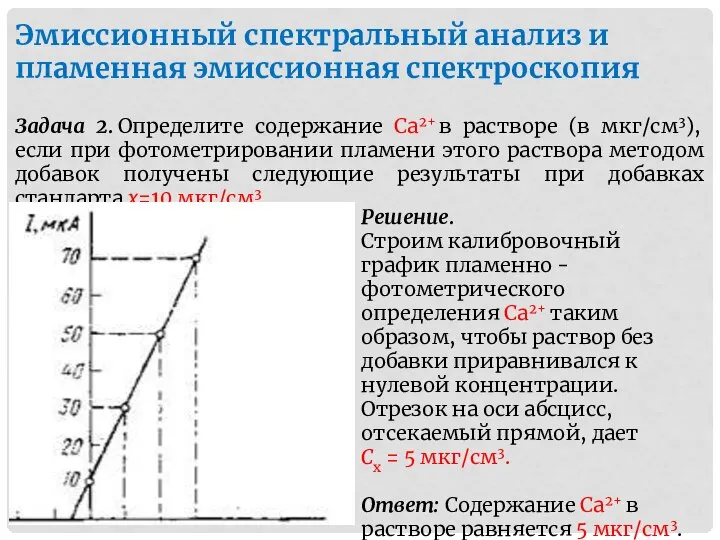
- 15. Задача 2. Определите содержание Са2+ в растворе (в мкг/см3), если при фотометрировании пламени этого раствора методом
- 16. Атомно-абсорбционный анализ Концентрационная зависимость оптической плотности выражается уравнением: lg (I0/I) = А = k l c
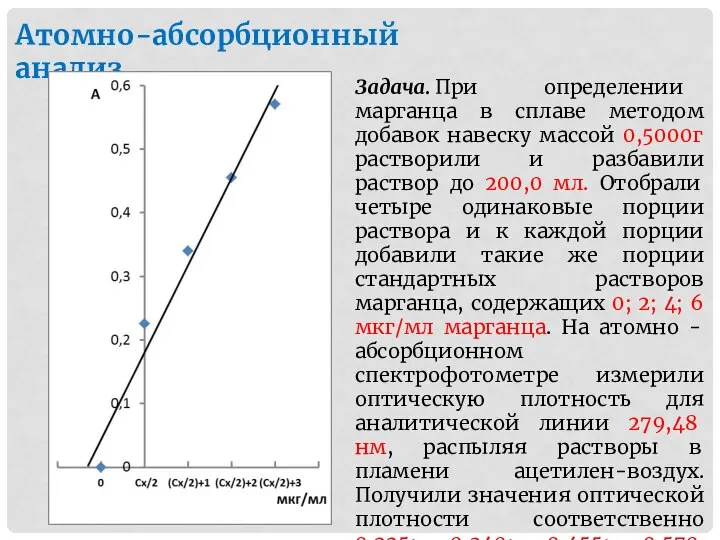
- 17. Атомно-абсорбционный анализ Задача. При определении марганца в сплаве методом добавок навеску массой 0,5000г растворили и разбавили
- 18. Решение. Принимаем концентрацию исследуемого раствора за сх. Тогда концентрации измеряемых растворов составляют сх/2; (сх/2)+1; (сх/2)+2; (сх/2)+3
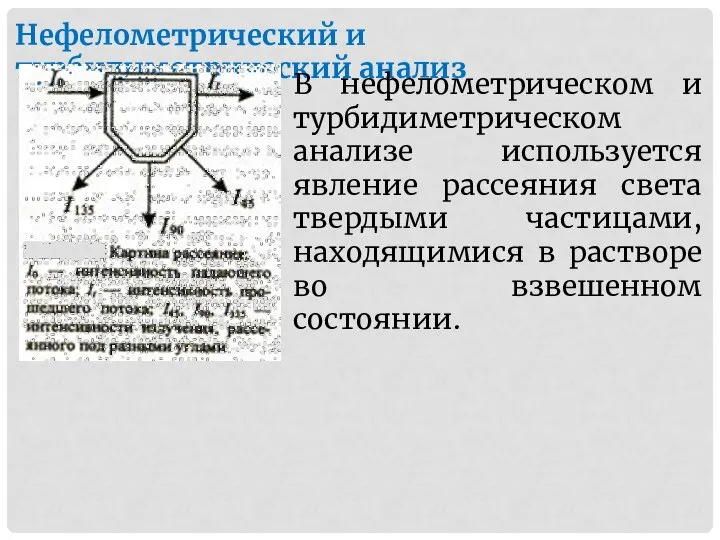
- 19. Нефелометрический и турбидиметрический анализ В нефелометрическом и турбидиметрическом анализе используется явление рассеяния света твердыми частицами, находящимися
- 20. Нефелометрический и турбидиметрический анализ Пробу освещают потоком света с интенсивностью I0, а затем, так же как
- 21. Нефелометрический и турбидиметрический анализ Метод, в котором используют интенсивность прошедшего света It, называют турбидиметрией, а метод
- 22. Нефелометрический и турбидиметрический анализ Используемое в нефелометрии расчетное соотношение следующее: I = Ka c I0, где:
- 23. Нефелометрический и турбидиметрический анализ Задача. Из навески Pb(C2H3O2)2·3Н2О массой 0,3260 г приготовили 100,0 мл раствора. В
- 24. Люминесцентный анализ Люминесценция - свечение вещества после поглощения им энергии возбуждения: М* → М + hν
- 25. Люминесцентный анализ Задача. При анализе пробы массой 0,9816 г на содержание кобальта хемилюминесцентным фотографическим методом на
- 26. Люминесцентный анализ Решение. В хемилюминесцентном фотографическом методе используется зависимость ΔS – разности почернений пятен в их
- 27. ЭЛЕКТРОХИМИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Потенциометрический метод анализа Кондуктометрический метод анализа Кулонометрический метод анализа Вольт-амперометрический метод анализа
- 28. Потенциометрический метод анализа Равновесный потенциал индикаторного электрода связан с активностью, участвующих в электродном процессе, уравнением Нернста:
- 29. Потенциометрический метод анализа Подставляя Т = 298,15 К и числовые значения констант R и F в
- 30. Потенциометрический метод анализа Задача 1. Вычислите электродный потенциал медного электрода, опущенного в раствор соли меди с
- 31. Кондуктометрический метод анализа По аналогии с сопротивлением проводников I рода, сопротивление раствора прямо пропорционально расстоянию между
- 32. Кондуктометрический метод анализа Эквивалентной электрической проводимостью называют проводимость раствора, содержащего 1 моль эквивалента вещества и находящегося
- 33. Кондуктометрический метод анализа Задача 1. Сопротивление ячейки с 0,1 моль-экв/л раствора NaCl равно 46,8 Ом. Площадь
- 34. Кондуктометрический метод анализа Задача 2. При кондуктометрическом титровании 50 мл раствора HCl 0,01 моль-экв/л NaOH были
- 35. Кулонометрический метод анализа Законы Фарадея формулируются следующим образом: Количество электропревращенного (восстановленного или окисленного) в процессе электролиза
- 36. Кулонометрический метод анализа число Фарадея F=96500 Кл/моль. m = (Q / F ) . M /
- 37. Кулонометрический метод анализа Задача 1. На полное восстановление цинка в кулонометрии понадобилось 26 мин при силе
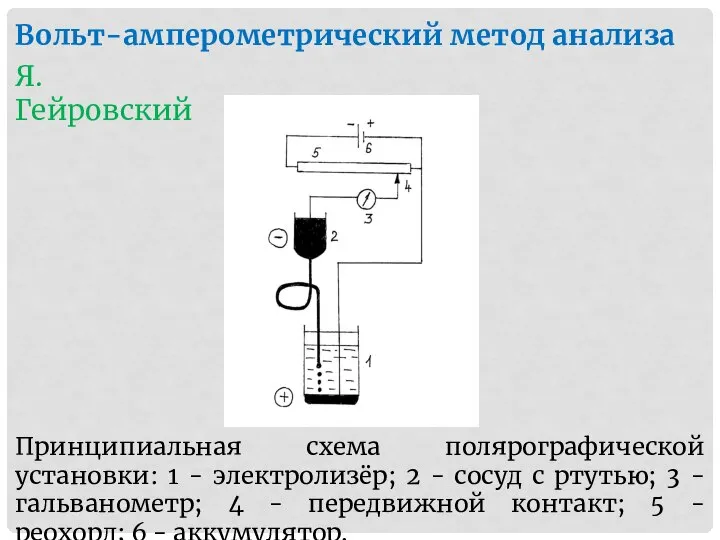
- 38. Вольт-амперометрический метод анализа Я. Гейровский Принципиальная схема полярографической установки: 1 - электролизёр; 2 - сосуд с
- 39. Вольт-амперометрический метод анализа Типичный вид полярограмм определяемого элемента Зависимость тока I от приложенногонапряжения Е при обратимом
- 40. Вольт-амперометрический метод анализа Количественный полярографический анализ основан на уравнении Ильковича, которое связывает диффузионный ток Id с
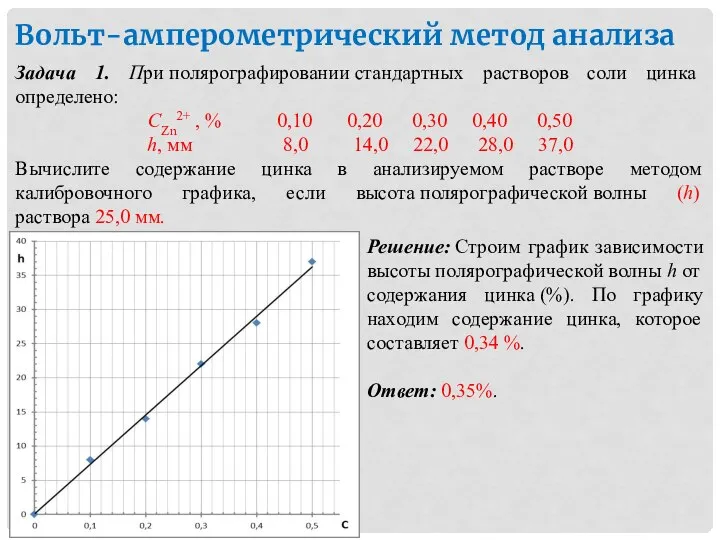
- 41. Вольт-амперометрический метод анализа Задача 1. При полярографировании стандартных растворов соли цинка определено: СZn2+ , % 0,10
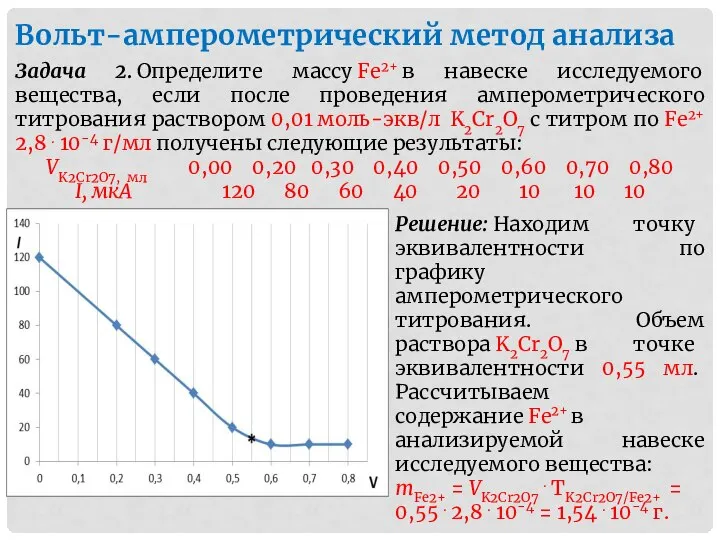
- 42. Вольт-амперометрический метод анализа Задача 2. Определите массу Fe2+ в навеске исследуемого вещества, если после проведения амперометрического
- 43. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Хроматография впервые была введена в аналитическую практику русским ботаником М.С. Цветом. Закон адсорбционного
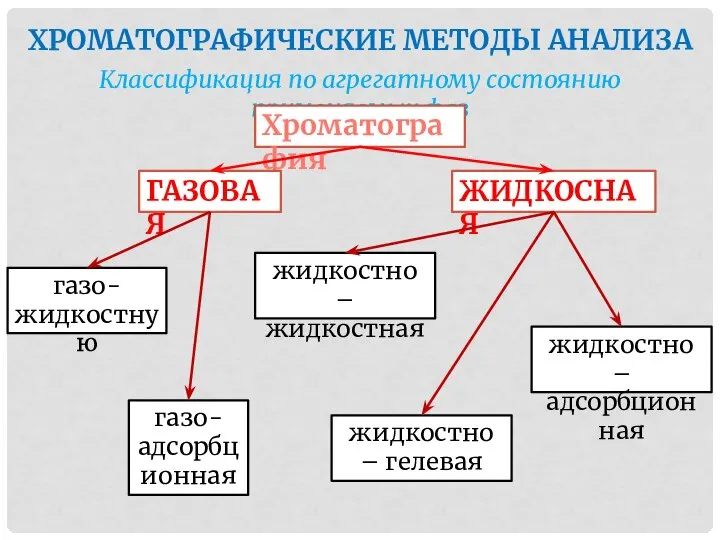
- 44. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Классификация по агрегатному состоянию применяемых фаз Хроматография ГАЗОВАЯ ЖИДКОСНАЯ газо-жидкостную газо-адсорбционная жидкостно –
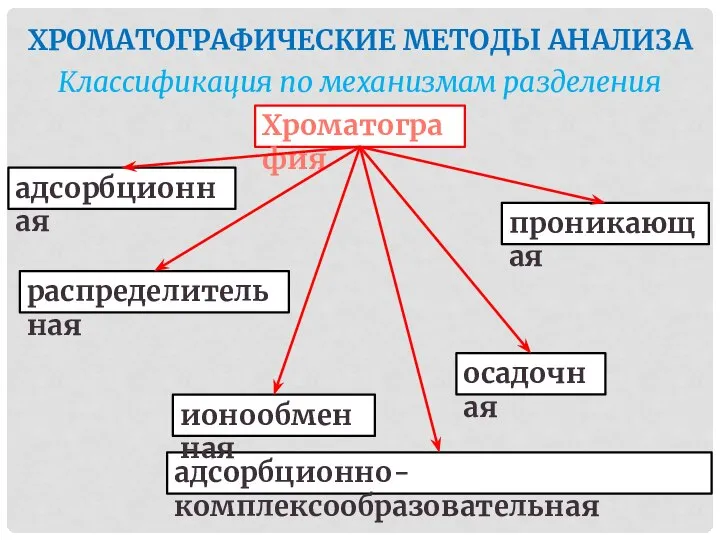
- 45. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Классификация по механизмам разделения Хроматография адсорбционно-комплексообразовательная адсорбционная распределительная ионообменная проникающая осадочная
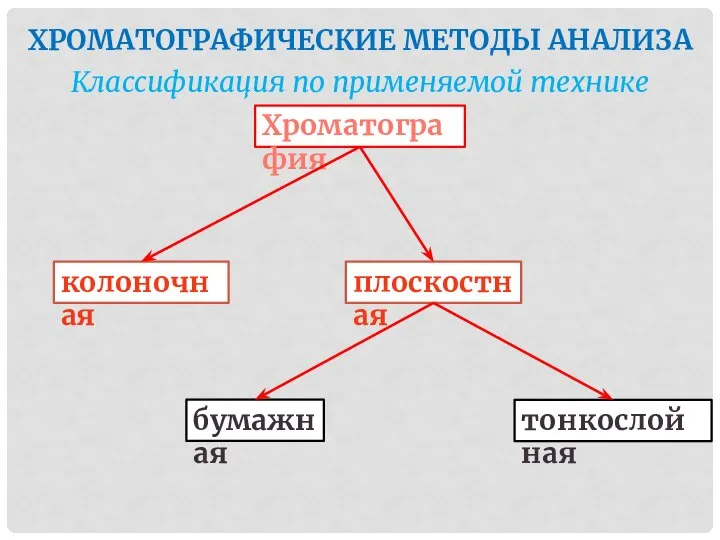
- 46. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Классификация по применяемой технике Хроматография тонкослойная колоночная плоскостная бумажная
- 47. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Коэффициент распределения вещества равен: Кп/н = сп / сн где: сп и сн
- 48. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Сорбционные свойства системы в ТСХ характеризуются подвижностью, т.е. величиной Rf, которая рассчитывается из
- 49. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Задача 1. Определить массовую долю (%) компонентов газовой смеси по следующим данным: Компонент:
- 50. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Задача 2. Реакционную массу после нитрования толуола проанализировали методом газожидкостной хроматографии с применением
- 51. ХРОМАТОГРАФИЧЕСКИЕ МЕТОДЫ АНАЛИЗА Задача 3. Для хроматографического определения никеля на бумаге, пропитанной раствором диметилглиоксима, приготовили три
- 53. Скачать презентацию





































 Электроразведочные методы на этапах поиска и оценки рудных месторождений
Электроразведочные методы на этапах поиска и оценки рудных месторождений Основные свойства атомных ядер. Масса и энергия связи ядра
Основные свойства атомных ядер. Масса и энергия связи ядра Динамика вращательного движения. Момент силы
Динамика вращательного движения. Момент силы Атмосферное давление Цель урока: сформировать представление об атмосферном давлении и закономерностях его изменения Научитьс
Атмосферное давление Цель урока: сформировать представление об атмосферном давлении и закономерностях его изменения Научитьс Почему радуга разноцветная
Почему радуга разноцветная Зависимость силы тока от напряжения. Электрическое сопротивление
Зависимость силы тока от напряжения. Электрическое сопротивление Основные Законы Природы
Основные Законы Природы Решение задач. Закон всемирного тяготения
Решение задач. Закон всемирного тяготения «Вес воздуха. Атмосферное давление». Цель урока: 1. Рассмотреть причины, создающие атмосферное давление. 2. Экспериментально док
«Вес воздуха. Атмосферное давление». Цель урока: 1. Рассмотреть причины, создающие атмосферное давление. 2. Экспериментально док Шина Can, управления электрическими устройствами автомобиля
Шина Can, управления электрическими устройствами автомобиля Загадка Роберта Вуда (спектры и спектральный анализ)
Загадка Роберта Вуда (спектры и спектральный анализ) Свойства твёрдых тел, жидкостей и газов
Свойства твёрдых тел, жидкостей и газов Люминесценция биологических объектов
Люминесценция биологических объектов Типовой расчет №3. Молекулярная физика и термодинамика
Типовой расчет №3. Молекулярная физика и термодинамика Катушка Тесла
Катушка Тесла Гигрометр. Виды гигрометров
Гигрометр. Виды гигрометров Радиотолқындар. Радиотолқындар мен инфрақызыл сәулелердің
Радиотолқындар. Радиотолқындар мен инфрақызыл сәулелердің Назначение и общее устройство трактора Беларус1221
Назначение и общее устройство трактора Беларус1221 Механические свойства металлов
Механические свойства металлов История ракетостроения
История ракетостроения Решение экзаменационных задач по МОАНИ
Решение экзаменационных задач по МОАНИ Исследовательская работа по теме: «Фруктовые и овощные батарейки».
Исследовательская работа по теме: «Фруктовые и овощные батарейки». Формулы расчёта оптической силы интраокулярных линз
Формулы расчёта оптической силы интраокулярных линз Общая энергетика. Теория теплообмена. Теплопроводность
Общая энергетика. Теория теплообмена. Теплопроводность Москаленко Анна 10-М
Москаленко Анна 10-М  Насыщенный пар. Влажность воздуха
Насыщенный пар. Влажность воздуха Поляризация
Поляризация  Законы сохранения в механике
Законы сохранения в механике