Полный момент импульса электрона в атоме. Символические обозначения термов. Правила отбора для оптических переходов
Содержание
- 2. Операции с векторами орбитального момен-та L и спина S можно производить с помо-щью следующего полуклассического мето-да.
- 3. Во-первых, углы между векторами L и S не могут быть произвольными. Вектор L может располагаться относительно
- 4. Во-вторых, полный момент J, как всякий момент им-пульса в квантовой механике имеет свое кванто-вое число j,
- 5. Проекция вектора J на какое либо направление Z (ось квантования, направление внешнего маг-нитного или электрического поля
- 6. Полный механический момент (спин) атома Ядро атома также обладает собственным механи-ческим моментом (спином) JЯ , поэтому
- 7. Полный магнитный момент атома Каждое ядро с ненулевым спином имеет магнитный момент μЯ, направление которого с
- 8. Полный магнитный момент атома Ядерный магнетон (19.11) отличается от магнетона Бора μ0 (формула (15.4)) тем, что
- 9. Вернемся к электронной оболочка атома. Изложенные выше правила сложения векторов L и S составляют векторную модель
- 10. Различные состояния атома (термы) принято обо-значать специальными символами. Общий вид такого обозначения: (19.13) где квантовое число
- 11. Т.к. терм - это характеристика всего атома, то ис-пользуются прописные буквы вместо строчных (которые применяются для
- 12. Правила отбора для оптических переходов Согласно комбинационному принципу, волновое число любой спектральной линии (в испускании и
- 13. Эти правила связаны с законами сохранения мо-мента импульса и четности в квантовых пере-ходах. В частности установлено,
- 14. Если условие (19.16) соблюдается, то такие пере-ходы называются разрешенными. Другие пере-ходы маловероятны, и их называют запрещен-ными.
- 15. Вероятность перехода определяется так называ-емым матричным элементом: интегралом вида (19.17) который представляет собой дипольный момент ex,
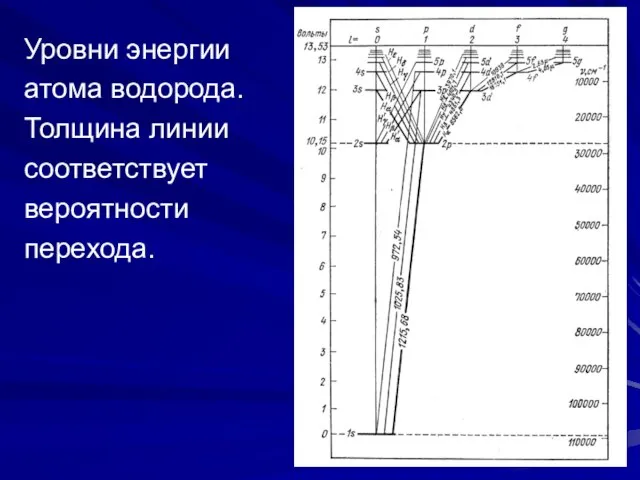
- 16. Уровни энергии атома водорода. Толщина линии соответствует вероятности перехода.
- 17. Схема уровней энергии атома лития
- 19. Скачать презентацию















 Уравнения распространения волн
Уравнения распространения волн Типы камер сгорания и их сравнительная оценка
Типы камер сгорания и их сравнительная оценка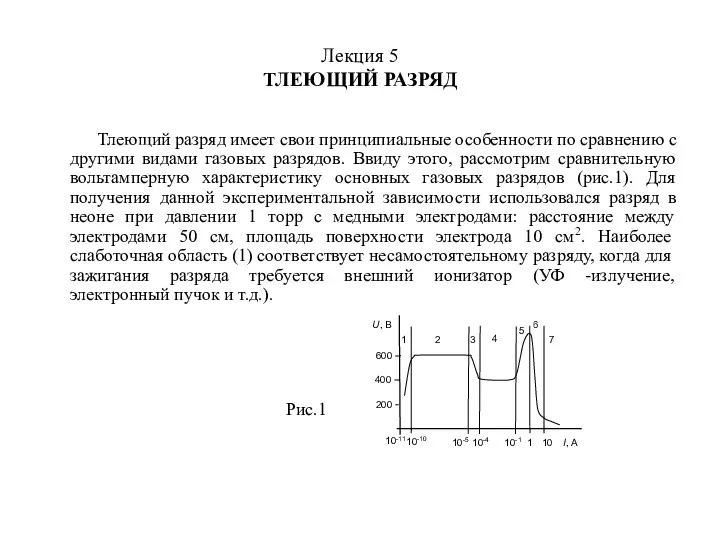 Тлеющий разряд. (Лекция 5)
Тлеющий разряд. (Лекция 5) Опиливание металла
Опиливание металла 7ф урок 1
7ф урок 1 Гидравлические машины
Гидравлические машины Мыльные пузыри и плёнки
Мыльные пузыри и плёнки Преобразования электрических цепей
Преобразования электрических цепей Тепловые двигатели и охрана окружающей среды
Тепловые двигатели и охрана окружающей среды Презентация по физике Термодинамика
Презентация по физике Термодинамика  Электростатика. Потенциал электростатического поля. Напряжение. (Лекция 2.2)
Электростатика. Потенциал электростатического поля. Напряжение. (Лекция 2.2) Прямоточный воздушнореактивный двигатель (ПВРД), Сверхзвуковой ПВРД, Гиперзвуковой ГПВРД, Пульсирующий воздушнореактивный
Прямоточный воздушнореактивный двигатель (ПВРД), Сверхзвуковой ПВРД, Гиперзвуковой ГПВРД, Пульсирующий воздушнореактивный Сила упругости
Сила упругости Электрическое поле в веществе
Электрическое поле в веществе Технологический колледж сервиса Государственное образовательное учреждение высшего профессионального образования Южно-Уральс
Технологический колледж сервиса Государственное образовательное учреждение высшего профессионального образования Южно-Уральс Мощность. Единицы мощности
Мощность. Единицы мощности Источники питания и напряжения и контрольно-измерительные приборы Практикум по основам измерительных технологий
Источники питания и напряжения и контрольно-измерительные приборы Практикум по основам измерительных технологий  Три состояния вещества
Три состояния вещества Физиология возбудимых тканей. Структура и функции биологических мембран
Физиология возбудимых тканей. Структура и функции биологических мембран Голография и её применения
Голография и её применения Движение тела по окружности
Движение тела по окружности Агрегатное состояние вещества Презентация к уроку по физике 8 класс
Агрегатное состояние вещества Презентация к уроку по физике 8 класс Festkörperphysik. Material design
Festkörperphysik. Material design Этапы создания деталей, узлов и машин. Требования к машинам и критерии их качества
Этапы создания деталей, узлов и машин. Требования к машинам и критерии их качества Решение задач по теме Закон всемирного тяготения презентация
Решение задач по теме Закон всемирного тяготения презентация Презентация элективного курса «Астрофизика - школьникам» 11 класс. (16 часов).
Презентация элективного курса «Астрофизика - школьникам» 11 класс. (16 часов). Звуковые волны. Урок изучения нового материала
Звуковые волны. Урок изучения нового материала ТЕСТ "Геометрическая оптика"
ТЕСТ "Геометрическая оптика"