Содержание
- 2. Проверка выполнения домашнего задания: Раздаточный материал Ответьте на вопросы: Что изучает молекулярная физика? Какие тела называют
- 3. Какие законы называются газовыми? Что такое изопроцессы? Что такое температура? Какие существуют шкалы для измерения температуры?
- 4. Количественную зависимость между двумя параметрами газа при фиксированном значении третьего параметра называют газовыми законами. Процессы, протекающие
- 5. Температура не может быть измерена непосредственно! Основной способ измерения температуры — по изменению тел при нагревании
- 6. изопроцессы ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС ИЗОБАРНЫЙ ПРОЦЕСС ИЗОХОРНЫЙ ПРОЦЕСС
- 7. Существует два определения температуры. Одно — с молекулярно-кинетической точки зрения, другое — с термодинамической. Т –
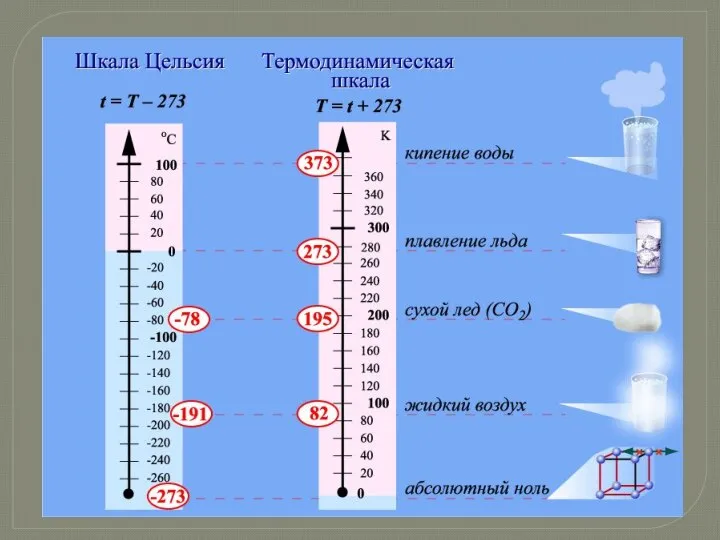
- 8. * О ШКАЛЕ ИЗМЕРЕНИЯ ТЕМПЕРАТУРЫ Какие существуют шкалы для измерения температуры и какова история их создания?
- 9. * Карло Ренальдини В 1694 году предложил принять в качестве двух крайних фиксированных точек термометра температуру
- 10. * Р.А.Реомюр В 1730 году делал опыты со спиртовым термометром и принял за 0 ° температуру
- 11. * Андрес Цельсий В 1742 году опубликовал работу с описанием стоградусной шкалы термометра, в которой температура
- 12. * Позже шведский биолог К.Линней «перевернул» эту шкалу, приняв за 0° температуру таяния льда. Этой шкалой
- 13. * Д. Г. Фаренгейт В 1714 году изготовил ртутный термометр. На шкале Фаренгейта точка таяния льда
- 14. * М. В. Ломоносовым был предложен жидкостный термометр, имеющий шкалу со 150 делениями от точки плавления
- 15. * К концу 18 века количество различных температурных шкал значительно увеличилось. По данным «Пилометрии» Ламберта на
- 16. * Английским ученым лордом Кельвином в 1848 году была предложена абсолютная термодинамическая шкала. Одновременно Кельвин обосновал
- 18. * На сегодняшний день используются термометры со шкалой Цельсия, Фаренгейта (в США), а также со шкалой
- 19. Температура тела увеличилась на 10 0С. Какому изменению температуры по шкале Кельвина это соответствует? Газ находится
- 20. Лабораторная работа № 1 «Исследование скорости остывания воды»
- 21. ИЗОБАРНЫЙ ПРОЦЕСС ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЁННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ДАВЛЕНИИ
- 22. Изобарный процесс
- 23. Этот закон экспериментально был открыт в 1802г. французским учёным Гей-Люссаком
- 24. Для данной массы данного вещества, отношение объема газа к его температуре постоянно, если давление не меняется.
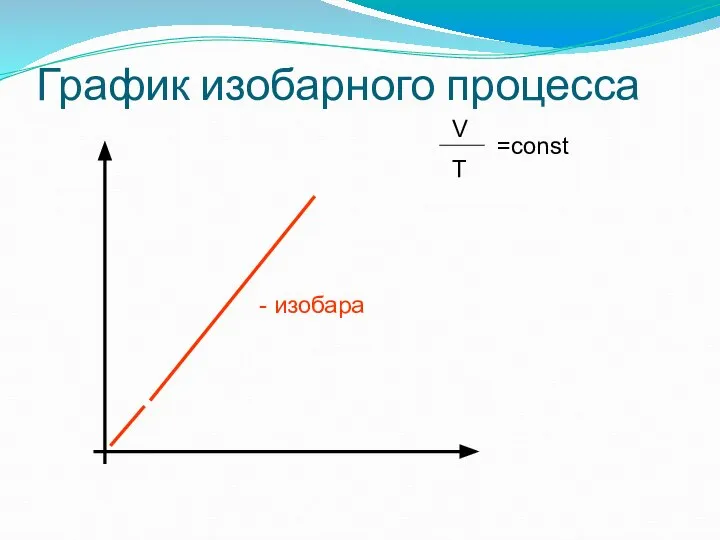
- 25. ГРАФИК ИЗОБАРНОГО ПРОЦЕССА: ИЗОБАРА (ПРЯМАЯ)
- 26. График изобарного процесса - изобара V T =const
- 27. ИСПОЛЬЗОВАНИЕ В ПРИРОДЕ И ТЕХНИКЕ РАСШИРЕНИЕ ГАЗА ПРИ НАГРЕВАНИИ ЕГО В ЦИЛИНДРЕ С ПОДВИЖНЫМ ПОРШНЕМ
- 28. Как изменяется объём данной массы газа при увеличении его абсолютной температуры в 3 раза, если давление
- 29. ИЗОХОРНЫЙ ПРОЦЕСС ПРОЦЕСС ИЗМЕНЕНИЯ СОСТОЯНИЯ ОПРЕДЕЛЁННОЙ МАССЫ ГАЗА ПРИ ПОСТОЯННОМ ОБЪЁМЕ
- 30. Изохорный процесс
- 31. Эту зависимость экспериментально установил в 1787 г. французский физик Шарль
- 32. Для данной массы данного вещества, отношение давления газа к температуре постоянно, если объем не меняется. Закон
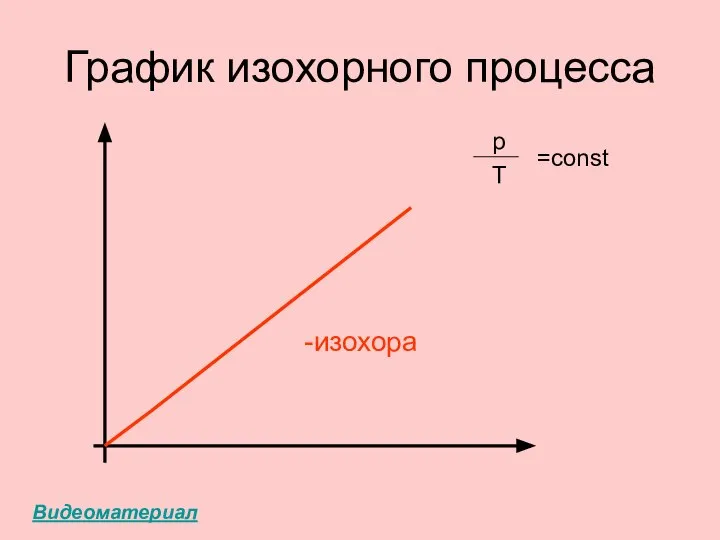
- 33. ГРАФИК ИЗОХОРНОГО ПРОЦЕССА: ИЗОХОРА (ПРЯМАЯ)
- 34. График изохорного процесса -изохора p Т =const Видеоматериал
- 35. ИСПОЛЬЗОВАНИЕ В ПРИРОДЕ И ТЕХНИКЕ УВЕЛИЧЕНИЕ ДАВЛЕНИЯ ПРИ НАГРЕВАНИИ В ЭЛЕКТРИЧЕСКОЙ ЛАМПОЧКЕ
- 36. Как изменяется давление данной массы газа при уменьшении абсолютной температуры в 2 раза, если объём газа
- 38. Скачать презентацию


























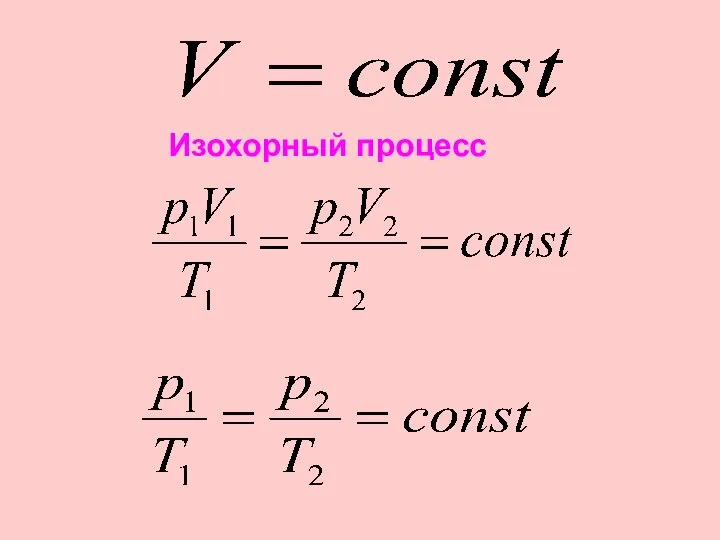





 Почему самолеты не падают
Почему самолеты не падают Андрей Дмитриевич Сахаров
Андрей Дмитриевич Сахаров Развитие навыков смыслового чтения и работы с текстом на уроках физики
Развитие навыков смыслового чтения и работы с текстом на уроках физики Исследование зависимости уровня воды от различных параметров
Исследование зависимости уровня воды от различных параметров Удельная теплоёмкость ( 8 класс)
Удельная теплоёмкость ( 8 класс) Сравнение энергоисточников
Сравнение энергоисточников Презентация по физике "Собирающие линзы" - скачать
Презентация по физике "Собирающие линзы" - скачать  Решение задач. Закон сохранения энергии
Решение задач. Закон сохранения энергии Звук и вибрация
Звук и вибрация Конвекция. Основные положения переноса теплоты. (Тема 2. Лекции 6,7)
Конвекция. Основные положения переноса теплоты. (Тема 2. Лекции 6,7) Аттестационная работа. Проведение энергетического исследования на предприятиях и учреждениях ЖКХ
Аттестационная работа. Проведение энергетического исследования на предприятиях и учреждениях ЖКХ Оценки качества переходных процессов
Оценки качества переходных процессов Презентация по физике "Физика и методы научного познания" - скачать
Презентация по физике "Физика и методы научного познания" - скачать  Работу выполнили Учащиеся 10 а класса МОУ СОШ №19 Пономарева Алена Докучаев Денис Залавский Сергей Прокопенко Сергей
Работу выполнили Учащиеся 10 а класса МОУ СОШ №19 Пономарева Алена Докучаев Денис Залавский Сергей Прокопенко Сергей Альберт Эйнштейн Я был третируем моими профессорами, которые не любили меня из-за моей независимости и закрыли мне путь в науку…
Альберт Эйнштейн Я был третируем моими профессорами, которые не любили меня из-за моей независимости и закрыли мне путь в науку… Электричество. Электростатика
Электричество. Электростатика Атомның планетарлық моделі
Атомның планетарлық моделі Урок повторения Световые кванты
Урок повторения Световые кванты МАНОМЕТРЫ 7 КЛАСС Автор: учитель физики МОУ «СОШ № 1» г. Ивантеевки Гагарина Марианна Сергеевна
МАНОМЕТРЫ 7 КЛАСС Автор: учитель физики МОУ «СОШ № 1» г. Ивантеевки Гагарина Марианна Сергеевна Электромагнитное излучение на границе раздела сред и в структурированном веществе. Оптическая микроскопия ближнего поля
Электромагнитное излучение на границе раздела сред и в структурированном веществе. Оптическая микроскопия ближнего поля Системы создания плазмы. Плазменные установки
Системы создания плазмы. Плазменные установки Спектры периодических и непериодических сигналов
Спектры периодических и непериодических сигналов Внутренняя энергия, теплопередача, работа
Внутренняя энергия, теплопередача, работа Термическая обработка металлов
Термическая обработка металлов Космические ЯЭУ
Космические ЯЭУ Возбуждение петлей. Возбуждение штырем. Возбуждение зондовым возбудителем
Возбуждение петлей. Возбуждение штырем. Возбуждение зондовым возбудителем Качество изображения астрономических объективов и изображений математически-смоделированного точечного источника
Качество изображения астрономических объективов и изображений математически-смоделированного точечного источника Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим
Жизнь и творчество Д.И. Менделеева Подготовил ученик 8а Карбушев Максим