Содержание
- 2. Gliederung Röntgenabsorptionsspektroskopie mit Synchrotronstrahlung Spektroskopische Speziation von Actiniden Aquoionen Hydrolyse Komplexierung mit F-, Cl-, NO3-, CO32-
- 3. Entwicklung der Synchrotronstahlung im 20. Jh. 1895 G. C. Röntgen entdeckt X-Strahlen 1913 W. D. Cooldige
- 4. Synchrotronspeicherring der ESRF am Zusammenfluß von Drac und Isere in Grenoble Foto: ESRF
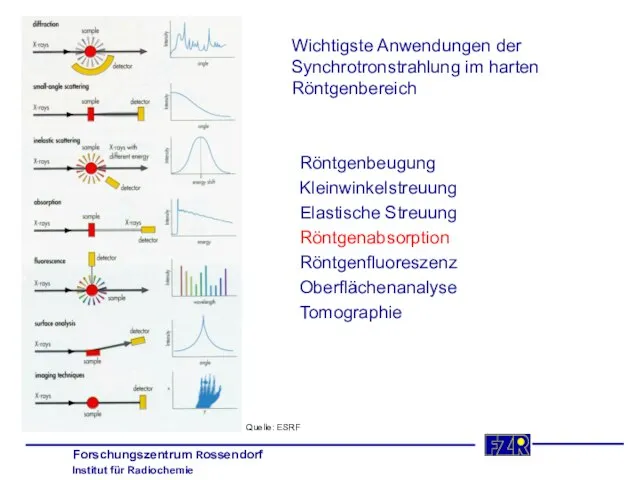
- 5. Wichtigste Anwendungen der Synchrotronstrahlung im harten Röntgenbereich Röntgenbeugung Kleinwinkelstreuung Elastische Streuung Röntgenabsorption Röntgenfluoreszenz Oberflächenanalyse Tomographie Quelle:
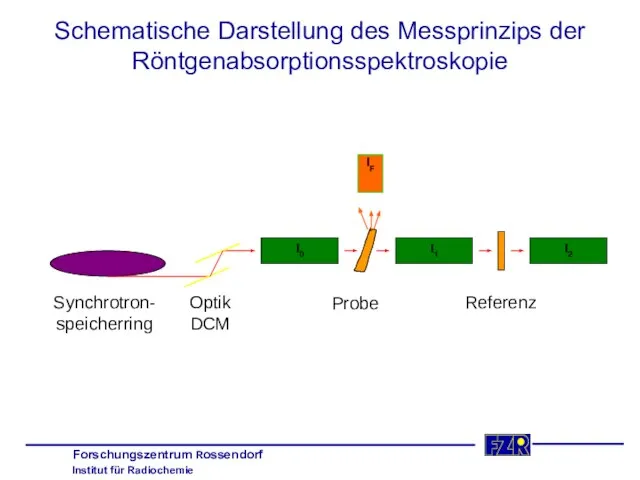
- 6. Schematische Darstellung des Messprinzips der Röntgenabsorptionsspektroskopie
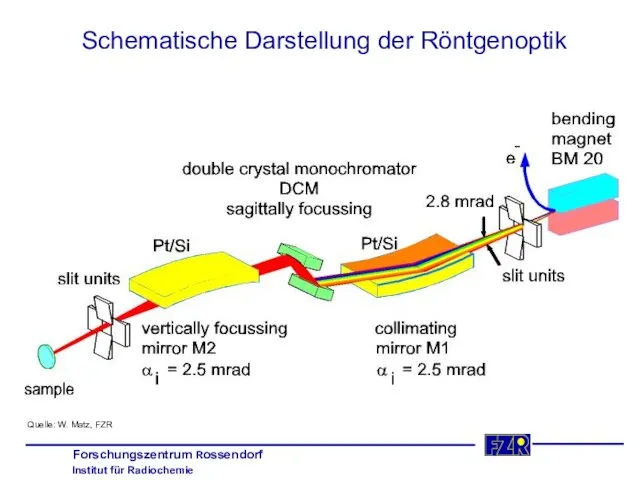
- 7. Schematische Darstellung der Röntgenoptik Quelle: W. Matz, FZR
- 8. Eigenschaften des Röntgenstrahls Energiebereich: 5 - 35 keV Energieauflösung ΔE/E: 1,5 - 2,5 x 10-4 Si(111)
- 9. Radiochemie-Messplatz am Rossendorfer Synchrotronstrahlrohr ROBL Maximale Aktivität der Proben am Messplatz: 185 MBq (5 mCi) Umgangsgenehmigung
- 10. Motivation für die XAFS-Untersuchungen Eigenschaften der radioaktiven Elemente ganz wesentlich bestimmt durch ihre chemischen Bindungsformen (Elementspeziation)
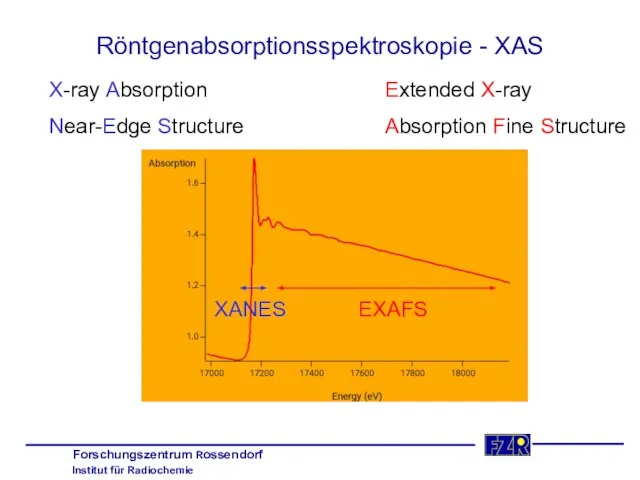
- 11. Röntgenabsorptionsspektroskopie - XAS X-ray Absorption Near-Edge Structure Extended X-ray Absorption Fine Structure XANES EXAFS
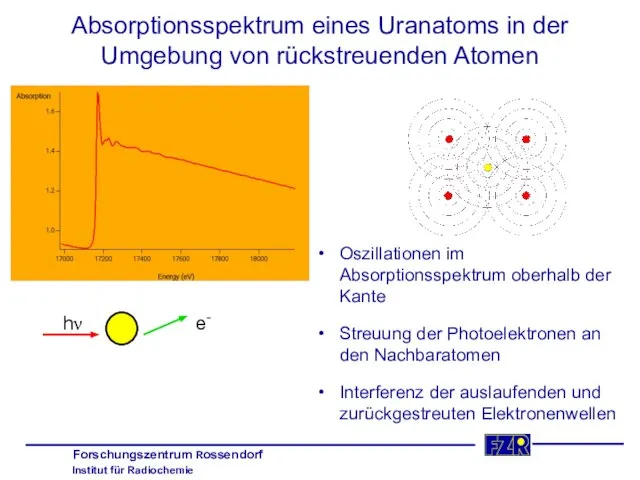
- 12. Absorptionsspektrum eines Uranatoms in der Umgebung von rückstreuenden Atomen Oszillationen im Absorptionsspektrum oberhalb der Kante Streuung
- 13. Thorium 16 300 Uran 17 166 Neptunium 17 610 Plutonium 18 057 Americium 18 510 Curium
- 14. XANES-Spektroskopie 10-5 mol/L EXAFS-Spektroskopie 5x10-4 mol/L 200 - 500 ppm Für die XAFS-Spektroskopie notwendige Menge an
- 15. Ziel der EXAFS-Untersuchung Bestimmung der Strukturparameter der nächsten Nachbarn Koordinationszahlen N (±20%) Bindungsabstände R (±0,02 Å)
- 16. Sauerstoff K-Kante EXAFS von Wasser Wasserstoff als Rückstreuer Wasserdampf, 20 mtorr EXAFS-Signal ist 1% des atomaren
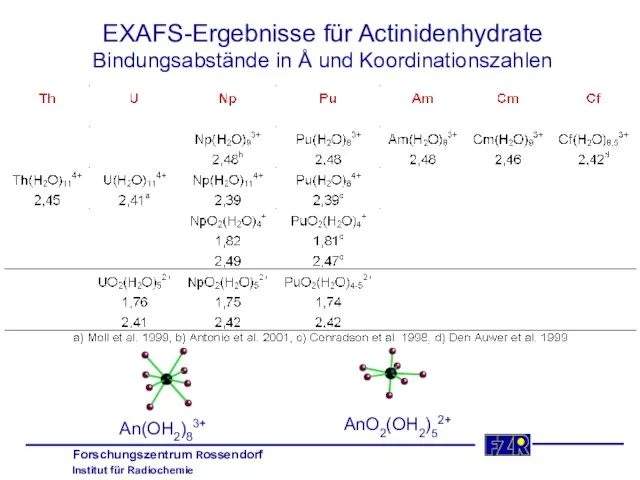
- 17. EXAFS-Ergebnisse für Actinidenhydrate Bindungsabstände in Å und Koordinationszahlen An(OH2)83+ AnO2(OH2)52+
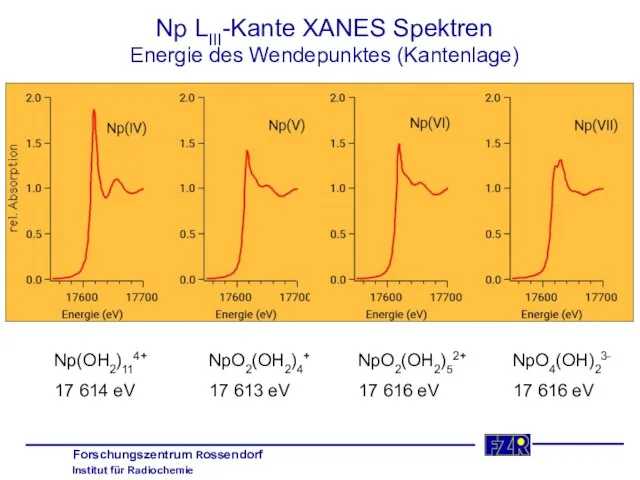
- 18. Np LIII-Kante XANES Spektren Energie des Wendepunktes (Kantenlage) Np(OH2)114+ 17 614 eV NpO2(OH2)4+ 17 613 eV
- 19. In Situ XAFS-Messungen von Actinidenspezies Design einer elektrochemischen Zelle M.R. Antonio et al., J. Appl. Electrochem.
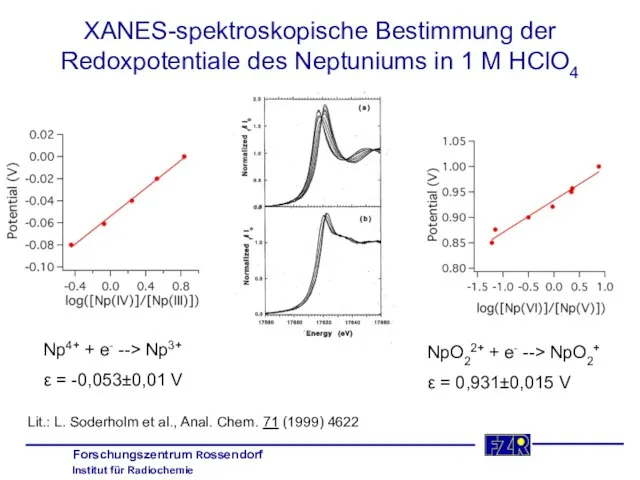
- 20. XANES-spektroskopische Bestimmung der Redoxpotentiale des Neptuniums in 1 M HClO4 Np4+ + e- --> Np3+ ε
- 21. U(VI) Hydrolyse-Spezies Probenpräparation Probe A 0,05 M U(VI), 0,05 M TMA-OH, pH 4,1 Aus thermodynamischen Daten
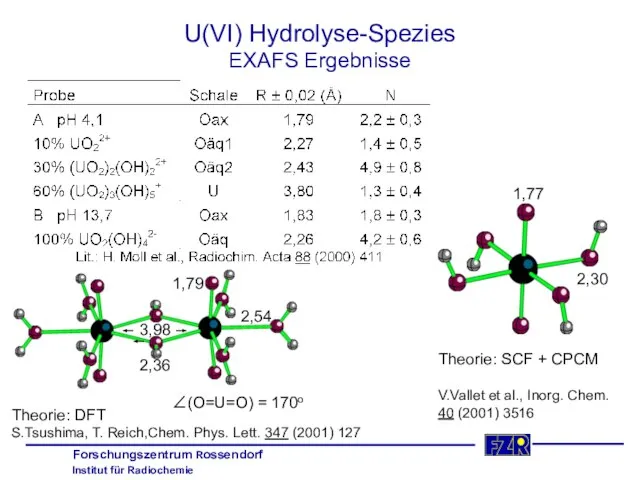
- 22. U(VI) Hydrolyse-Spezies EXAFS Ergebnisse V.Vallet et al., Inorg. Chem. 40 (2001) 3516 2,30 1,77 Theorie: SCF
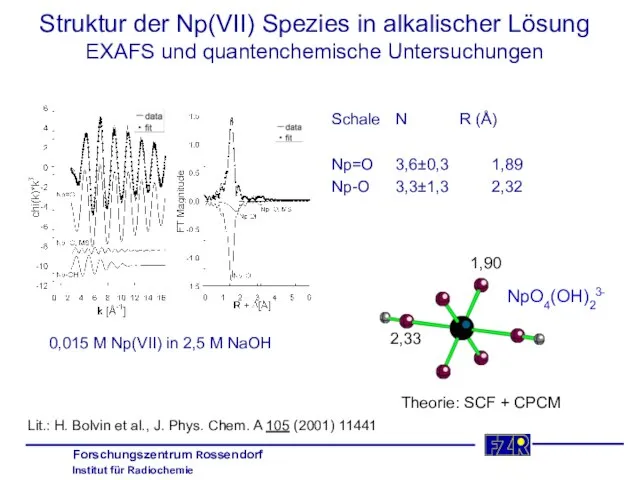
- 23. Struktur der Np(VII) Spezies in alkalischer Lösung EXAFS und quantenchemische Untersuchungen Schale N R (Å) Np=O
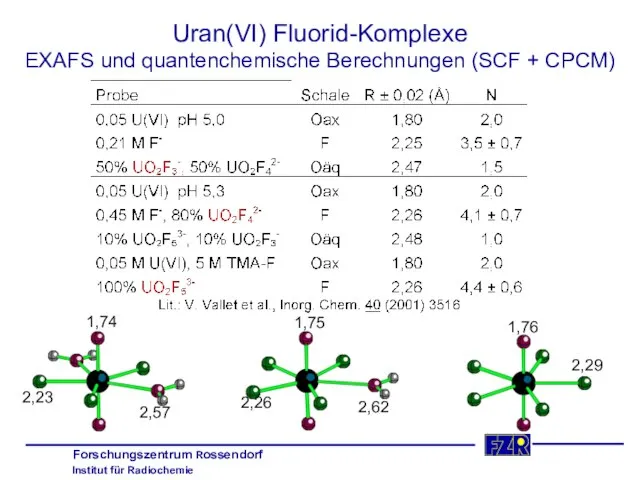
- 24. Uran(VI) Fluorid-Komplexe EXAFS und quantenchemische Berechnungen (SCF + CPCM) 1,76 2,29 1,75 2,26 2,62 1,74 2,23
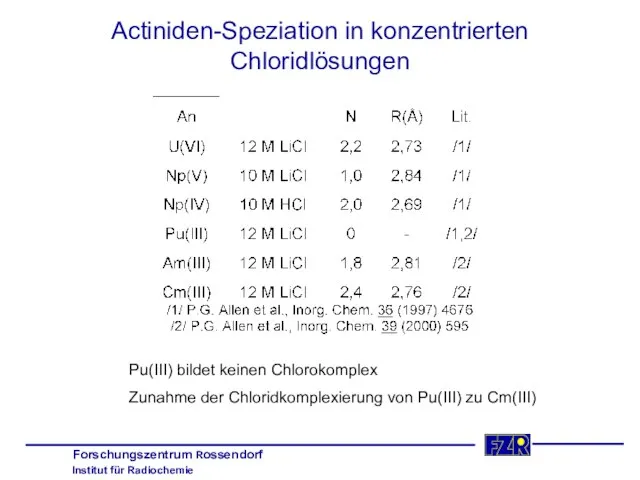
- 25. Actiniden-Speziation in konzentrierten Chloridlösungen Pu(III) bildet keinen Chlorokomplex Zunahme der Chloridkomplexierung von Pu(III) zu Cm(III)
- 26. Carbonat- und Nitratkomplexe vierwertiger Actiniden
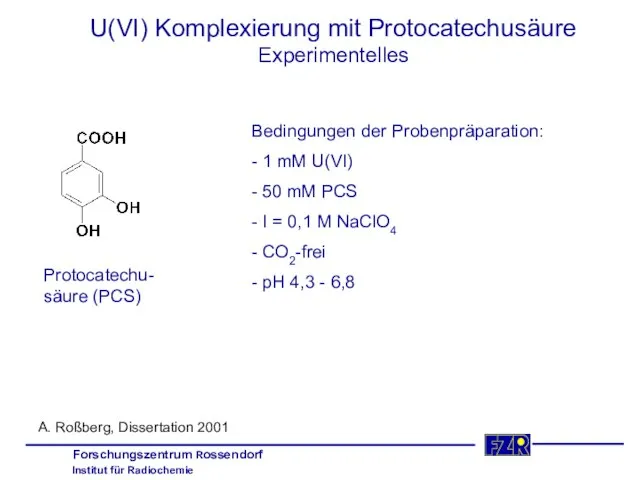
- 27. U(VI) Komplexierung mit Protocatechusäure Experimentelles Protocatechu- säure (PCS) Bedingungen der Probenpräparation: - 1 mM U(VI) -
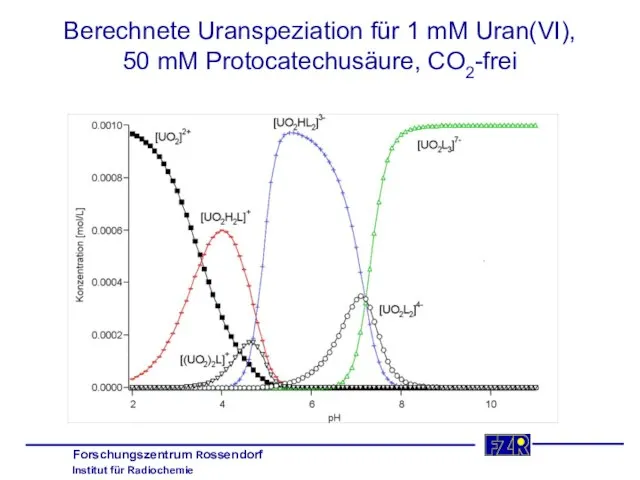
- 28. Berechnete Uranspeziation für 1 mM Uran(VI), 50 mM Protocatechusäure, CO2-frei
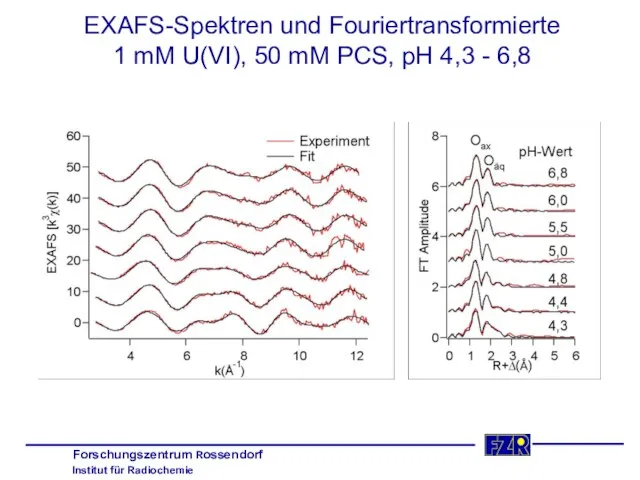
- 29. EXAFS-Spektren und Fouriertransformierte 1 mM U(VI), 50 mM PCS, pH 4,3 - 6,8
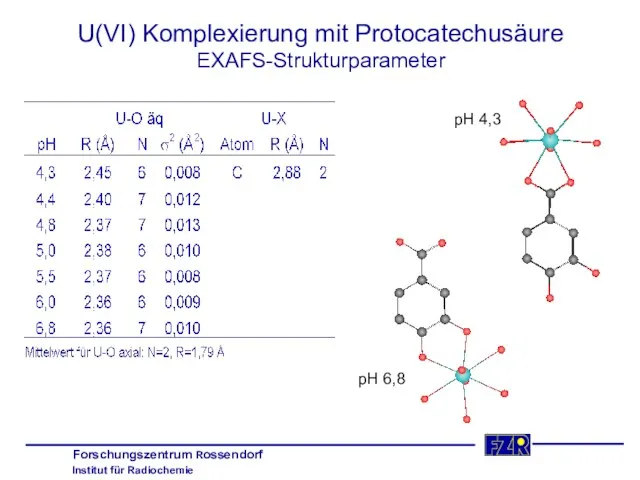
- 30. U(VI) Komplexierung mit Protocatechusäure EXAFS-Strukturparameter pH 4,3 pH 6,8
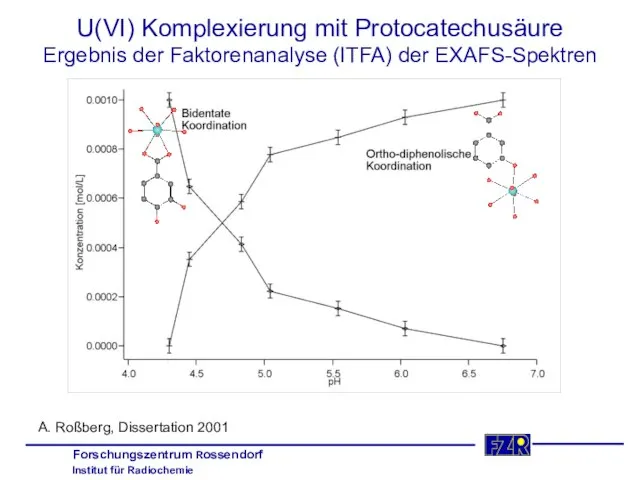
- 31. U(VI) Komplexierung mit Protocatechusäure Ergebnis der Faktorenanalyse (ITFA) der EXAFS-Spektren A. Roßberg, Dissertation 2001
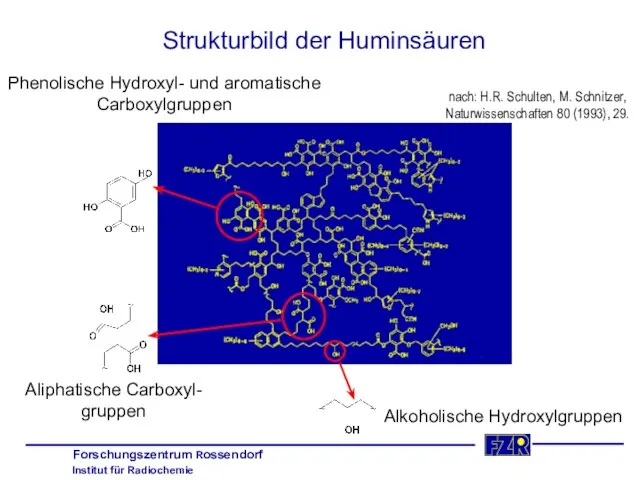
- 32. Strukturbild der Huminsäuren Aliphatische Carboxyl- gruppen Alkoholische Hydroxylgruppen Phenolische Hydroxyl- und aromatische Carboxylgruppen nach: H.R. Schulten,
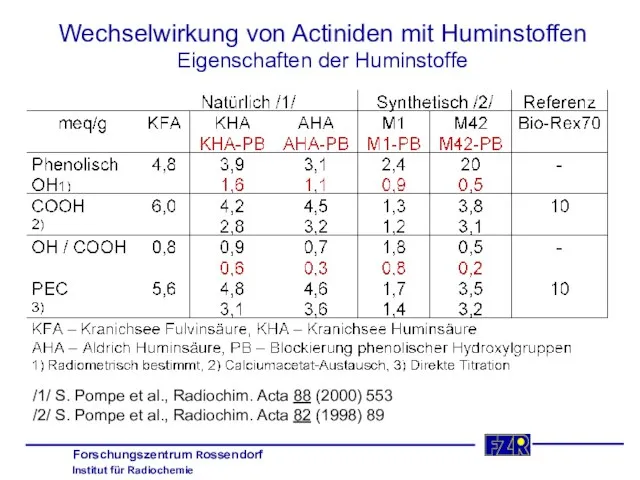
- 33. Wechselwirkung von Actiniden mit Huminstoffen Eigenschaften der Huminstoffe /1/ S. Pompe et al., Radiochim. Acta 88
- 34. Präparation der Np(V) Humatlösungen Huminsäure (HS) Natürliche Aldrich HS (AHA) 8,1 g/L Modifizierte AHA mit blockierten
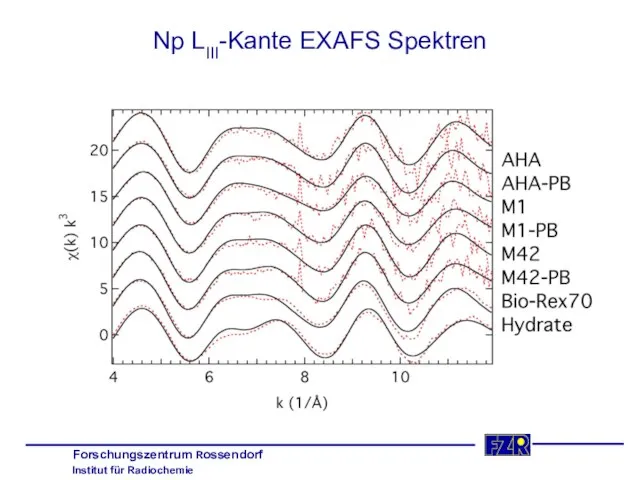
- 35. Np LIII-Kante EXAFS Spektren
- 36. Vergleich der mittleren Np-O Bindungslängen in Å Np(V) Carboxylate - XRD an Einkristallen Axialer Sauerstoff 1,84
- 37. Na+ [SiO4] [Al(O/OH)6] Struktur von Na-Montmorillonit Mögliche Sorptionsmechnismen Innersphärisch Außersphärisch Ausfällungen
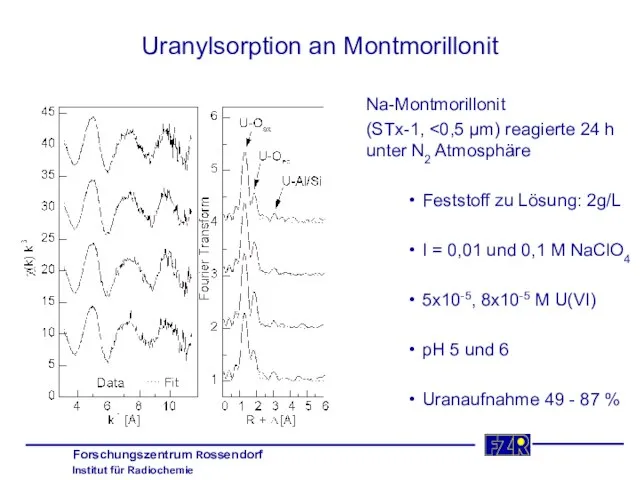
- 38. Uranylsorption an Montmorillonit Na-Montmorillonit (STx-1, Feststoff zu Lösung: 2g/L I = 0,01 und 0,1 M NaClO4
- 39. C. Hennig et al., Radiochim. Acta (angenommen) Strukturparameter von UO22+ sorbiert an Montmorillonit Ergebnisse der EXAFS-Analyse
- 40. Schlussfolgerungen und Ausblick Die Röntgenabsorptionsspektroskopie (EXAFS und XANES) mit Synchrotronstrahlung ermöglicht die elementspezifische Untersuchung der Speziation
- 41. Schlussfolgerungen und Ausblick Die EXAFS- und XANES-Spektroskopie finden immer stärkere Anwendung auf vielen Gebieten der Actinidenchemie,
- 42. Schlussfolgerungen und Ausblick Die Ergebnisse der spektroskopischen Speziation mit Synchrotronstrahlung sind wichtig für andere Untersuchungen, z.B.:
- 43. Schlussfolgerungen und Ausblick Durch die Entwicklung und Anpassung entsprechender Sicherheitskonzepte für den Umgang mit radioaktiven Proben
- 44. Schlussfolgerungen und Ausblick Spezielle Radiochemiemessplätze entstanden bzw. sind in der Planung Radiochemiemessplatz am Rossendorfer Synchrotronstrahlrohr ROBL
- 46. Скачать презентацию















![Na+ [SiO4] [Al(O/OH)6] Struktur von Na-Montmorillonit Mögliche Sorptionsmechnismen Innersphärisch Außersphärisch Ausfällungen](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/614933/slide-36.jpg)






 Тестовые вопросы по физике 1-35
Тестовые вопросы по физике 1-35 Ядерная энергетика в автомобилях. Машины с ядерными двигателями
Ядерная энергетика в автомобилях. Машины с ядерными двигателями Характеристика автомобиля как объекта ремонта
Характеристика автомобиля как объекта ремонта Производная в технике, физике и химии
Производная в технике, физике и химии Правка, разметка и резание заготовок из тонколистового металла и проволоки
Правка, разметка и резание заготовок из тонколистового металла и проволоки Антенные решетки. (Лекция 7)
Антенные решетки. (Лекция 7) Магнитное поле
Магнитное поле Термодинаміка. Внутрішня енергія
Термодинаміка. Внутрішня енергія Атом. Состав атомного ядра
Атом. Состав атомного ядра Магниттік күштік микроскопия
Магниттік күштік микроскопия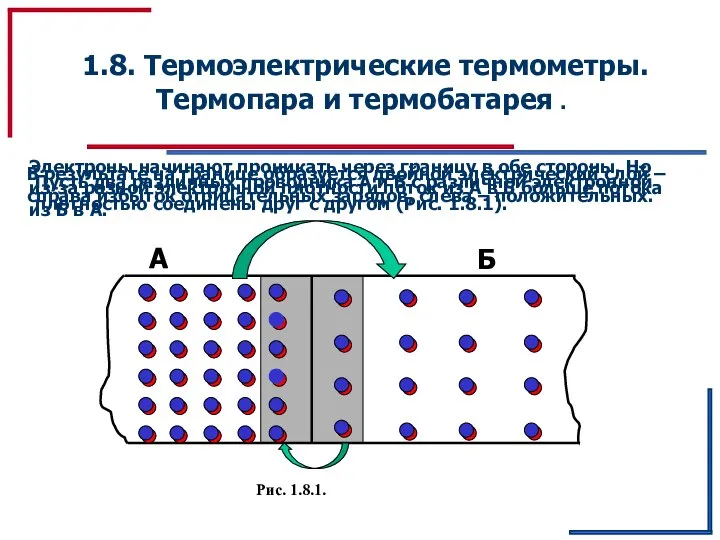 Термоэлектрические термометры. Термопара и термобатарея
Термоэлектрические термометры. Термопара и термобатарея Величины, характеризующие колебательное движение Сформировать знания у школьников о частоте колебаний, амплитуде, периоде, фазе.
Величины, характеризующие колебательное движение Сформировать знания у школьников о частоте колебаний, амплитуде, периоде, фазе. Физические приборы
Физические приборы Аттестационная работа. Программа внедрения инновационных бизнес-технологий, проект: «Новой школе - бизнестехнологии»
Аттестационная работа. Программа внедрения инновационных бизнес-технологий, проект: «Новой школе - бизнестехнологии» Многогрупповое приближение. Технология получения групповых констант. Понятие спектра свертки. Стандартные спектры
Многогрупповое приближение. Технология получения групповых констант. Понятие спектра свертки. Стандартные спектры Жидкости. Строение и свойства жидкостей
Жидкости. Строение и свойства жидкостей Задачи по статике. (10 класс)
Задачи по статике. (10 класс) Типы спектров и постулаты бора
Типы спектров и постулаты бора Жылу және электр энергиясын жинап сақтау
Жылу және электр энергиясын жинап сақтау Механическое движение
Механическое движение Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности
Постоянный электрический ток. Характеристики электрической цепи. Действие электрического тока и правила техники безопасности Реальный колебательный контур. Визуальная часть. Приложение.
Реальный колебательный контур. Визуальная часть. Приложение. Основные параметры и характеристики передающих антенн
Основные параметры и характеристики передающих антенн Спин – орбитальная связь
Спин – орбитальная связь Мореходность
Мореходность Ағындардың гидродинамикалық құрылымы. Химиялық аппараттарда ағын бөлшектерінің жылдамдығы мен болу уақыты
Ағындардың гидродинамикалық құрылымы. Химиялық аппараттарда ағын бөлшектерінің жылдамдығы мен болу уақыты Радиоволны и радио
Радиоволны и радио Презентация по физике Магнитное поле земли
Презентация по физике Магнитное поле земли