Содержание
- 2. ЛЕКЦИЯ 17. СПИН – ОРБИТАЛЬНАЯ СВЯЗЬ. А.И. Валишев
- 3. МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ В МНОГОЭЛЕКТРОННОМ АТОМЕ.
- 4. Виды взаимодействий Виды взаимодействий в многоэлектронном атоме Помимо кулоновского взаимодействия электронов с ядром имеется: Кулоновское межэлектронное
- 5. МЕТОД САМОСОГЛАСОВАННОГО ПОЛЯ.
- 6. Метод самосогласованного поля. МССП Попарное взаимодействие электронов учитывается как эффективное взаимодействие единственного электрона с осредненным центральным
- 7. Метод самосогласованного поля. МССП В отсутствии межэлектронного взаимодействия: h – одноэлектронный потенциал i – го состояния.
- 8. Метод самосогласованного поля. МССП Отношение энергии взаимодействия всех пар электронов (всего пар Z(Z-1)/2 штук) к полной
- 9. Метод самосогласованного поля. МССП Вид «самосогласованного» потенциала:
- 10. Метод самосогласованного поля. МССП Результат. 3. Кулоновское вырождение по орбитальному моменту и проекции момента снимается. В
- 11. СПИН – ОРБИТАЛЬНОЕ ВЗАИМОДЕЙСТВИЕ.
- 12. Приближение LS связи Спин – орбитальное взаимодействие приближенно моделируется взаимодействием полного орбитального магнитного момента атома (магнитный
- 13. Приближение LS связи Орбитальное движение ядра в системе «покоящегося электрона. «Покоящийся электрон со спиновым магнитным моментом
- 14. Приближение LS связи
- 15. Приближение LS связи Состояние всего набора электронов в атоме приближенно зависит от квантовых чисел полного орбитального
- 16. Приближение LS связи Интегралы движения – J = L + S Квадрат полного орбитального момента L2
- 17. Приближение LS связи Полный орбитальный момент L не является интегралом движения – не сохраняется – т.к.
- 18. Приближение LS связи Полное число компонент на которое расщепляется уровень энергии с заданными L, S -
- 19. РАСЧЕТ ПОПРАВКИ LS СВЯЗИ.
- 20. Поправка LS связи Оператор LS взаимодействия в обкладках ВФ с квантовыми числами J, MJ Необходимо: 1.определить
- 21. Поправка LS связи Собственные числа оператора (L⋅S)
- 22. Поправка LS связи Осреднение 1/r3 в обкладках радиальных ВФ
- 23. Поправка LS связи Пример. Осреднение 1/r3 для 2p состояния (n=2, l=1)
- 24. Поправка LS связи Окончательно: поправка ΔWLS
- 25. Поправка LS связи Расщепление уровня с заданными L, S - ΔWLS δE = A/2⋅J – правило
- 26. ОБОЛОЧЕЧНАЯ МОДЕЛЬ.
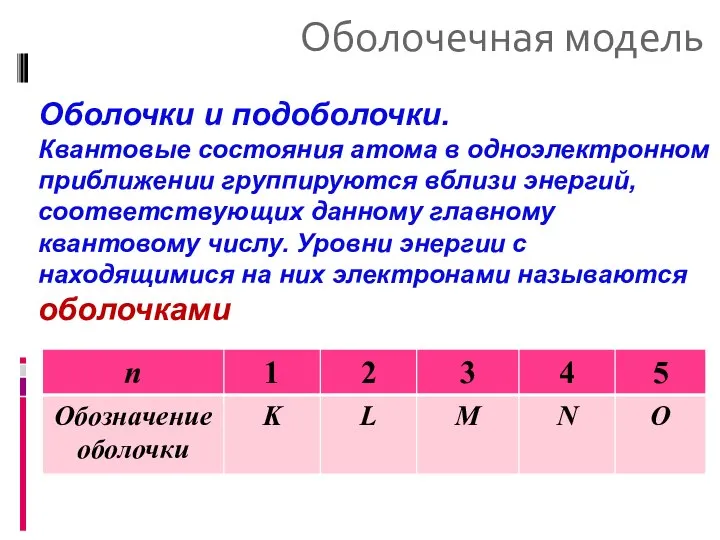
- 27. Оболочечная модель Оболочки и подоболочки. Квантовые состояния атома в одноэлектронном приближении группируются вблизи энергий, соответствующих данному
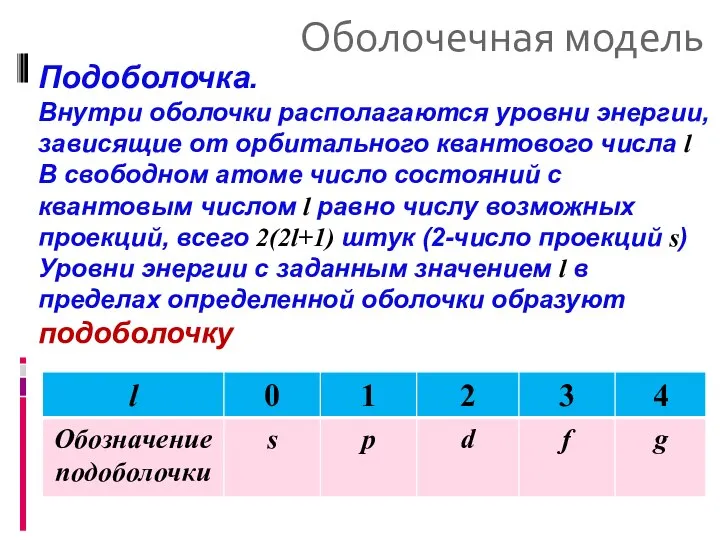
- 28. Оболочечная модель Подоболочка. Внутри оболочки располагаются уровни энергии, зависящие от орбитального квантового числа l В свободном
- 29. Оболочечная модель Максимальное число электронов. Максимальное число электронов в подоболочке - 2(2l+1) Квантовое число l меняется
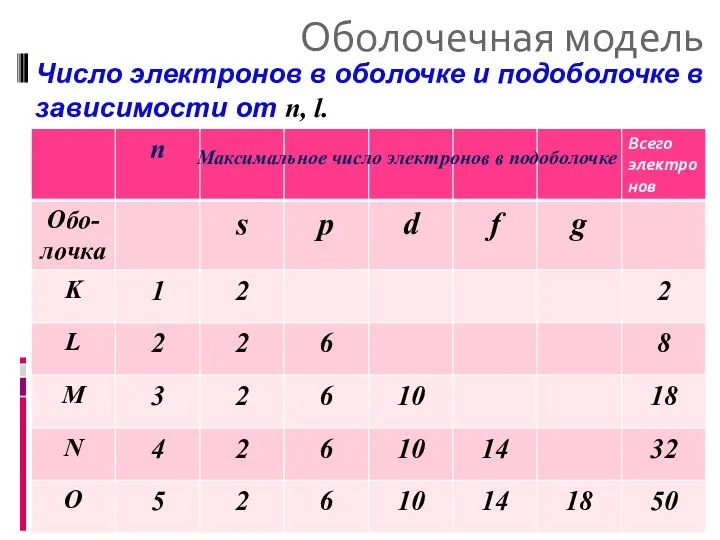
- 30. Оболочечная модель Число электронов в оболочке и подоболочке в зависимости от n, l. Максимальное число электронов
- 31. Оболочечная модель Df. Полностью заполненные оболочки называются замкнутыми. Электроны замкнутых оболочек слабо взаимодействуют с электронами других
- 32. ЭЛЕКТРОННЫЕ КОНФИГУРАЦИИ.
- 33. Электронные конфигурации Df.Состояния отдельных электронов в атоме обозначаются символами n l y . n – главное
- 34. ТЕРМ. МУЛЬТИПЛЕТНОСТЬ ТЕРМА.
- 35. Терм Уровни из набора (2L+1)(2S+1) штук, принад-лежащие определенной электронной конфи-гурации с заданными L, S называется термами.
- 36. Терм Число уровней: Синглетный терм S = 0 Дублет S = 1 Триплет S = 2
- 37. Терм Заполненная (замкнутая) оболочка имеет L = 0 и S = 0. Тогда проекции Lz и
- 38. Терм Наиболее просто определяются термы электронов на незаполненных оболочках с различными n, l – в этом
- 39. ПРАВИЛА ХУНДА.
- 40. Правила Хунда Терм при данной конфигурации, соответствующий наименьшей энергии. Df. 1. Из всех термов данной конфигурации
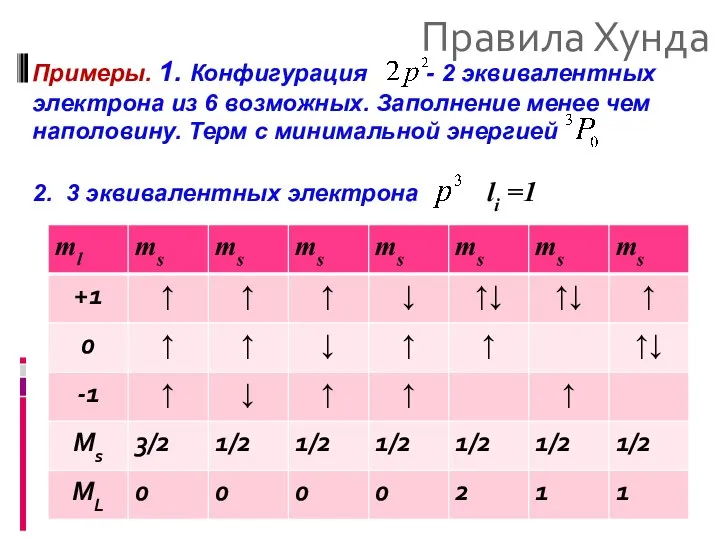
- 41. Правила Хунда Примеры. 1. Конфигурация - 2 эквивалентных электрона из 6 возможных. Заполнение менее чем наполовину.
- 42. Правила Хунда 2. 3 эквивалентных электрона 3 терма:
- 43. Правила Хунда Результаты справедливы при слабой L, S связи. Расстояние между подуровнями тонкой структуры в спектре
- 44. Интернет ресурс http//:edu.ci.nsu.ru Курс лекций Задачник
- 46. Скачать презентацию







































 Презентация по физике "Удельная теплота сгорания" - скачать бесплатно
Презентация по физике "Удельная теплота сгорания" - скачать бесплатно Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Жизнь А.Эйнштейна: 1.Научная деятельность.
Жизнь А.Эйнштейна: 1.Научная деятельность. Взаимодействие излучения с атомными системами
Взаимодействие излучения с атомными системами Объектное демонстрирование эффекта Доплера для звуковых волн
Объектное демонстрирование эффекта Доплера для звуковых волн Энтропия и вероятность. Статистический характер необратимых процессов
Энтропия и вероятность. Статистический характер необратимых процессов Распространение плоских волн в гиротропных средах
Распространение плоских волн в гиротропных средах Быстрые переключения нелинейных систем
Быстрые переключения нелинейных систем Комплексное электрофизическое воздействие на призабойную зону с целью добычи трудноизвлекаемой нефти
Комплексное электрофизическое воздействие на призабойную зону с целью добычи трудноизвлекаемой нефти Нестационарная теплопроводность
Нестационарная теплопроводность Физика в системе естественных наук. Кинематика поступательного движения. (Лекция 1)
Физика в системе естественных наук. Кинематика поступательного движения. (Лекция 1) Презентация по физике "Решение задач по теме: «Механическая работа. Мощность»." - скачать бесплатно
Презентация по физике "Решение задач по теме: «Механическая работа. Мощность»." - скачать бесплатно Лазеры. Принцип действия
Лазеры. Принцип действия Кинематика материальной точки
Кинематика материальной точки Toyota. Motors: drive (x2) & lifting - block diagram
Toyota. Motors: drive (x2) & lifting - block diagram Плотность вещества
Плотность вещества Отсчёт по практике. Электричество
Отсчёт по практике. Электричество Явление тяготения. Сила тяжести
Явление тяготения. Сила тяжести Динамика материальной точки
Динамика материальной точки Сила упругости
Сила упругости Қан айналымды зерттеу әдістері. Интегралдық және регионарлық реография. Реография
Қан айналымды зерттеу әдістері. Интегралдық және регионарлық реография. Реография Колебания и волны. Квантовая физика
Колебания и волны. Квантовая физика Изучение конструкции и исследование цилиндрическими редуктора зубчатыми колесами
Изучение конструкции и исследование цилиндрическими редуктора зубчатыми колесами Закон Ома для однорідної ділянки кола
Закон Ома для однорідної ділянки кола Расчет эквивалентных сопротивлений линейных бесконечных цепей
Расчет эквивалентных сопротивлений линейных бесконечных цепей Кинематика точки
Кинематика точки Объём тела
Объём тела Галилео Галилей
Галилео Галилей