Содержание
- 2. Принцип детального равновесия При статистическом описании равновесных состояний широко используется принцип детального равновесия: любой микроскопический процесс
- 3. Функции распределения молекул В статистической физике важное значение имеет установление вида функции распределения молекул по какому-либо
- 4. Плотность вероятности Функция f(v) называется также плотностью вероятности, поскольку
- 5. Среднее значение физической величины Зная функцию распределения молекул f(x) по параметру x, можно найти среднее значение
- 6. Нормировка функции распределения Считается, что для функции распределения f(x) выполняется условие нормировки:
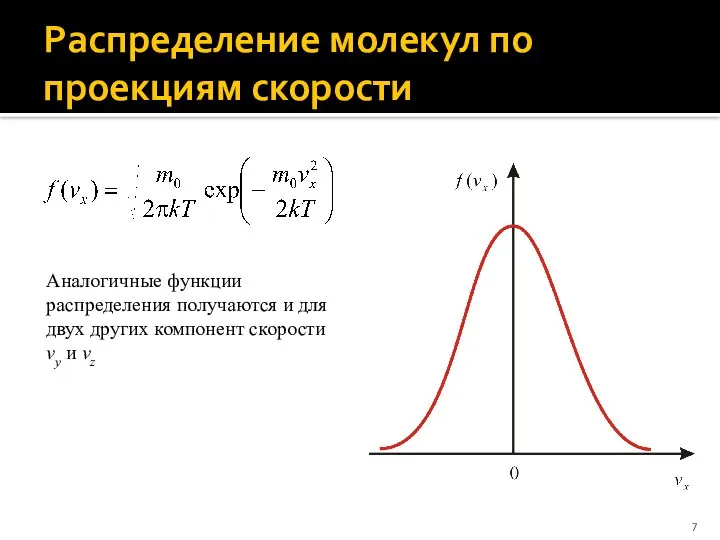
- 7. Распределение молекул по проекциям скорости Аналогичные функции распределения получаются и для двух других компонент скорости vy
- 8. Функция распределения f(vx,vy,vz)
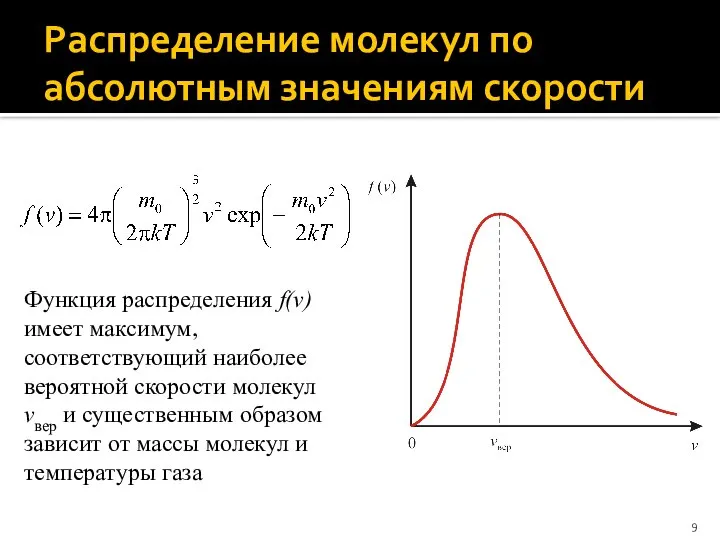
- 9. Распределение молекул по абсолютным значениям скорости Функция распределения f(v) имеет максимум, соответствующий наиболее вероятной скорости молекул
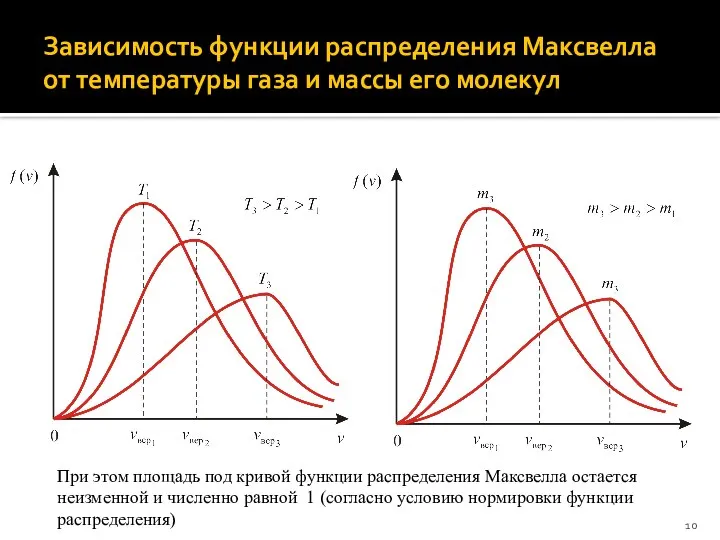
- 10. Зависимость функции распределения Максвелла от температуры газа и массы его молекул При этом площадь под кривой
- 11. Характерные скорости молекул: наиболее вероятная скорость
- 12. Характерные скорости молекул: средняя скорость
- 13. Характерные скорости молекул: средняя квадратичная скорость
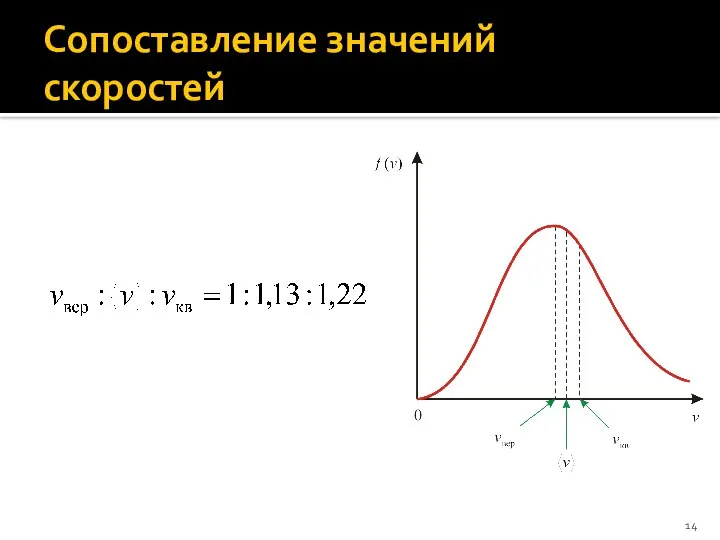
- 14. Сопоставление значений скоростей
- 15. Распределение молекул по величинам безразмерной скорости
- 16. Распределение молекул по значениям импульса
- 17. Распределение молекул по значениям кинетической энергии поступательного движения
- 18. 2.2 Распределение Больцмана ЛЕКЦИЯ 2. СТАТИСТИЧЕСКИЕ РАСПРЕДЕЛЕНИЯ
- 19. Распределение Больцмана Если термодинамическая система, находящаяся в равновесном состоянии, помещена в силовой поле, то распределение молекул
- 20. Распределение Больцмана Число молекул, находящихся в пределах бесконечно малого объема dV = dxdydz, расположенного в окрестности
- 21. 2.3 Барометрическая формула ЛЕКЦИЯ 2. СТАТИСТИЧЕСКИЕ РАСПРЕДЕЛЕНИЯ
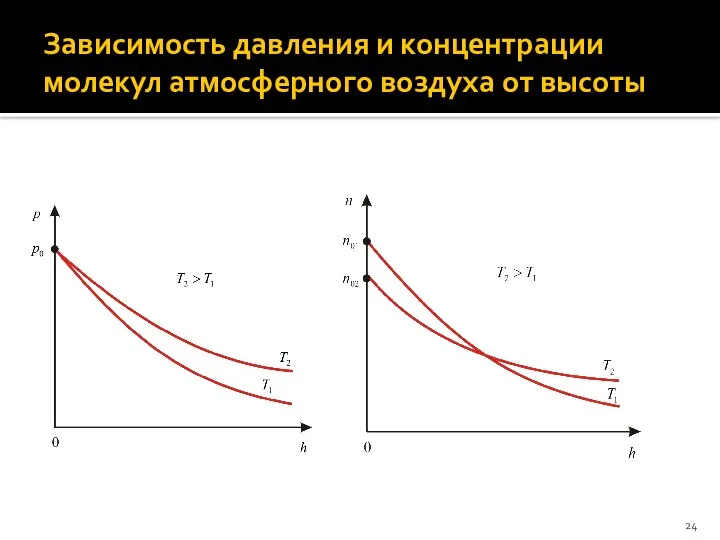
- 22. Барометрическая формула Из распределения Больцмана следует барометрическая формула, описывающая изменение давления атмосферного воздуха с высотой h:
- 23. Предположения, при которых получена барометрическая формула: Воздух является идеальным газом, т.е. для него выполняется уравнение Менделеева
- 24. Зависимость давления и концентрации молекул атмосферного воздуха от высоты
- 25. 2.4 Распределение Максвелла – Больцмана ЛЕКЦИЯ 2. СТАТИСТИЧЕСКИЕ РАСПРЕДЕЛЕНИЯ
- 26. Распределение Максвелла – Больцмана Распределение Максвелла и распределение Больцмана можно объединить в одно обобщенное распределение Макселла
- 28. Скачать презентацию




















 Радиоактивность. Строение атома
Радиоактивность. Строение атома Физические основы действия ионизирующих излучений на организм
Физические основы действия ионизирующих излучений на организм Влияние современной оптики на качество фотоснимков. Рекомендации пользователям
Влияние современной оптики на качество фотоснимков. Рекомендации пользователям Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения
Применение ядерной энергии в различных отраслях. Доза радиоактивного излучения Делимость электрического заряда. Электрон
Делимость электрического заряда. Электрон Расчет гармонических колебаний в электрических цепях
Расчет гармонических колебаний в электрических цепях Корректировка знаний
Корректировка знаний Выбор тока срабатывания МТЗ
Выбор тока срабатывания МТЗ Презентация по физике "Что такое теплопередача и теплопроводность?" - скачать
Презентация по физике "Что такое теплопередача и теплопроводность?" - скачать  PowerPoint Template
PowerPoint Template Механическая работа. Мощность. Энергия. Задачи
Механическая работа. Мощность. Энергия. Задачи Квантовая механика
Квантовая механика Оптика. Геометрическая оптика
Оптика. Геометрическая оптика Анализ причин разрушения и методов повышения износостойкости деталей запорной арматуры систем промыслового сбора
Анализ причин разрушения и методов повышения износостойкости деталей запорной арматуры систем промыслового сбора МОЛЕКУЛЯРНАЯ ФИЗИКА .
МОЛЕКУЛЯРНАЯ ФИЗИКА .  Тепловые двигатели и нагнетатели. Компрессоры
Тепловые двигатели и нагнетатели. Компрессоры Электризация тел. Два рода электрического заряда
Электризация тел. Два рода электрического заряда Агрегаты наддува двигателей
Агрегаты наддува двигателей Методы наблюдения и регистрации элементарных частиц
Методы наблюдения и регистрации элементарных частиц Эффект Кондо
Эффект Кондо Спектрофотометрия видимой области спектра
Спектрофотометрия видимой области спектра Технология бурения горизонтальной скважины с применением роторной управляемой системы
Технология бурения горизонтальной скважины с применением роторной управляемой системы Механические волны. Звуковые волны
Механические волны. Звуковые волны Современные проблемы, перспективы развития науки о наноматериалах
Современные проблемы, перспективы развития науки о наноматериалах Матричный формализм квантовой механики – теория представлений
Матричный формализм квантовой механики – теория представлений Электростатика
Электростатика Урок 1. Тема: Что такое нано? Элективный курс «Первые шаги в наномир»
Урок 1. Тема: Что такое нано? Элективный курс «Первые шаги в наномир»  Учебный курс
Учебный курс