Содержание
- 2. Как устроен атом? Дж. Томсон 1904г Э. Резерфорд 1911г Н. Бор 1913г
- 3. Опыт Резерфорда 1911 г. Резерфордом в результате опытов по рассеянию α-частиц на тонкой фольге (золото, серебро,
- 4. Планетарная модель атома Согласно этой модели: атом имеет положительно заряженное ядро, размеры которого малы по сравнению
- 5. Планетарная модель, однако, противоречит классической физике. Электрон, вращаясь с центростремительным ускорением, излучает электромагнитные волны, и это
- 6. Постулаты Бора
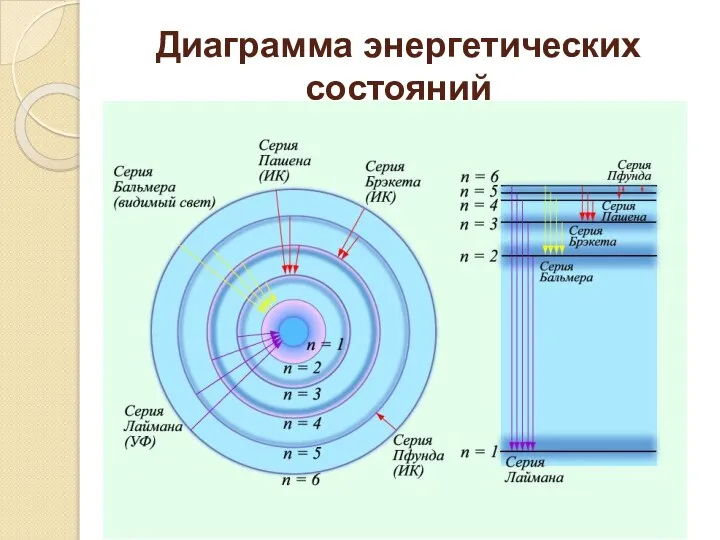
- 7. Диаграмма энергетических состояний
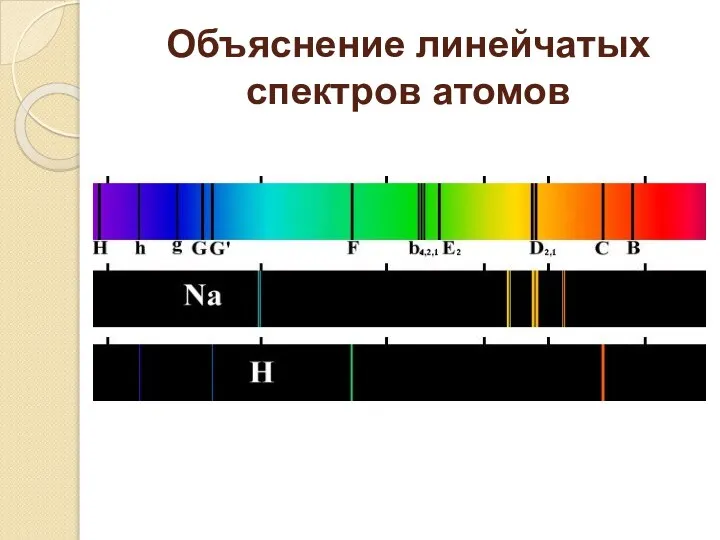
- 8. Объяснение линейчатых спектров атомов
- 9. Следствия постулатов Бора Стабильность атома объясняется тем, что для каждого электрона в атоме существует орбита с
- 11. Скачать презентацию






 Кристаллические и аморфные тела
Кристаллические и аморфные тела Энергия движущейся воды и ветра
Энергия движущейся воды и ветра Тема: Приборы по физике своими руками и простые опыты с ними. Работу выполнил: ученик 9 класса- Давыдов Рома Руководитель: учит
Тема: Приборы по физике своими руками и простые опыты с ними. Работу выполнил: ученик 9 класса- Давыдов Рома Руководитель: учит Роботу виконала учениця 11-А класу Мельніченко Юлія
Роботу виконала учениця 11-А класу Мельніченко Юлія  Задания из ЕГЭ по физике за 2006 год
Задания из ЕГЭ по физике за 2006 год Второй закон Ньютона.
Второй закон Ньютона.  Лекционный курс «физические основы измерений и эталоны». Охлаждение при расширении газов. Эффект джоуля-томсона
Лекционный курс «физические основы измерений и эталоны». Охлаждение при расширении газов. Эффект джоуля-томсона Електричний струм в газах Підготувала Учениця 11-Б класу Криворізькоі гімназіі №49 Махіна Марія
Електричний струм в газах Підготувала Учениця 11-Б класу Криворізькоі гімназіі №49 Махіна Марія  Molecular-kinetic theory of ideal gases
Molecular-kinetic theory of ideal gases Никола Тесла (1856-1943)
Никола Тесла (1856-1943) Интерференция света. Пространственно-временная когерентность. Лекция 15(1)
Интерференция света. Пространственно-временная когерентность. Лекция 15(1) Атомы во внешнем магнитном поле. Магнитный момент атома. Спин электрона. Векторная модель атома
Атомы во внешнем магнитном поле. Магнитный момент атома. Спин электрона. Векторная модель атома Проверка формул по физике. 7 класс
Проверка формул по физике. 7 класс Бегом по радуге. Игра-состязание по физике среди 8 классов
Бегом по радуге. Игра-состязание по физике среди 8 классов Продолжение молекулярной физики
Продолжение молекулярной физики Курение, с точки зрения физики
Курение, с точки зрения физики Корпускулярные свойства рентгеновского излучения
Корпускулярные свойства рентгеновского излучения Экспериментальные факты, лежащие в основе теории магнетизма
Экспериментальные факты, лежащие в основе теории магнетизма Лампы накаливания
Лампы накаливания Уравнения теории упругости. Закон Гука для изотропного тела. Упругие постоянные. Объемная деформация. (Лекция 4)
Уравнения теории упругости. Закон Гука для изотропного тела. Упругие постоянные. Объемная деформация. (Лекция 4) Закон сохранения и превращения энергии.
Закон сохранения и превращения энергии. Плотность веществ
Плотность веществ Электрический ток в полупроводниках
Электрический ток в полупроводниках Робота електричного струму
Робота електричного струму Заттың агрегаттық күйлерінің өзгеруі. 8 сынып
Заттың агрегаттық күйлерінің өзгеруі. 8 сынып Механическая работа. Единицы работы. Мощность. Единицы мощности
Механическая работа. Единицы работы. Мощность. Единицы мощности Application of Variational Integrators in Modeling the Dynamics of Mechanical. Systems
Application of Variational Integrators in Modeling the Dynamics of Mechanical. Systems Энергия подводных морских и океанических течений
Энергия подводных морских и океанических течений