Содержание
- 2. Эксперименты, подтверждающие сложное строение атома. 1. Иоганн Бальмер, 1885 г. Наблюдал с помощью трубки Гейсслера в
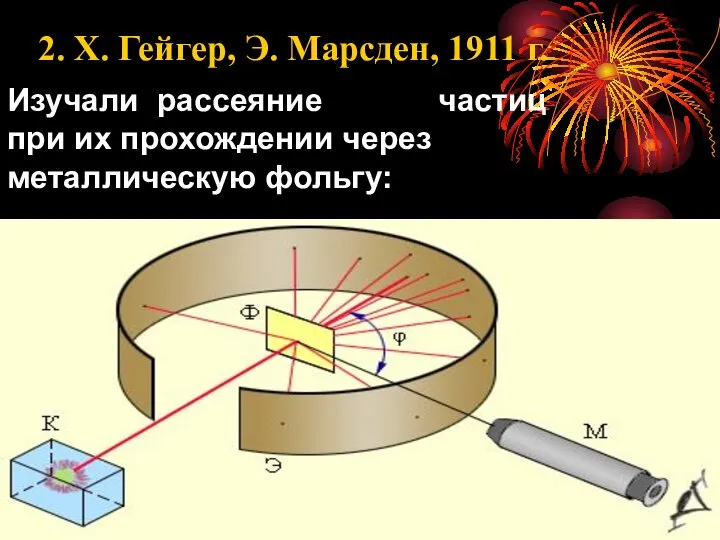
- 3. 2. Х. Гейгер, Э. Марсден, 1911 г. Изучали рассеяние частиц при их прохождении через металлическую фольгу:
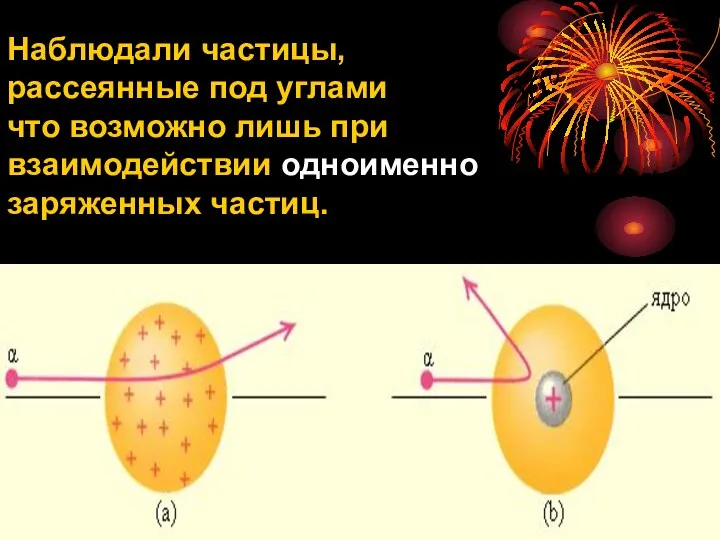
- 4. Наблюдали частицы, рассеянные под углами , что возможно лишь при взаимодействии одноименно заряженных частиц.
- 5. Дж.Дж.Томсон (1903 г.) : атом - положительный шар радиусом , внутри него у положения равновесия колеблются
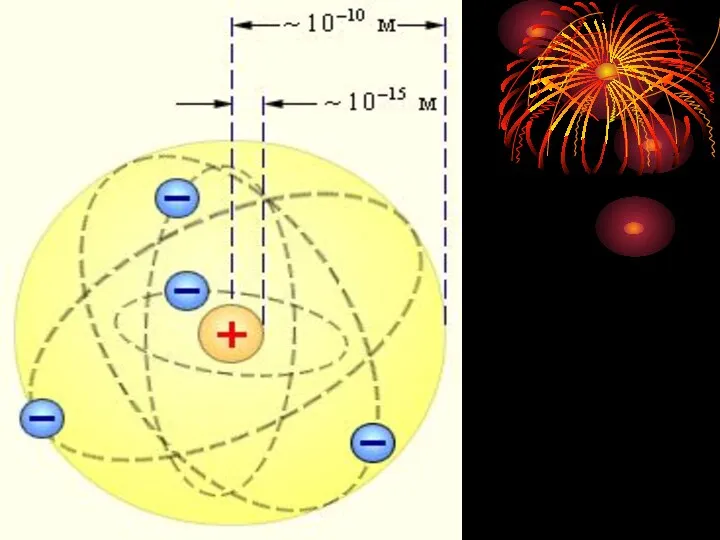
- 6. Эрнест Резерфорд (1911 г.): вокруг положительного ядра с зарядом Zе и размером по замкнутым орбитам с
- 9. Теория атома водорода Нильс Бор, 1913 г. Первый постулат : существуют стационарные состояния атома, в которых
- 10. Второй постулат (правило частот): при переходе атома из одного стационарного состояния в другое излучается или поглощается
- 11. Частота излучаемых (поглощаемых) спектральных линий длина волны спектральных линий
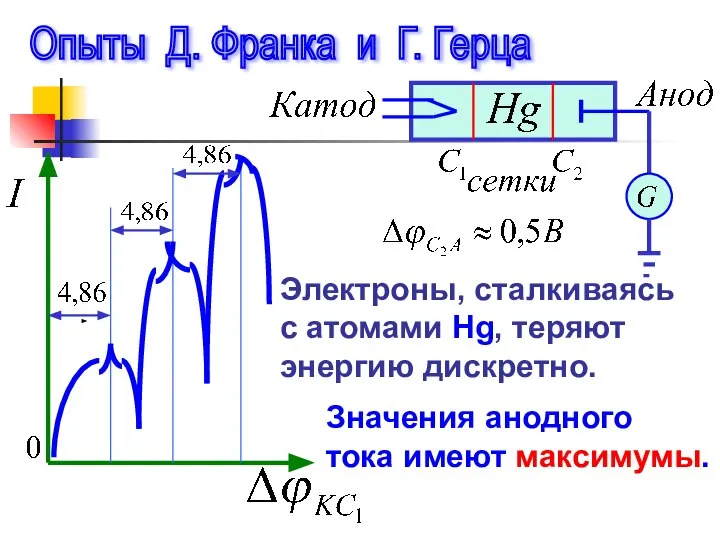
- 12. Дискретность значений энергии атомов экспери- ментально доказана при изучении методом задерживающего потенциала столкновения электронов с атомами
- 13. Опыты Д. Франка и Г. Герца Электроны, сталкиваясь с атомами Hg, теряют энергию дискретно. Значения анодного
- 14. Минимальная энергия, которую может поглотить атом Hg в основном состоянии, равна 4,86 эВ. Возвращаясь из возбужденного
- 15. Задача. Используя теорию Бора, рассчи- тать энергию атома водорода в стационарных состояниях. Первый постулат Бора: Кулоновская
- 16. Решая систему (1-2), получим: радиус ой орбиты электрона радиус первой орбиты; и скорость электрона на ой
- 17. Полная энергия атома кинетическая энергия электрона потенциальная энергия взаимодейст-вия ядра и электрона Учитывая,что получим
- 18. Используя (3), запишем энергию атома водорода для ого стационарного состояния Энергия атома квантуется, т.е. принимает дискретные
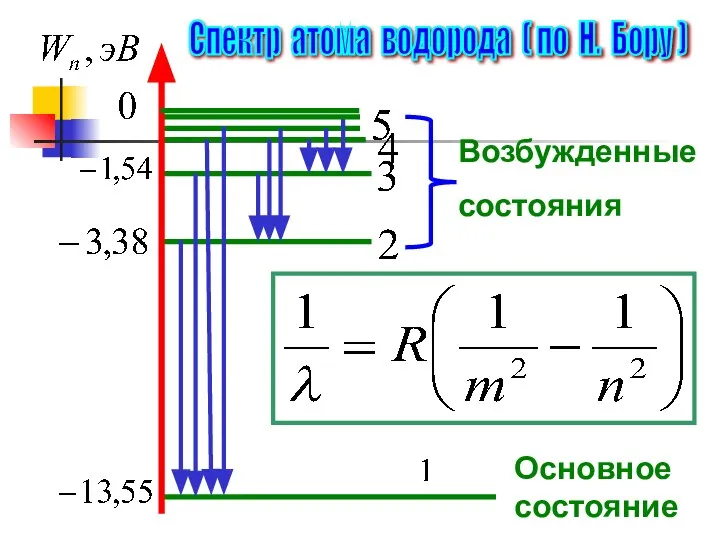
- 20. Возбужденные состояния Основное состояние Спектр атома водорода ( по Н. Бору )
- 21. R – постоянная Ридберга; Линии объединяют в серии. Границы серии определяют
- 22. - Лаймана ( УФ ) - Бальмера (видимая) - Пашена - Брэкета - Пфунда Серии спектральных
- 24. Атом водорода в квантовой механике стационарное уравнение Шредингера. Потенциальная энергия взаимодействия электрона с ядром :
- 25. При решении уравнения (3) для электрона в центральноcиммет-ричном поле используют cфери-ческую СК: Результаты решения уравнения Шредингера
- 26. 2) вектор момента импульса электрона имеет такие ориентации в пространстве, при которых проекция его на направ-ление
- 27. 3)энергия электрона в атоме водорода квантуется радиальное квантовое число. Обозначив , получим совпадение с выводами теории
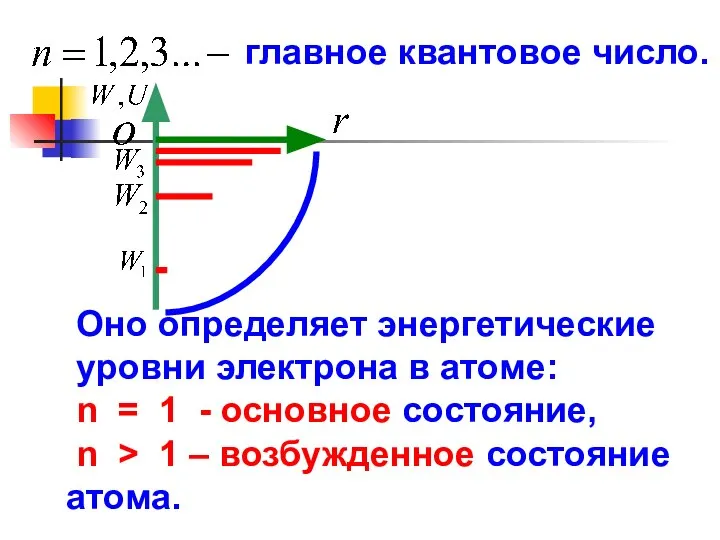
- 28. главное квантовое число. Оно определяет энергетические уровни электрона в атоме: n = 1 - основное состояние,
- 30. Электрон “размазан” по объему атома. Плотность электронного облака определяет вероятность нахождения электрона в разных точках :
- 31. 1S m=0 2S m=0 2p m=0 2p m=1
- 32. Состояния электрона в атоме: s - cостояние; p – состояние; d - состояние; f - состояние.
- 33. Исследуя на экстремум получим,что вероятность обнаружить электрон на расстоянии от ядра – максимальна.
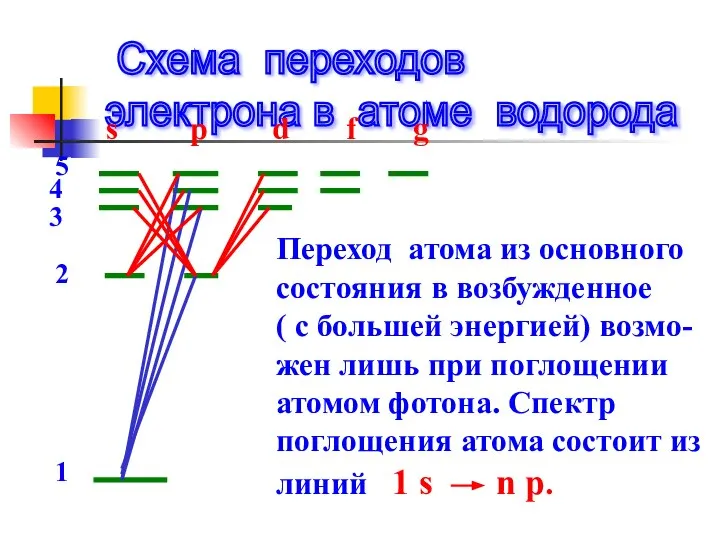
- 34. Правило отбора Ограничивает число возможных переходов электронов в атоме, определяющих излучение или поглощение фотона. Для электрона
- 35. С учетом правила отбора получим переходы для: серии Лаймана серии Бальмера
- 36. Схема переходов электрона в атоме водорода s p d f g 1 2 3 4 5
- 37. Спин электрона О. Штерн, В. Герлах (1922г.) подтвердили прос-транственное квантование в магнитном поле. магнетон Бора. Если
- 38. С. Гаудсмит и Дж. Уленбек (1925г.) предположили наличие у электрона, кроме орбитального , собственного момента импульса
- 39. Спин микрочастицы - квантовая величина, не имеет классического аналога, это внутреннее свойство частицы. Спину электрона соответствует
- 40. Из выводов квантовой механики следует: c п и н к в а н т у е
- 41. Принцип Паули В. Паули (1925г.): в любом атоме не может быть двух электронов с одинаковым набором
- 42. Квантовые числа, определяющие состояние электрона в атоме: главное орбитальное магнитное спиновое
- 43. Периодическая система элементов Д.И. Менделеев ( 1869 г.) Периодичность свойств химических элементов связана с периодичностью расположения
- 44. Положения теории периодической системы: порядковый номер элемента равен числу электронов в атоме; состояние электронов в атоме
- 45. Электронный слой образуют электроны с одинаковым значением главного квантового числа : К – слой , L
- 46. Электронное состояние обозначают символами Состояния с одинаковыми эквивалентны. Число эквивалентных состояний z :
- 47. Какой элемент?
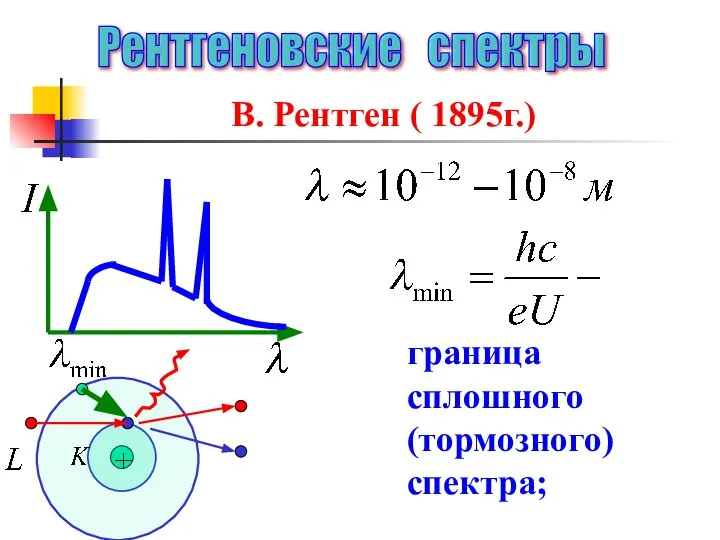
- 48. Рентгеновские спектры В. Рентген ( 1895г.) граница сплошного (тормозного) спектра;
- 49. длина волны линии характеристического спектра. закон Мозли, постоянная экранирования.
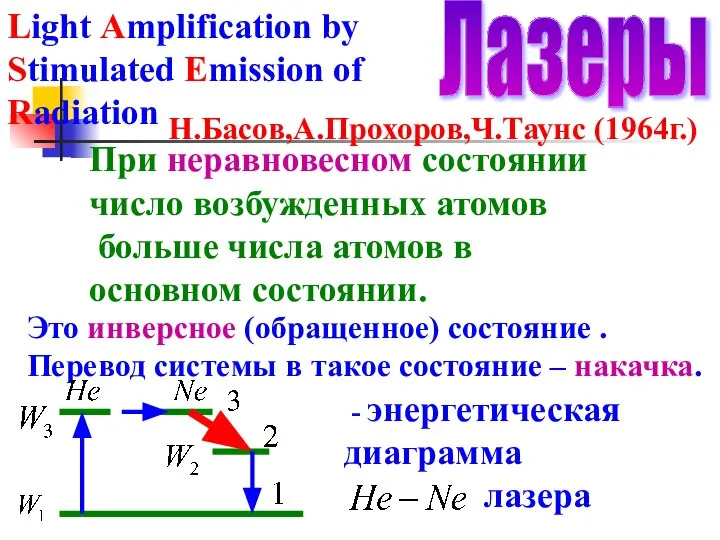
- 50. Лазеры Light Amplification by Stimulated Emission of Radiation Н.Басов,А.Прохоров,Ч.Таунс (1964г.) При неравновесном состоянии число возбужденных атомов
- 51. Электроны при разряде возбуждают атомы , которые сталкиваются с атомами и возбуждают их. Переход дает излучение
- 53. Скачать презентацию





































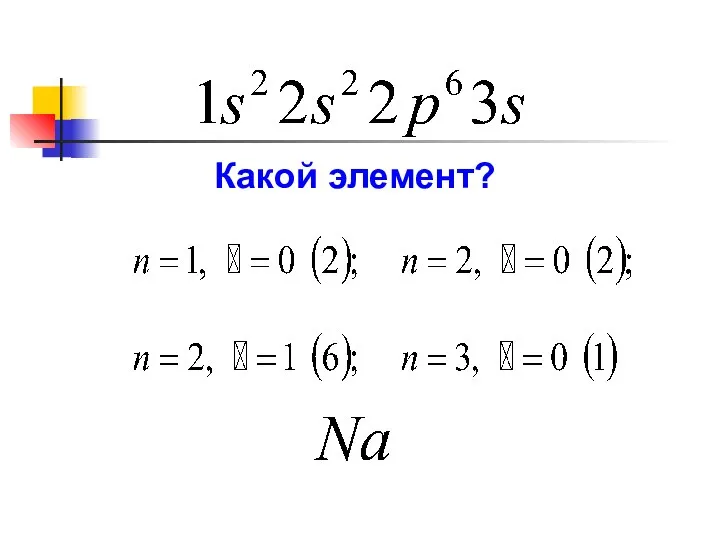


 Философские проблемы науки и техники. Классическая механика. (Лекция 5)
Философские проблемы науки и техники. Классическая механика. (Лекция 5) Магнитное поле Земли
Магнитное поле Земли Рычаг
Рычаг Уклон и конусность
Уклон и конусность Параллельная работа синхронных генераторов. Режим работы электропривода якорно-швартовных механизмов. (Билет 5)
Параллельная работа синхронных генераторов. Режим работы электропривода якорно-швартовных механизмов. (Билет 5) Расчет статически определимых систем на подвижную нагрузку
Расчет статически определимых систем на подвижную нагрузку Относительность движения
Относительность движения Магниторазведка
Магниторазведка Енергія електричного поля
Енергія електричного поля Зависимость силы тока от напряжения
Зависимость силы тока от напряжения Презентация Сила трения.
Презентация Сила трения. Точность различных методов базирования. Требования к деталям поступающим на сборку
Точность различных методов базирования. Требования к деталям поступающим на сборку Монтаж, техническая эксплуатация и ремонт холодильного шкафа для продуктов двухдверного
Монтаж, техническая эксплуатация и ремонт холодильного шкафа для продуктов двухдверного Атомная и ядерная физика
Атомная и ядерная физика Ядерный реактор
Ядерный реактор Перспективы развития атомной энергетики
Перспективы развития атомной энергетики Электрический ток в вакууме. Диод. Работу выполнили: Брюхов А., Нисов А.
Электрический ток в вакууме. Диод. Работу выполнили: Брюхов А., Нисов А.  Физика в военном деле
Физика в военном деле Свободное падение тел. Движение с ускорением свободного падения
Свободное падение тел. Движение с ускорением свободного падения Центр тяжести тела. Условия равновесия тел
Центр тяжести тела. Условия равновесия тел Классификация и параметры ДВС 1
Классификация и параметры ДВС 1 Физика как наука
Физика как наука Презентация по физике "Модели атома" - скачать
Презентация по физике "Модели атома" - скачать  Метрология, стандартизация и сертификация
Метрология, стандартизация и сертификация Амплитуда колебаний в звуковой волне
Амплитуда колебаний в звуковой волне Устройство и технические характеристики тягового двигателя ЭДП810 (СТК 810)
Устройство и технические характеристики тягового двигателя ЭДП810 (СТК 810) Уравнения распространения волн
Уравнения распространения волн Попов – основатель радиовещания
Попов – основатель радиовещания