Содержание
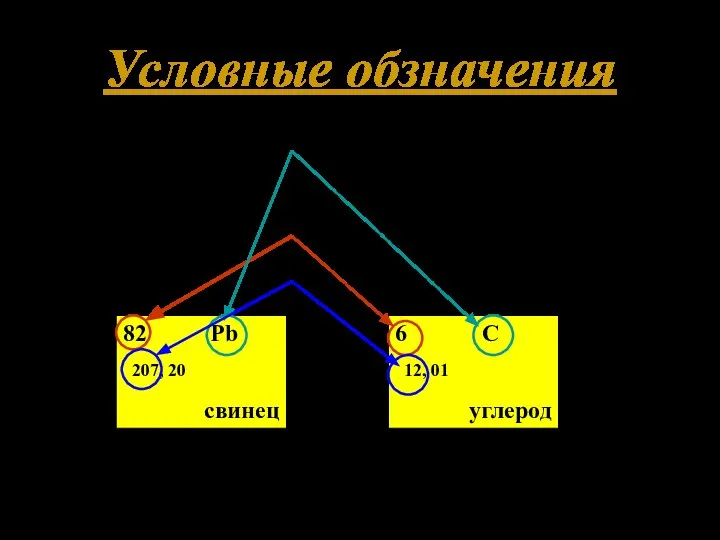
- 2. Условные обзначения X – символ химического элемента, Z – атомный номер, А – массовое число. 82
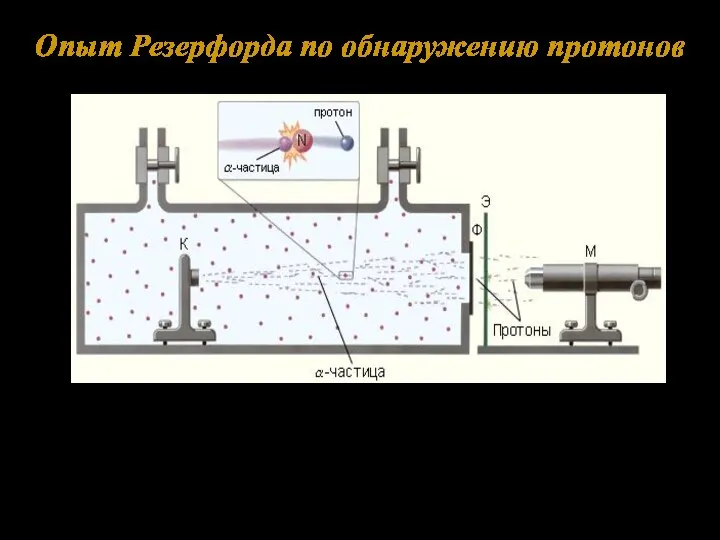
- 3. Опыт Резерфорда по обнаружению протонов Схема опытов в продуктах расщепления ядер: К – свинцовый контейнер с
- 4. Ядерная реакция: - явление расщепления ядер азота при ударах быстрых α-частиц. Протон: Протон Протон, p mp
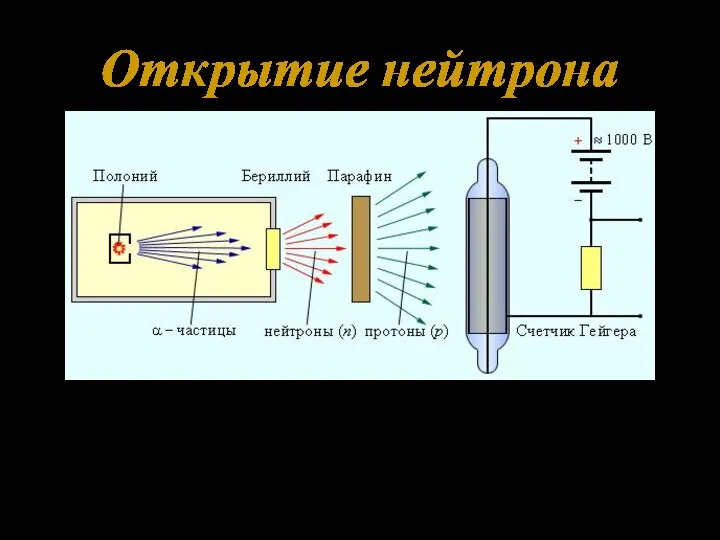
- 5. Открытие нейтрона Схема установки Дж.Чедвика для обнаружения нейтронов
- 6. Ядерная реакция: Нейтрон: Нейтрон Нейтрон, n mn=1,67493·10-27 кг = = 1,008665 а. е. м. =1838,6 me
- 7. Протонно-нейтронная модель ядра Д.Д.Иваненко, В.Гейзенберг – 1932 г. Z – число протонов в составе ядра равно
- 8. Изотопы Атомы химического элемента, отличающиеся друг от друга числом нейтронов в ядре, называются изотопами. У углерода
- 9. Вопросы Почему в таблице Менделеева относительная атомная масса всех элементов выражена дробным числом? Для чего применяются
- 10. Опыт: многие атомы являются устойчивыми. Вопрос: Что удерживает протоны и нейтроны в ядре?
- 11. Ядерные силы Игорь Евгеньевич Тамм, Хидеки Юкава Ядерное (сильное) взаимодействие. R ~ А1/3 ρядра = 2,5.1014
- 12. Ядерные силы Свойства: 1. На расстояниях порядка 10-13см сильные взаимодействия соответствуют притяжению, при уменьшении расстояния –
- 13. Сравнение фундаментальных взаимодействий
- 14. Энергия связи При плавлении льда на 1 молекулу Wсв=0,06эВ При парообразовании воды на 1 молекулу Wсв=0,4эВ
- 15. Энергия связи Для вырывания одного нуклона из ядра 238U 7,5 МэВ 1 МэВ = 106 эВ
- 16. Дефект массы. Опыт: масса любого ядра Mя всегда меньше суммы масс входящих в его состав протонов
- 17. Энергия связи. Энергия связи: Wсв = ΔMc2 = (Zmp + Nmn – Mя)c2. Удельная энергия связи:
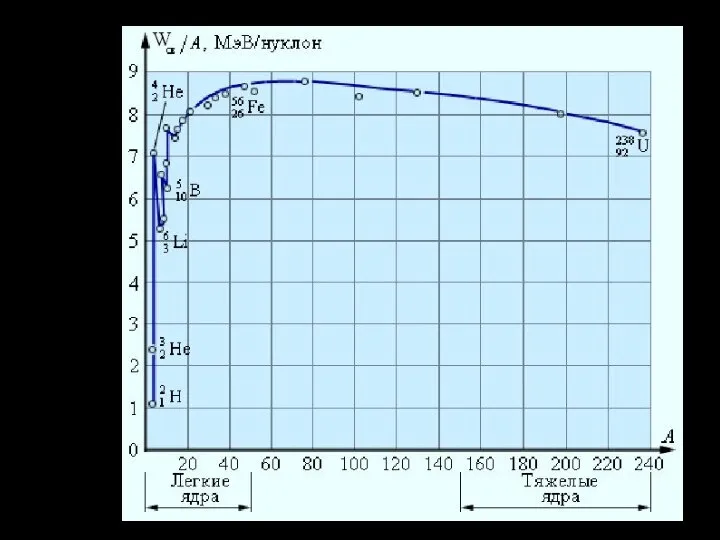
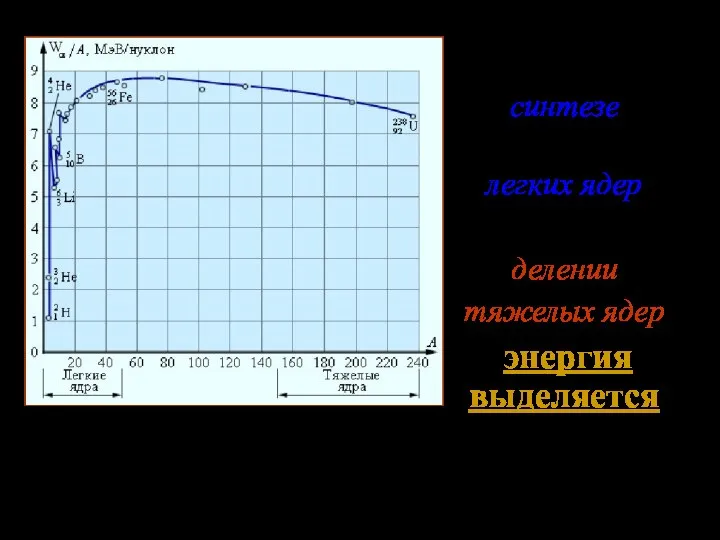
- 18. График зависимости модуля удельной энергии связи от массового числа
- 19. При синтезе (соединении) легких ядер и делении тяжелых ядер энергия выделяется
- 21. Скачать презентацию













 Радиоактивность как свидетельство сложного строения атомов
Радиоактивность как свидетельство сложного строения атомов Дифракція світла
Дифракція світла  Электричество
Электричество Системы автоматического управления. Тема 4
Системы автоматического управления. Тема 4 Лекция №3. Принцип Гюйгенса в виде формулы Кирхгофа. Зоны Френеля. Определение зон Френеля
Лекция №3. Принцип Гюйгенса в виде формулы Кирхгофа. Зоны Френеля. Определение зон Френеля Гидроэлектростанции (ГЭС)
Гидроэлектростанции (ГЭС) Презентация по физике "Физика в загадках" - скачать
Презентация по физике "Физика в загадках" - скачать  Форма и ширина спектральной линии
Форма и ширина спектральной линии Подготовка к ВПР. 7 класс
Подготовка к ВПР. 7 класс Программа испытаний автомобилей
Программа испытаний автомобилей Презентация по физике "Параллельное и последовательное соединение серы" - скачать
Презентация по физике "Параллельное и последовательное соединение серы" - скачать  Закон сохранения энергии
Закон сохранения энергии Електричне поле точкових зарядів. Потік напруженості електричного поля.
Електричне поле точкових зарядів. Потік напруженості електричного поля.  Синергетика. Основные мировоззренческие идеи синергетики
Синергетика. Основные мировоззренческие идеи синергетики Оптика. Природа света
Оптика. Природа света Напряженность электростатического поля. Линии напряженности электростатического поля
Напряженность электростатического поля. Линии напряженности электростатического поля Презентация Вода и ее свойства
Презентация Вода и ее свойства  Radiation analysis for space GRAS
Radiation analysis for space GRAS Нагревание воздуха и его температура
Нагревание воздуха и его температура Сила тока. Измерение силы тока.
Сила тока. Измерение силы тока. Газовые законы
Газовые законы Дифракция света. Принцип Гюйгенса-Френеля. Лекция 16(1)
Дифракция света. Принцип Гюйгенса-Френеля. Лекция 16(1) Явления переноса. Лекция № 16
Явления переноса. Лекция № 16 Динамика: инерция, масса, сила, законы Ньютона
Динамика: инерция, масса, сила, законы Ньютона Двигатели
Двигатели Радиопротекторы. Факторы облучения
Радиопротекторы. Факторы облучения Презентация по физике "Фундаментальные взаимодействия" - скачать
Презентация по физике "Фундаментальные взаимодействия" - скачать  Поверхностные явления
Поверхностные явления