Содержание
- 2. Тепловая обстановка в частице катализатора Зависит от выделяющегося (поглощаемого) при реакции тепла теплообмена между частицей и
- 3. Химическая реакция, протекающая с выделением или поглощением тепла, приводит к местному разогреву или охлаждению частицы катализатора,
- 4. В общем случае температуры окружающей газовой (жидкой) фазы Т0, поверхности Тп и центра Тц зерна катализатора
- 5. В гетерогенном химическом процессе реагирующее вещество диффундирует по порам внутрь зерна катализатора, его превращение и тепловыделение
- 6. Перенос и превращение вещества Граничные условия: при r = R0 С = С0; при r =
- 7. Внутренний разогрев частицы катализатора Введем степень превращения х = (С0 – С)/С0 и умножим числитель и
- 8. Внутренний разогрев частицы катализатора Т - Тп = ΔТ – разогрев зерна катализатора в направлении от
- 9. – адиабатический прогрев Показывает, на сколько градусов нагреется (охладится) реакционная смесь, если реакция пройдет до конца
- 10. Эффективный коэффициент диффузии в порах зерна катализатора составляет Dэф = 0,1 D. Теплопроводность пористых катализаторов λз
- 11. Внутренний разогрев частицы катализатора При значениях ΔТад в несколько сот градусов максимальный разогрев в центре зерна,
- 12. Температура на внешней поверхности зерна Тп зависит от температуры потока вокруг зерна Т0 и определяется тепловым
- 13. Для реакции первого порядка β(С0 – Сn) = kСп β = α/ср , хп = (С0-Сп)/С0
- 14. В случае экзотермической реакции (qp > 0) произойдет разогрев поверхности частицы, т.е. Тп – Т0 >
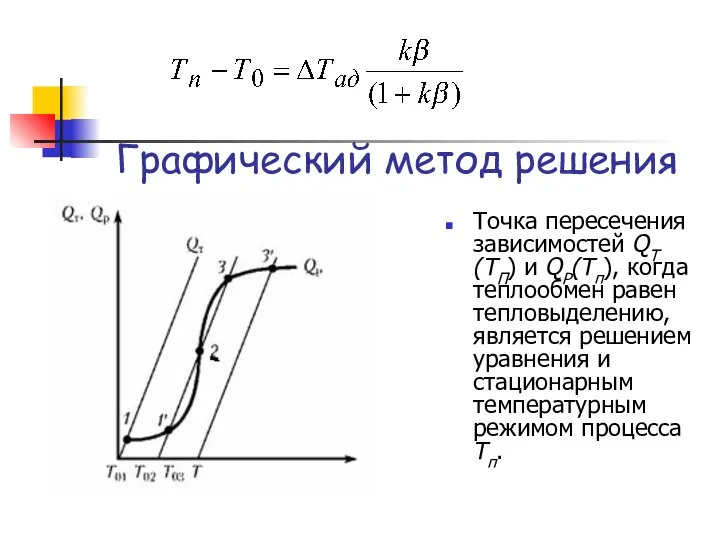
- 15. Левая часть представляет теплоотвод QT(Tп) и имеет линейную зависимость от Тп. Правая часть — скорость тепловыделения
- 16. Графический метод решения Точка пересечения зависимостей QТ(TП) и QP(Tп), когда теплообмен равен тепловыделению, является решением уравнения
- 17. В зависимости от значения Т0 даже в простом случае возможно одно или три решения уравнения —
- 19. Скачать презентацию















 Конструкции сопловых лопаток
Конструкции сопловых лопаток Живая и мёртвая вода (4 класс)
Живая и мёртвая вода (4 класс) Поршневые двигатели внутреннего сгорания
Поршневые двигатели внутреннего сгорания 实验五 功率放大电路
实验五 功率放大电路 Электрооборудование автомобилей. Генераторные установки. (Урок 3)
Электрооборудование автомобилей. Генераторные установки. (Урок 3) Лекция 23 Тема: Электростатическое поле в диэлектрической среде. Поляризованность. Электрическое смещение. Проводники в электр
Лекция 23 Тема: Электростатическое поле в диэлектрической среде. Поляризованность. Электрическое смещение. Проводники в электр Estados de la materia ejercicios propuestos
Estados de la materia ejercicios propuestos Сенин В.Г., МОУ «СОШ №4», г. Корсаков
Сенин В.Г., МОУ «СОШ №4», г. Корсаков  Электромагнитное поле. Электромагнитные волны. Волновые свойства света. Различные виды электромагнитных излучений
Электромагнитное поле. Электромагнитные волны. Волновые свойства света. Различные виды электромагнитных излучений Аттестационная работа. Бурение нефтяных и газовых скважин. Методика расчета утяжеленных бурильных труб
Аттестационная работа. Бурение нефтяных и газовых скважин. Методика расчета утяжеленных бурильных труб СВАРКА МЕТАЛЛОВ классификация
СВАРКА МЕТАЛЛОВ классификация  Корреляционный лаг
Корреляционный лаг Презентация ИСПАРЕНИЕ 8 класс
Презентация ИСПАРЕНИЕ 8 класс  Классификация, общее устройство и принцип действия поршневых ДВС
Классификация, общее устройство и принцип действия поршневых ДВС Презентация по физике Дисперсия
Презентация по физике Дисперсия  История электрификации Брянской области
История электрификации Брянской области Взаимодействие радиоактивных излучений с веществом. Прохождение излучений через материальную среду
Взаимодействие радиоактивных излучений с веществом. Прохождение излучений через материальную среду Оптика. ( Источники, отражение и преломление света) Подготовил: Ученик МОУ лицея № 18 Кондратов Алексей
Оптика. ( Источники, отражение и преломление света) Подготовил: Ученик МОУ лицея № 18 Кондратов Алексей  Агрегатные состояния вещества Сенин В.Г., МОУ «СОШ №4», г. Корсаков
Агрегатные состояния вещества Сенин В.Г., МОУ «СОШ №4», г. Корсаков  Закон Ома для полной цепи
Закон Ома для полной цепи Всё живое из яйца. Исследовательская работа
Всё живое из яйца. Исследовательская работа Elektriskās piedziņas pārejas procesi. (№4)
Elektriskās piedziņas pārejas procesi. (№4) Проводники в электрическом поле
Проводники в электрическом поле Устройство двигателя внутреннего сгорания
Устройство двигателя внутреннего сгорания Undertone sound
Undertone sound Ультразвуковая сигнализация на платформе Arduino
Ультразвуковая сигнализация на платформе Arduino Система подготовки к ГИА по физике в 9 кл. Бейбулатова Е.А., учитель физики высшей квалификационной категории МОУ СОШ № 1 р.п. Степно
Система подготовки к ГИА по физике в 9 кл. Бейбулатова Е.А., учитель физики высшей квалификационной категории МОУ СОШ № 1 р.п. Степно Законы сохранения в механике
Законы сохранения в механике