Содержание
- 2. Содержание 1.Фазовые состояния и превращения воды 2.Фазовые диаграммы p,T-, p,V- и Ts для воды 3.Жидкость на
- 3. Фазовые состояния и превращения воды Вода в равновесном состоянии (без энергетических взаимодействий с окружающей средой )
- 4. Фазовые состояния и превращения воды Вода в неравновесном состоянии (с энергетическими взаимодействиями с окружающей средой )
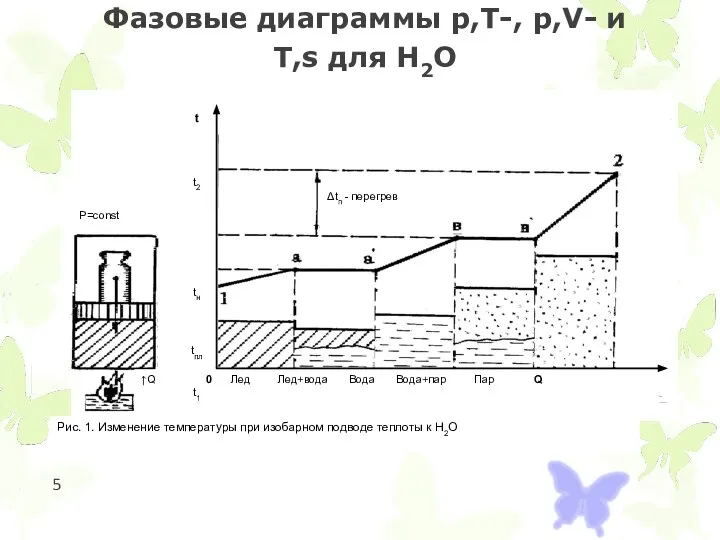
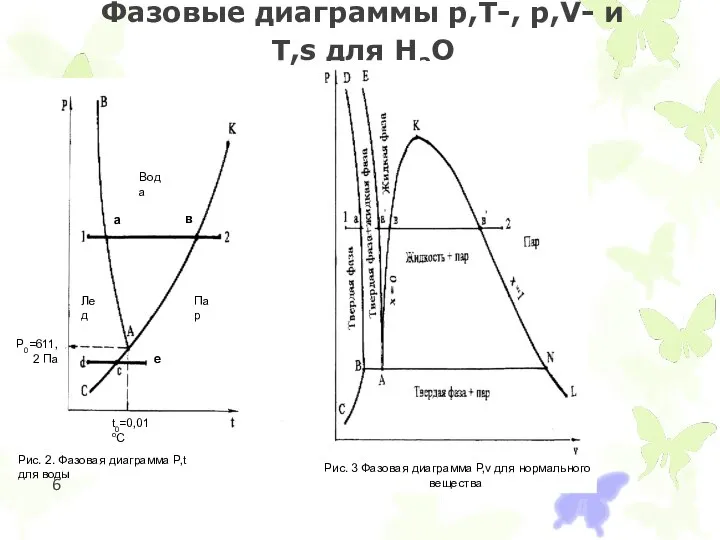
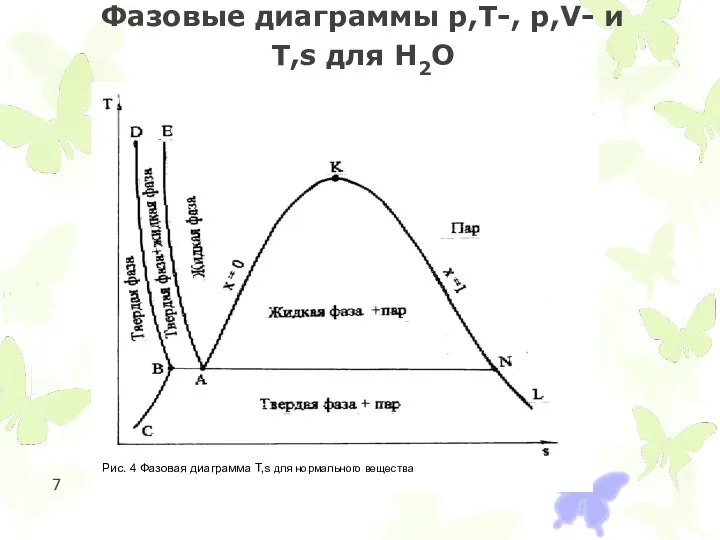
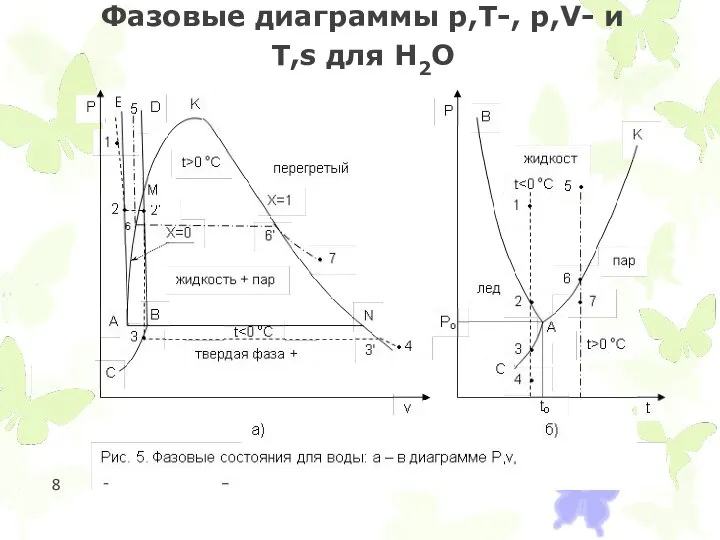
- 5. Фазовые диаграммы p,T-, p,V- и T,s для Н2О
- 6. Фазовые диаграммы p,T-, p,V- и T,s для Н2О
- 7. Фазовые диаграммы p,T-, p,V- и T,s для Н2О
- 8. Фазовые диаграммы p,T-, p,V- и T,s для Н2О
- 9. Жидкость на линии фазового перехода Энтропия жидкости на линии насыщения x = 0 определяется исходя из
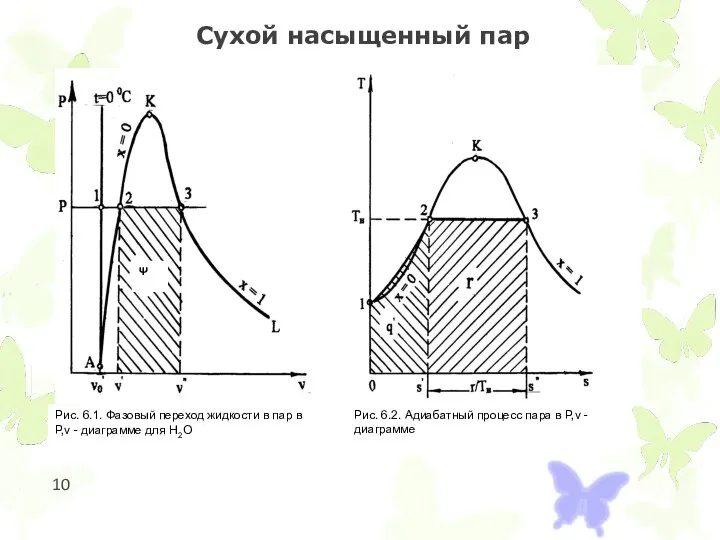
- 10. Сухой насыщенный пар
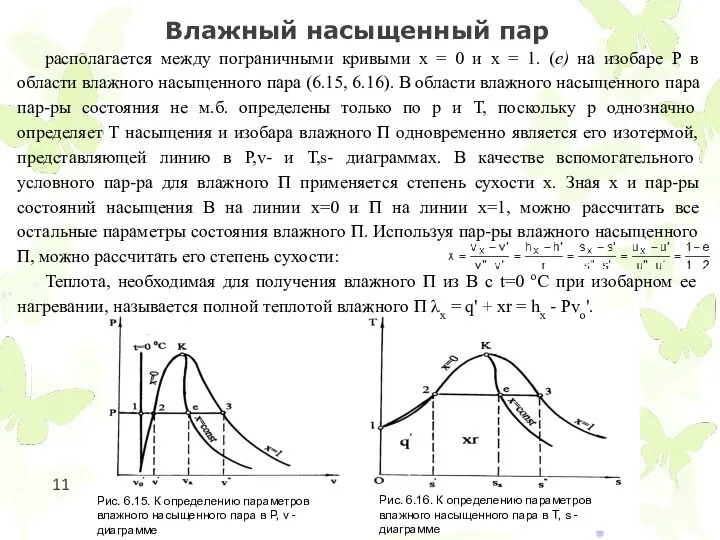
- 11. Влажный насыщенный пар располагается между пограничными кривыми x = 0 и x = 1. (е) на
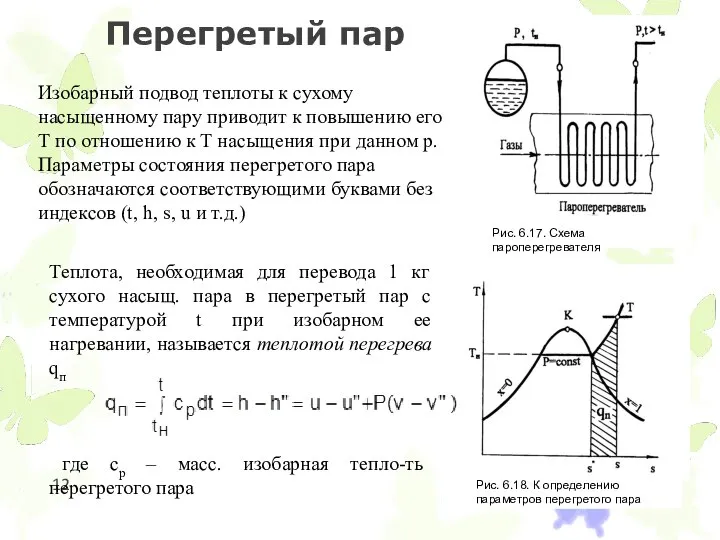
- 12. Перегретый пар Изобарный подвод теплоты к сухому насыщенному пару приводит к повышению его Т по отношению
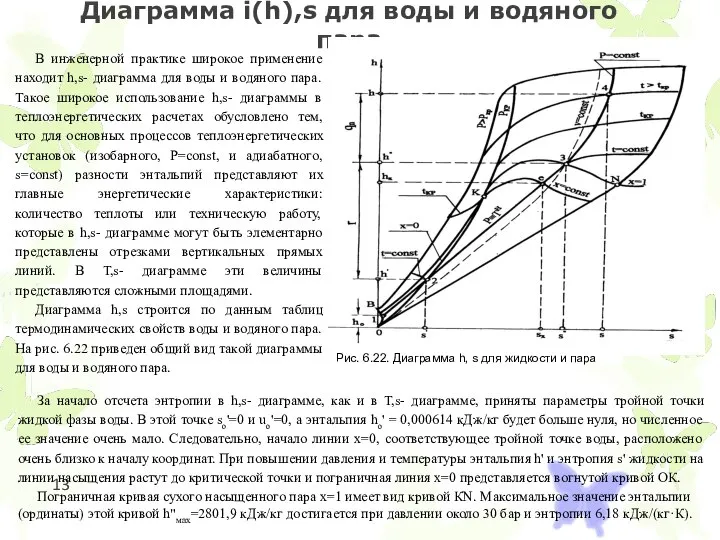
- 13. Диаграмма i(h),s для воды и водяного пара . В инженерной практике широкое применение находит h,s- диаграмма
- 14. Контрольные вопросы 1.В каких фазовых состояниях может находиться вода? 2.Что такое испарение, сублимация , десублимация? 3.Что
- 16. Скачать презентацию
Содержание
1.Фазовые состояния и превращения воды
2.Фазовые диаграммы p,T-, p,V- и Ts для
Содержание
1.Фазовые состояния и превращения воды
2.Фазовые диаграммы p,T-, p,V- и Ts для
3.Жидкость на линии фазового перехода
4.Сухой насыщенный пар
5.Влажный насыщенный пар
6.Перегретый пар
7.Диаграмма i,s для воды и водяного пара
Фазовые состояния и превращения воды
Вода в равновесном состоянии
(без энергетических взаимодействий
Фазовые состояния и превращения воды
Вода в равновесном состоянии
(без энергетических взаимодействий
У поверхности льда или жидкости всегда присутствует пар. Соприкасающиеся фазы находятся в т/д равновесии: быстрые молекулы вылетают из жидкой фазы, преодолевая поверхностные силы, а из паровой фазы медленные молекулы переходят в жидкую фазу.
В состоянии равновесия каждой Т соответствует определенное давление пара – полное (если над жидкостью присутствует только пар) или парциальное (если присутствует смесь пара с воздухом или другими газами).
Пар, находящийся в равновесном состоянии с ж. фазой, из которой он образовался - насыщенный, а соответствующая ему Т - Т насыщения, а давление – р насыщения.
Фазовые состояния и превращения воды
Вода в неравновесном состоянии
(с энергетическими взаимодействиями
Фазовые состояния и превращения воды
Вода в неравновесном состоянии
(с энергетическими взаимодействиями
Процесс некомпенсированного перехода вещества из ЖФ в Г - испарение.
Процесс некомпенсированного перехода вещества из ТФ в Г - сублимациия (возгонка).
Процесс перехода вещества из жидкой фазы в паровую непосредственно внутри жидкости - кипение.
Любой процесс перехода вещества из жидкой фазы в паровую - парообразование.
Процесс, противоположный парообразованию, т.е. некомпенсированный переход вещества из паровой фазы в жидкую - конденсация.
Процесс, противоположный сублимации, т.е. переход вещества из паровой фазы непосредственно в твердую - десублимация.
Жидкая фаза воды при температуре кипения - насыщенная жидкость.
Пар при температуре кипения (насыщения) - сухой насыщенный пар.
Двухфазная смесь "ж+п" в состоянии насыщения - влажный насыщенный пар.
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Фазовые диаграммы p,T-, p,V- и T,s для Н2О
Жидкость на линии фазового перехода
Энтропия жидкости на линии насыщения x =
Жидкость на линии фазового перехода
Энтропия жидкости на линии насыщения x =
Зная значение энтропии sо при t=0 oС и заданном давлении, энтропию жидкости на линии насыщения при Tн можно определить как
где sо = sо'= 0 – при давлениях, используемых в технике; сp ≅ 4,187 кДж/(кг·К) – при умеренных давлениях.
Определение энтальпии, энтропии и внутренней энергии жидкости при температурах меньших, чем температура насыщения при заданном давлении, ведется аналогичным образом.
Сухой насыщенный пар
Сухой насыщенный пар
Влажный насыщенный пар
располагается между пограничными кривыми x = 0 и x
Влажный насыщенный пар
располагается между пограничными кривыми x = 0 и x
Теплота, необходимая для получения влажного П из В c t=0 оС при изобарном ее нагревании, называется полной теплотой влажного П λx = q' + xr = hx - Рvo'.
Перегретый пар
Изобарный подвод теплоты к сухому насыщенному пару приводит к повышению
Перегретый пар
Изобарный подвод теплоты к сухому насыщенному пару приводит к повышению
Теплота, необходимая для перевода 1 кг сухого насыщ. пара в перегретый пар с температурой t при изобарном ее нагревании, называется теплотой перегрева qп
где cp – масс. изобарная тепло-ть перегретого пара
Диаграмма i(h),s для воды и водяного пара
.
В инженерной практике широкое применение
Диаграмма i(h),s для воды и водяного пара
.
В инженерной практике широкое применение
Диаграмма h,s строится по данным таблиц термодинамических свойств воды и водяного пара. На рис. 6.22 приведен общий вид такой диаграммы для воды и водяного пара.
За начало отсчета энтропии в h,s- диаграмме, как и в Т,s- диаграмме, приняты параметры тройной точки жидкой фазы воды. В этой точке sо'=0 и uо'=0, а энтальпия hо' = 0,000614 кДж/кг будет больше нуля, но численное ее значение очень мало. Следовательно, начало линии х=0, соответствующее тройной точке воды, расположено очень близко к началу координат. При повышении давления и температуры энтальпия h' и энтропия s' жидкости на линии насыщения растут до критической точки и пограничная линия х=0 представляется вогнутой кривой ОК.
Пограничная кривая сухого насыщенного пара х=1 имеет вид кривой КN. Максимальное значение энтальпии (ординаты) этой кривой h"мах=2801,9 кДж/кг достигается при давлении около 30 бар и энтропии 6,18 кДж/(кг·К).
Контрольные вопросы
1.В каких фазовых состояниях может находиться вода?
2.Что такое испарение, сублимация
Контрольные вопросы
1.В каких фазовых состояниях может находиться вода?
2.Что такое испарение, сублимация
3.Что такое конденсация, парообразование, кипение?
4.Дайте определение сухого насыщенного пара, влажного насыщенного пара и перегретого пара.
5.Какие диаграммы для воды и водяного пара чаще всего используются в инженерных расчетах?





 Выдувание пузырей
Выдувание пузырей Физика конденсированного состояния. Движение электронов в атоме
Физика конденсированного состояния. Движение электронов в атоме Лекция 12 Тема:Уравнение состояния идеального газа .
Лекция 12 Тема:Уравнение состояния идеального газа .  Основные © В.Е. Фрадкин, 2004
Основные © В.Е. Фрадкин, 2004 Расчет установившихся режимов простейших электрических сетей. (Глава 6)
Расчет установившихся режимов простейших электрических сетей. (Глава 6) Выполнила: Ученица 4 «э» класса Худобина Елизавета Руководитель: О. И. Баранцева (программа XXI 4 классов) г. Санкт-Петербург 2011 год.
Выполнила: Ученица 4 «э» класса Худобина Елизавета Руководитель: О. И. Баранцева (программа XXI 4 классов) г. Санкт-Петербург 2011 год. Интерференция света 11 класс
Интерференция света 11 класс  Проект «В царстве Архимеда»
Проект «В царстве Архимеда» Механическое движение
Механическое движение Исследовательский проект «Машина Голдберга и бизиборд «Кваторианский домик»
Исследовательский проект «Машина Голдберга и бизиборд «Кваторианский домик» Дифракция света. Принцип Гюйгенса-Френеля
Дифракция света. Принцип Гюйгенса-Френеля Презентация к уроку в 7 классе по теме: «Сила» Учитель физики первой квалификационной категории МБОУ «Россошинская сош»
Презентация к уроку в 7 классе по теме: «Сила» Учитель физики первой квалификационной категории МБОУ «Россошинская сош»  Основы кинематики
Основы кинематики Презентация по физике "Производство, передача и потребление электроэнергии" - скачать
Презентация по физике "Производство, передача и потребление электроэнергии" - скачать  Открытие В.К. Рентгеном Х-лучей. Открытие А. Беккерелем явления радиоактивности
Открытие В.К. Рентгеном Х-лучей. Открытие А. Беккерелем явления радиоактивности Математическое моделирование как основной метод изучения процессов и решения задач оптимизации и управления в биосфере
Математическое моделирование как основной метод изучения процессов и решения задач оптимизации и управления в биосфере Плавление и отвердевание кристаллических тел
Плавление и отвердевание кристаллических тел Диэлектрофорез вирионов осповакцины
Диэлектрофорез вирионов осповакцины ВІльям Томсон
ВІльям Томсон Аттестационная работа. Равновесие рычага и золотое сечение
Аттестационная работа. Равновесие рычага и золотое сечение Поток энергии и цепи питания Автор презентации = учитель биологии ГБОУ СОШ№113 Архипова Татьяна Сергеевна
Поток энергии и цепи питания Автор презентации = учитель биологии ГБОУ СОШ№113 Архипова Татьяна Сергеевна Тяговые расчеты при проектировании железной дороги
Тяговые расчеты при проектировании железной дороги Форма и ширина спектральной линии
Форма и ширина спектральной линии Процессы обработки влажного воздуха
Процессы обработки влажного воздуха Деление тяжелых ядер. Цепная ядерная реакция. Ядерный реактор. Ядерная энергетика
Деление тяжелых ядер. Цепная ядерная реакция. Ядерный реактор. Ядерная энергетика Презентация на тему: Выполнила работу: Хамедова Хасиба 10 класса «А»
Презентация на тему: Выполнила работу: Хамедова Хасиба 10 класса «А»  Явление молнии
Явление молнии  Модели на основе ДУ в частных производных и метод конечных разностей
Модели на основе ДУ в частных производных и метод конечных разностей