Содержание
- 2. План лекции
- 3. Общие замечания Введение Термодинамика изучает вещество как сплошную среду, обладающую определённым набором параметров (температура, давление, энергия
- 4. Раздел 1. Основные термодинамические параметры
- 5. 1.1 Температура 1. Основные термодинамические параметры Температура измеряется по одной из двух шкал: Международная практическая шкала
- 6. 1.2 Объём, давление 1. Основные термодинамические параметры Объём (V) – параметр, означающий геометрический размер области, занятой
- 7. 1.3 Термодинамическое состояние вещества 1. Основные термодинамические параметры Термодинамическое состояние вещества считается определённым (заданным), если известны
- 8. 1.4 Нулевое начало термодинамики 1. Основные термодинамические параметры Термодинамика, как любой раздел физики (и не только
- 9. Раздел 2. Энергетические характеристики в термодинамике
- 10. 2.1 Внутренняя энергия 2. Энергетические характеристики в термодинамике Внутренняя энергия (U) термодинамической системы – это энергия
- 11. 2.2 Количество теплоты 2. Энергетические характеристики в термодинамике Внутренняя энергия U вещества (тела) может быть изменена
- 12. 2.3 Работа термодинамической системы 2. Энергетические характеристики в термодинамике Внутренняя энергия U может изменяться за счёт
- 13. 2.4 Первое начало термодинамики 2. Энергетические характеристики в термодинамике Первое начало термодинамики – это полный аналог
- 14. Раздел 3. Степени свободы
- 15. 3.1 Число степеней свободы молекулы (i) – это: 3. Степени свободы - Число независимых направлений в
- 16. 3.2 Примеры 3. Степени свободы а) Одноатомная молекула: возможно только поступательное движение по трём независимым направлениям
- 17. 3.3 Распределение энергии по степеням свободы 3. Степени свободы Закон Больцмана: 1. Энергия по всем степеням
- 18. Раздел 4. Теплоёмкость
- 19. 4.1 Определения 4. Теплоёмкость Теплоёмкость – это характеристика вещества (тела), определяется опытным путём. Определения: 1.Удельная теплоёмкость
- 20. 4.2 Теплоёмкость при постоянном объёме и при постоянном давлении 4. Теплоёмкость Закон сохранения энергии (он же
- 21. Раздел 5. Изо-процессы
- 22. 5. Изо-процессы Графическое изображение изохорного процесса (1→2) в координатах основных термодинамических параметров {p,V}, {p,T}, {V,T}. 5.1
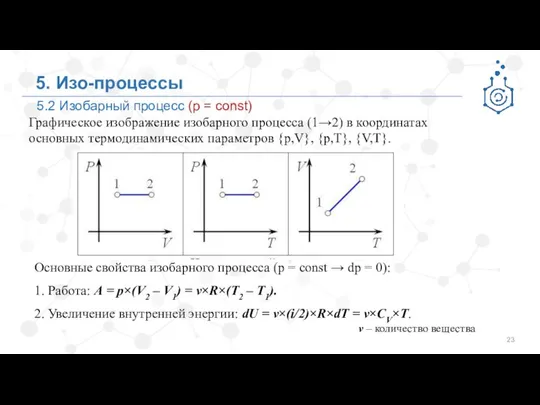
- 23. 5. Изо-процессы Графическое изображение изобарного процесса (1→2) в координатах основных термодинамических параметров {p,V}, {p,T}, {V,T}. 5.2
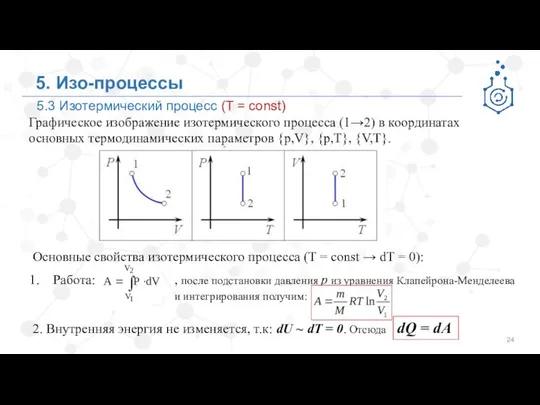
- 24. Основные свойства изотермического процесса (Т = const → dТ = 0): Работа: , после подстановки давления
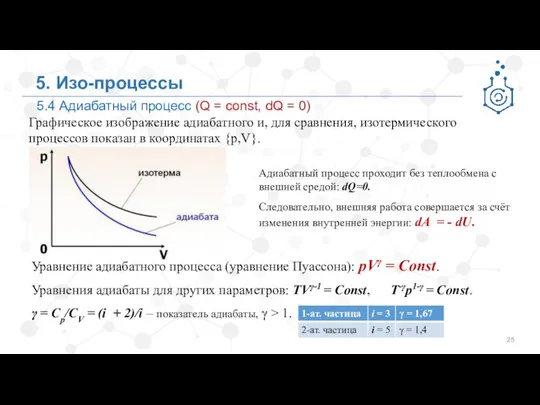
- 25. 5. Изо-процессы Графическое изображение адиабатного и, для сравнения, изотермического процессов показан в координатах {p,V}. 5.4 Адиабатный
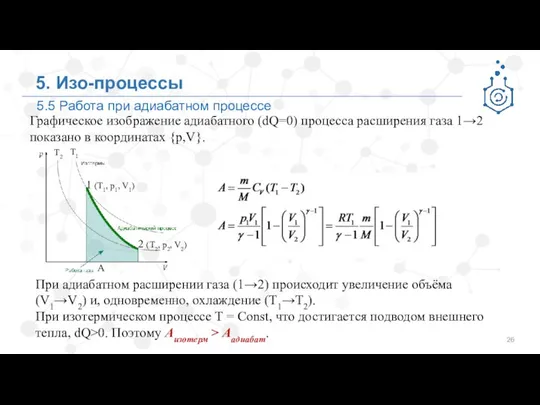
- 26. 5. Изо-процессы Графическое изображение адиабатного (dQ=0) процесса расширения газа 1→2 показано в координатах {p,V}. 5.5 Работа
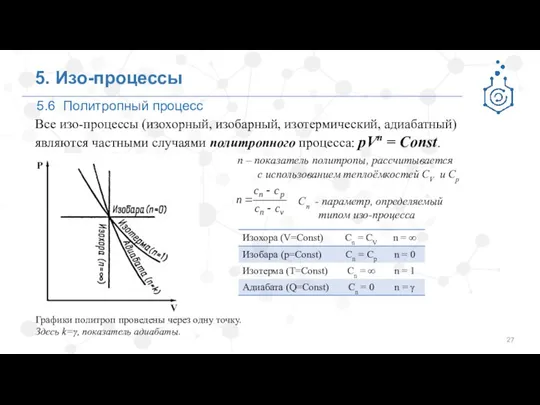
- 27. 5. Изо-процессы Все изо-процессы (изохорный, изобарный, изотермический, адиабатный) являются частными случаями политропного процесса: pVn = Const.
- 28. Вопросы в экзаменационных билетах Основные термодинамические параметры. Энергетические характеристики в термодинамике. Степени свободы. Теплоёмкость Изо-процессы. Изохорный,
- 30. Скачать презентацию






















 Оптика. Прохождение света через границу раздела двух сред. (Лекция 3)
Оптика. Прохождение света через границу раздела двух сред. (Лекция 3) Искусственные алмазы
Искусственные алмазы Проектирование системы обеспечения теплового режима космического полета
Проектирование системы обеспечения теплового режима космического полета Аттестационная работа. Проектно-исследовательская деятельность в рамках науки «Физика». (7 класс)
Аттестационная работа. Проектно-исследовательская деятельность в рамках науки «Физика». (7 класс) Фотометрия. Спектрофотометрический метод. Фотометрический метод. Метод визуальной колориметрии
Фотометрия. Спектрофотометрический метод. Фотометрический метод. Метод визуальной колориметрии Технология сварочных работ. История сварки
Технология сварочных работ. История сварки Электрические заряды. Способы получения зарядов. Закон сохранения электрического заряда
Электрические заряды. Способы получения зарядов. Закон сохранения электрического заряда Параметрические цепи
Параметрические цепи Квартирный щиток. Презентация по электротехнике
Квартирный щиток. Презентация по электротехнике Презентация по физике "Передача информации с помощью электромагнитных волн." - скачать бесплатно
Презентация по физике "Передача информации с помощью электромагнитных волн." - скачать бесплатно Проблемы прочности в технике
Проблемы прочности в технике Шредингер теңдеуі
Шредингер теңдеуі Давление газов Закон Паскаля ЛАДАНОВА И.В. МКОУ «ВЕРХ-ЖИЛИНСКАЯ ООШ
Давление газов Закон Паскаля ЛАДАНОВА И.В. МКОУ «ВЕРХ-ЖИЛИНСКАЯ ООШ Движение по окружности
Движение по окружности Электричество. Электрические цепи
Электричество. Электрические цепи Решение задач на применение законов Ньютона
Решение задач на применение законов Ньютона Презентация по физике "спектр" - скачать бесплатно
Презентация по физике "спектр" - скачать бесплатно Отто Штерн
Отто Штерн  Тема урока: Интерференция волн
Тема урока: Интерференция волн  Лабораторная работа №5 «Определение плотности твердого тела» Физика 7 класс Лактионова Надежда Сергеевна
Лабораторная работа №5 «Определение плотности твердого тела» Физика 7 класс Лактионова Надежда Сергеевна Електродвигун
Електродвигун Магнитное поле
Магнитное поле Сложный контур циркуляции
Сложный контур циркуляции Механическая работа и мощность Подготовка к ГИА
Механическая работа и мощность Подготовка к ГИА Сила тяжести
Сила тяжести Электрическое поле заряженных проводников. Энергия электростатического поля
Электрическое поле заряженных проводников. Энергия электростатического поля Принципиальные электрические схемы
Принципиальные электрические схемы Магнитное поле
Магнитное поле