Содержание
- 2. Термодинамиканың бірінші заңы Δ символы макроскопиялық өзгерісті белгілеу үшін, ал d шексіз аз өзгерістерді белгілеу үшін
- 3. Тепе - теңдік процестер. Максималдық жұмыс. Системаның бір күйден екінші күйге өткенде атқаратын жұмысы процесс жүруі
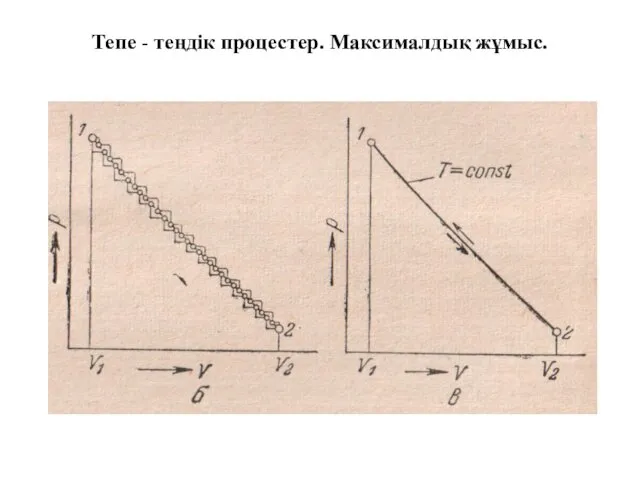
- 4. Тепе - теңдік процестер. Максималдық жұмыс.
- 5. Тепе - теңдік процестер. Максималдық жұмыс. 24-суретте(в) көрсетілген процесс тура және кері бағыттарда тепетеңдік күйлеріне шексіз
- 6. Термодинамиканың 1-заңының қарапайым процестерге қолданылуы. 1) Изобарлық процес қысымның тұрақтылығымен сипатталады. Тұрақты қысымға қарсы ұлғаю жұмысы
- 7. Термодинамиканың 1-заңының қарапайым процестерге қолданылуы. 2) Изохорлық процестер көлем тұрақтылығымен сипатталады. Егер процесс кезінде системаның көлемі
- 8. Термодинамиканың 1-заңының қарапайым процестерге қолданылуы. Изотермиялық процесс температураның тұрақтылығымен сипатталады. (47) Егер газ идеал десек Р
- 9. Термодинамиканың 1-заңының қарапайым процестерге қолданылуы. изотермиялық процесте системаның үстінен атқарылған жұмыс толығымен жылуға айналады, немесе керісінше,
- 10. Тұрақты көлемде және тұрақты қысымда жүретін реакциялардың жылу эффектілерінің арасындағы байланыс Н = U + PV
- 11. Гесс заңы Химиялық реакцияның жылу эффектілерін қарастыратын термодинамиканың тарауын термохимия деп атайды. Ең алғаш термохимияның екі
- 12. Гесс заңы C(қ)+O2(г) = CO2 (г) ΔН1 Екінші жол бойынша CO2 екі сатыда алынады; оларды қосып
- 13. Гесс заңының салдарлары 3-салдар: Реакцияның жылу эффектісі реакция өнімдерінің түзілу жылулары мен бастапқы реагенттердің түзілу жылуларының
- 14. Гесс заңының салдарлары 4-салдар: (Жану жылуын еске түсіріңіз). Егер реакцияға қатысушы заттардың жану жылулары белгілі болса,
- 16. Скачать презентацию












 Казанский университет. Институт физики
Казанский университет. Институт физики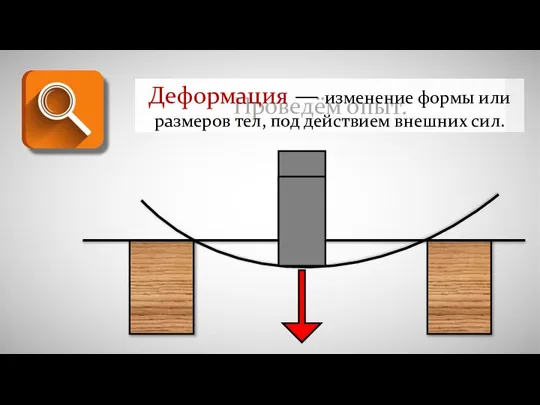 Деформация - изменение формы или размеров тел под действием внешних сил
Деформация - изменение формы или размеров тел под действием внешних сил Енергія електричного поля
Енергія електричного поля Полупроводниковые приборы
Полупроводниковые приборы Понятие термодинамики
Понятие термодинамики Проводники в электростатическом поле
Проводники в электростатическом поле Тема: Простые механизмы. Работа ученика 7 «в» СОШ №7 г.Якутска Филиппова Юры Руководитель проекта А.П.Филиппова
Тема: Простые механизмы. Работа ученика 7 «в» СОШ №7 г.Якутска Филиппова Юры Руководитель проекта А.П.Филиппова Теплота парообразования. Сжижение газов. Влажность воздуха
Теплота парообразования. Сжижение газов. Влажность воздуха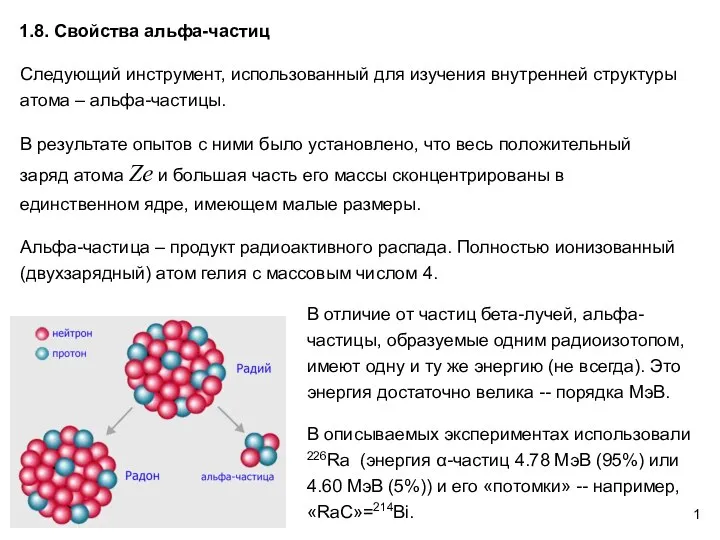 Свойства альфа-частиц. АФ1.8
Свойства альфа-частиц. АФ1.8 Нейтрон и его свойства
Нейтрон и его свойства מתקני הרמה ושינוע הרצאה :מתקני הרמה. כבלים ,חבלים ,שרשרות
מתקני הרמה ושינוע הרצאה :מתקני הרמה. כבלים ,חבלים ,שרשרות Команда «По» представляет: Закон сохранения импульса. Реактивное движение
Команда «По» представляет: Закон сохранения импульса. Реактивное движение Электростатика. Электрический заряд
Электростатика. Электрический заряд Электрическое поле. Законы постоянного тока
Электрическое поле. Законы постоянного тока Проект по физике на тему: «Экология, энергетика, человек»
Проект по физике на тему: «Экология, энергетика, человек» Модель атома Резерфорда Ядерная или Планетарная модель атома Вонс Диана и Тарамова Айза 10«Б»
Модель атома Резерфорда Ядерная или Планетарная модель атома Вонс Диана и Тарамова Айза 10«Б»  Лазер. История создания лазера. Устройство лазера. Применение лазера
Лазер. История создания лазера. Устройство лазера. Применение лазера Система и окружающая среда
Система и окружающая среда Контактные явления
Контактные явления Неньютоновские жидкости
Неньютоновские жидкости Дипломный проект. Ремонт, мотаж и эксплуатация домкратов
Дипломный проект. Ремонт, мотаж и эксплуатация домкратов Вычисления массы и массовой доли растворенного вещества (11 класс)
Вычисления массы и массовой доли растворенного вещества (11 класс) Презентация по физике "Радиация и её влияние на окружающую среду" - скачать
Презентация по физике "Радиация и её влияние на окружающую среду" - скачать  Теплообмен излучением между телами, разделённой прозрачной средой. Коэффициент облучённости. Теплообмен между телами
Теплообмен излучением между телами, разделённой прозрачной средой. Коэффициент облучённости. Теплообмен между телами Количественный анализ. Хроматографические методы
Количественный анализ. Хроматографические методы Тепловые процессы. Теплообменники. Нагрев острым паром
Тепловые процессы. Теплообменники. Нагрев острым паром Презентация по физике Электромагнитная индукция. Опыты Фарадея Подготовка к ГИА
Презентация по физике Электромагнитная индукция. Опыты Фарадея Подготовка к ГИА  Презентация Законы преломления.
Презентация Законы преломления.