Содержание
- 2. ПАРАМЕТРЫ СОСТОЯНИЯ Свойства веществ бывают интенсивные и экстенсивные. Интенсивные – не зависят от количества вещества (температура,
- 3. ПАРАМЕТРЫ СОСТОЯНИЯ Интенсивные свойства, определяющие состояние вещества, называются параметрами состояния. Основные параметры состояния: а) температура характеризует
- 4. ПАРАМЕТРЫ СОСТОЯНИЯ Состояние любого вещества однозначно определяется любой парой параметров состояния: Для каждого вещества существует функция
- 5. ТЕРМОДИНОМИЧЕСКИЙ ПРОЦЕСС Термодинамическая система – это тело или совокупность тел, взаимодействующих между собой и окружающей средой.
- 6. ТЕРМОДИНОМИЧЕСКИЙ ПРОЦЕСС Частные случаи термодинамического процесса: p=const – изобарный процесс; v=const – изохорный процесс; T=const –
- 7. ТЕПЛОЁМКОСТЬ Теплоёмкость – это количество теплоты, которое нужно подвести к телу для того, чтобы нагреть его
- 8. ТЕПЛОЁМКОСТЬ Средняя теплоёмкость – это теплоёмкость, измеренная в интервале температур. где - это количество теплоты, которое
- 9. ТЕПЛОЁМКОСТЬ Истинная теплоемкость это теплоёмкость при конкретном значении температуры . , где x - индекс процесса.
- 10. ТЕПЛОЁМКОСТЬ Для газов справедливо: где k -показатель адиабаты. k=1,4 для двухатомных газов ( , воздух) Уравнение
- 11. ВНУТРЕННЯЯ ЭНЕРГИЯ Внутренняя энергия включает в себя: энергию поступательного и вращательного движения молекул, внутримолекулярную энергию, энергию
- 12. ВНУТРЕННЯЯ ЭНЕРГИЯ Внутренняя энергия – это функция состояния, т.е. её изменение не зависит от пути процесса,
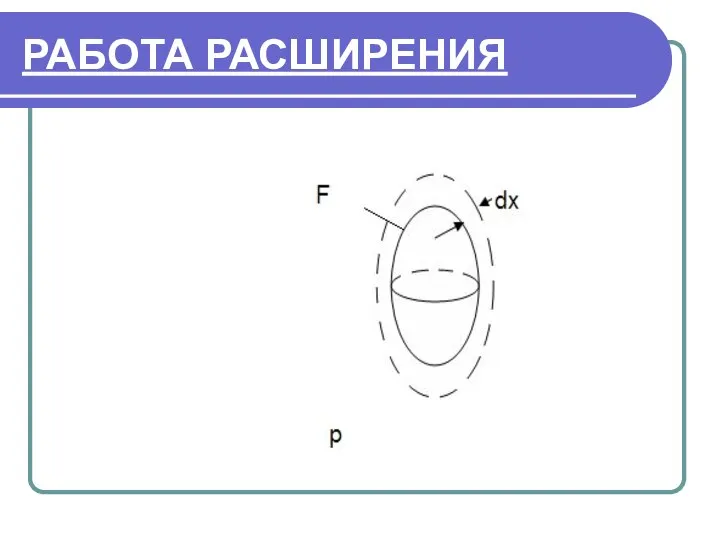
- 13. РАБОТА РАСШИРЕНИЯ
- 14. РАБОТА РАСШИРЕНИЯ F-площадь поверхности данного тела. Тело помещено в среду с давлением р. Преодолевая это давление,
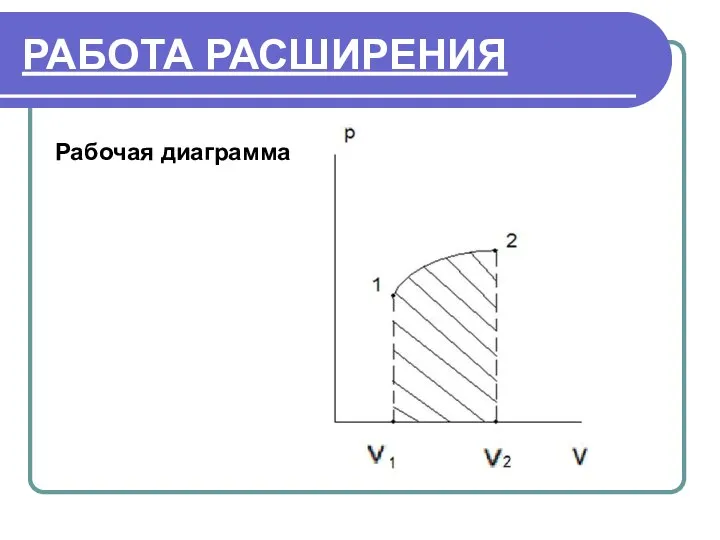
- 15. РАБОТА РАСШИРЕНИЯ Рабочая диаграмма
- 16. РАБОТА РАСШИРЕНИЯ Тело переходит из состояния 1 в состояние 2. При этом тело совершает работу расширения
- 17. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ ФОРМУЛИРОВКА ПЕРВОГО ЗАКОНА ТЕРМОДИНАМИКИ: Теплота, подведенная к телу, расходуется на изменение его внутренней
- 18. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Правило знаков : «+» - теплота поводится к телу; «- » - теплота
- 19. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Запишем уравнение (1) первого закона термодинамики: в удельной форме: (2) в дифференциальной форме:
- 20. ПЕРВЫЙ ЗАКОН ТЕРМОДИНАМИКИ Если единственным видом работы является работа расширения, то уравнение (4) примет вид: при
- 21. ЭНТАЛЬПИЯ Энтальпия – это функция состояния, определяемая уравнением: Удельная энтальпия: Величина изменения энтальпии не зависит от
- 22. ЭНТАЛЬПИЯ Выведем уравнение первого закона термодинамики через энтальпию. Тогда: уравнение первого закона термодинамики, выраженное через энтальпию:
- 23. ЭНТАЛЬПИЯ Если изобарный процесс (dp=0), то : т.е. вся теплота, подведённая к телу, расходуется на изменение
- 24. Второй закон термодинамики Обратимыми называются такие процессы, при совершении которых как в прямом, так и в
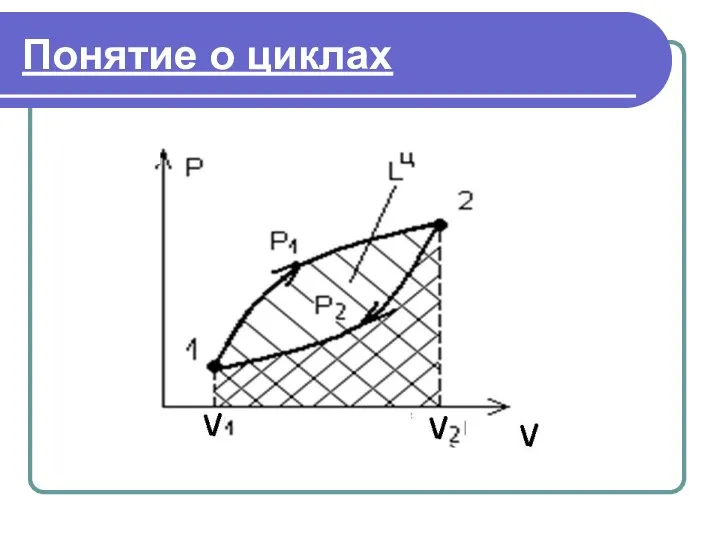
- 25. Понятие о циклах
- 26. Понятие о циклах Тело переходит из состояния 1 в состояние 2. При этом совершается работа расширения,
- 27. Понятие о циклах Работа расширения: Работа сжатия: Работа цикла: Уравнение второго закона термодинамики для цикла:
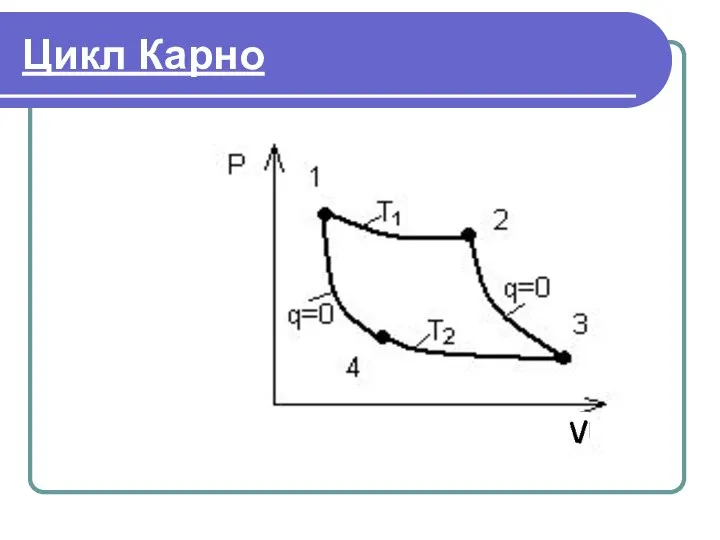
- 28. Цикл Карно
- 29. Цикл Карно Процессы: 1-2, 3-4 - изотермические, 2-3;4-1 - адиабатные; 1-2 - расширение тела в изотермическом
- 30. Цикл Карно Рассмотрим осуществление цикла Карно в обратном направлении. Процессы: 1-4 - возможен; 4-3 - невозможен,
- 31. Цикл Карно Обратимый цикл Карно. Пусть в процессе 1-2: - второму закону термодинамики процесс не противоречит.
- 32. Цикл Карно Пусть при совершении цикла в обратном направлении: Таким образом процессы 2-1 и 4-3 уже
- 33. Энтропия Термический КПД цикла определяется формулой: (1) где Q1 и Q2 – количество теплоты, подведенной к
- 34. Энтропия Можно доказать, что для обратимого цикла Карно термический КПД определяется по формуле: (2) где Т1
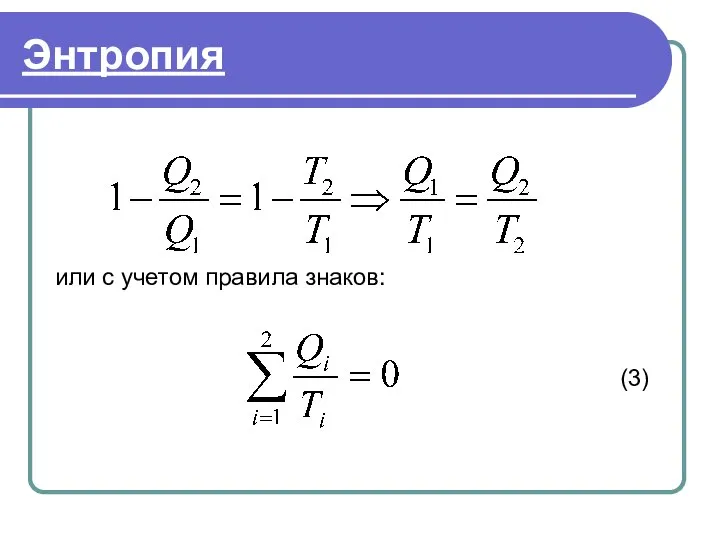
- 35. Энтропия Формула (1) справедлива для любого цикла Из (1) и (2) получим: Эта формула справедлива только
- 36. Энтропия или с учетом правила знаков: (3)
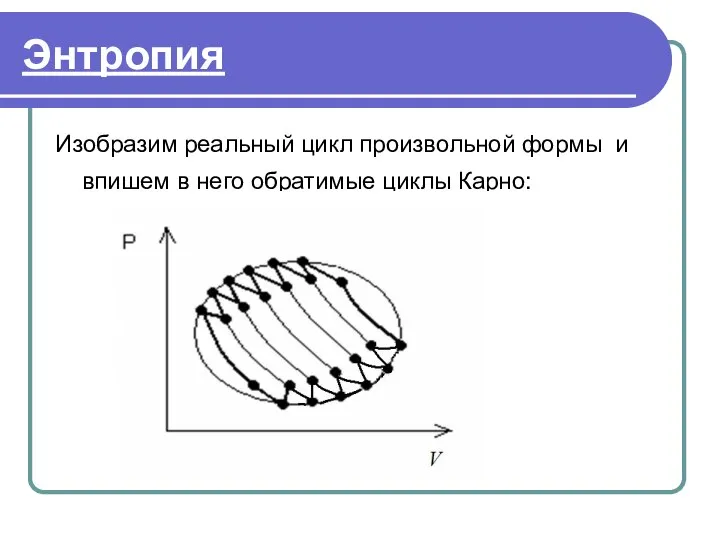
- 37. Энтропия Изобразим реальный цикл произвольной формы и впишем в него обратимые циклы Карно:
- 38. Энтропия В реальный цикл произвольной формы вписали n обратимых циклов Карно с n пар тепловых источников.
- 39. Энтропия Пусть , тогда формула (4) примет вид: (5) т.е. интеграл по замкнутой кривой: (6)
- 40. Энтропия Тогда для любого реального цикла справедлива формула (6). Обозначим подынтегральное выражение: где S- энтропия ,
- 41. Энтропия - интеграл Клаузиуса. - интегрирующий множитель, он превращает функцию процесса в функцию состояния. Удельная энтропия:
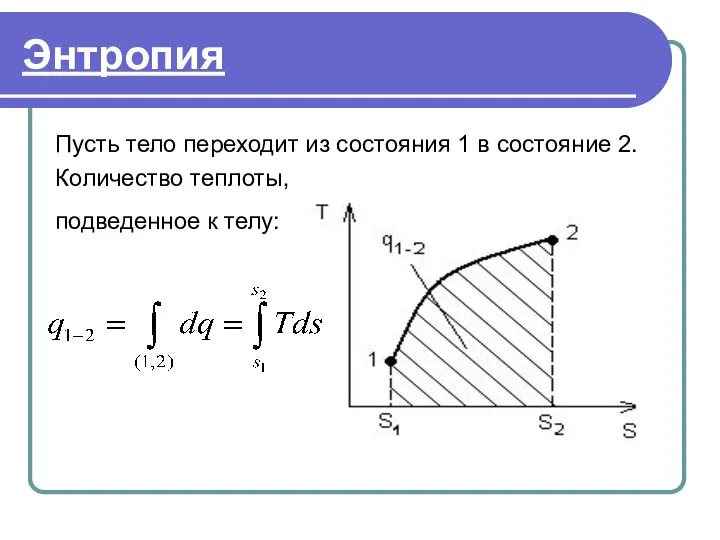
- 42. Энтропия Пусть тело переходит из состояния 1 в состояние 2. Количество теплоты, подведенное к телу:
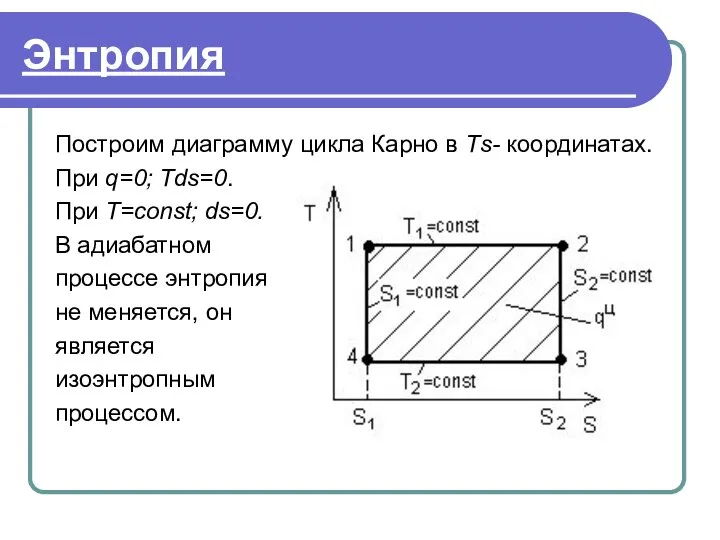
- 43. Энтропия Построим диаграмму цикла Карно в Тs- координатах. При q=0; Тds=0. При T=const; ds=0. В адиабатном
- 44. ЭКСЕРГИЯ Основываясь на втором начале термодинамики, установим количественное соотношение между работой, которая могла бы быть совершена
- 45. ЭКСЕРГИЯ Р а б о т о с п о с о б н о с
- 46. ЭКСЕРГИЯ Из предыдущего ясно, что максимальная полезная работа теплоты Q, представляет собой работу равновесного цикла Кapнo,
- 47. ЭКСЕРГИЯ Таким образом, эксергия теплоты Q1: т. е работоспособность теплоты тем больше, чем меньше отношение То/Т1.
- 48. ЭКСЕРГИЯ Полезную работу, полученную за счет теплоты Q1 горячего источника, можно представить в виде: L1 =
- 49. ЭКСЕРГИЯ Если через обозначить приращение энтропии холодного источника, то тогда
- 50. ЭКСЕРГИЯ Если бы в рассматриваемой изолированной системе протекали только равновесные процессы, то энтропия системы оставалась бы
- 52. Скачать презентацию









































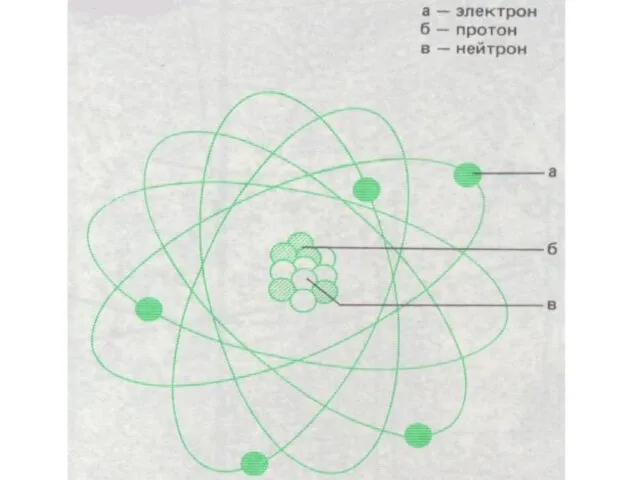 Радиоактивный распад
Радиоактивный распад Сила. Явление тяготения. Сила тяжести
Сила. Явление тяготения. Сила тяжести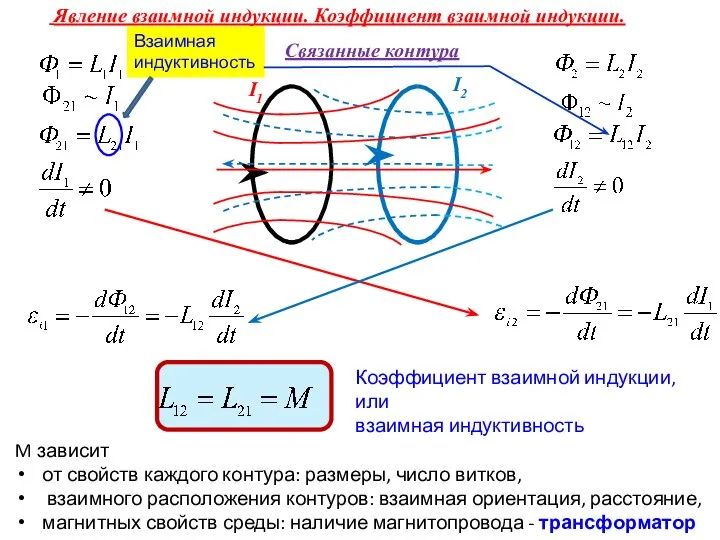 Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность
Явление взаимной индукции. Коэффициент взаимной индукции. Взаимная индуктивность Механічна взаємодія тіл. Сила
Механічна взаємодія тіл. Сила Проектная деятельность на уроках физики
Проектная деятельность на уроках физики ФИЗИКА ГРОЗЫ
ФИЗИКА ГРОЗЫ Открытие и исследование векторных бозонов в эксперименте ATLAS
Открытие и исследование векторных бозонов в эксперименте ATLAS Модели атомов. Опыт Резерфорда.
Модели атомов. Опыт Резерфорда. 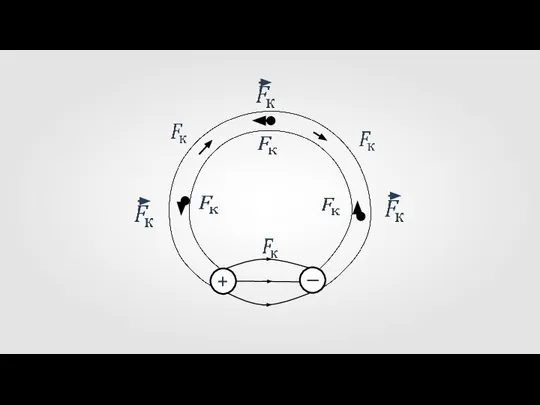 Cторонние силы
Cторонние силы Источник бесперебойного питания
Источник бесперебойного питания Величины, характеризующие колебательное движение.
Величины, характеризующие колебательное движение. Воздухоплавание
Воздухоплавание Нанотехнологии. Понятие и основные принципы нанотехнологии
Нанотехнологии. Понятие и основные принципы нанотехнологии Презентация по физике "Применение кристаллов" - скачать
Презентация по физике "Применение кристаллов" - скачать  Measurements at high voltage
Measurements at high voltage Квалиметриялық шкалалар
Квалиметриялық шкалалар Презентация по физике "Полное внутреннее отражение" - скачать
Презентация по физике "Полное внутреннее отражение" - скачать  История создания термометра
История создания термометра Тепловые двигатели
Тепловые двигатели Магнитное поле. Тема 7
Магнитное поле. Тема 7 Электромагнитное поле. Электромагнитные волны
Электромагнитное поле. Электромагнитные волны Физические свойства поверхностных слоев
Физические свойства поверхностных слоев Сравнение сил. 7класс
Сравнение сил. 7класс Аттестационная работа. Физика. Домашняя лаборатория. 7 класс
Аттестационная работа. Физика. Домашняя лаборатория. 7 класс Выполнили студенты гр. РБ-10: Егасова Т.Ю. Попова М.В. Приняла: Гостюхина В.В.
Выполнили студенты гр. РБ-10: Егасова Т.Ю. Попова М.В. Приняла: Гостюхина В.В. Плавание судов. Воздухоплавание
Плавание судов. Воздухоплавание Что изучает физика
Что изучает физика Рівномірний рух по колу
Рівномірний рух по колу