Содержание
- 2. Лекция 8 Условия фазового и мембранного равновесия. Правило фаз. Диаграммы состояния однокомпонентных систем.
- 3. Химическая реакция. Отметьте правильные утверждения Энергия Гиббса самопроизвольной химической реакции должна убывать. 2) При самопроизвольной реакции
- 6. Стандартная энергия Гиббса химической реакции ∆G0. : Найдите правильные утверждения: Равна изменению энергии Гиббса при переходе
- 7. Константа равновесия К газовой химической реакции : Найдите правильные утверждения: С температурой растет, 2) Безразмерна, 3)
- 8. Фазовое равновесие. Найдите правильные утверждения: 1) Температуры всех фаз должны быть одинаковы; 2) В равновесии могут
- 9. Фазовое равновесие
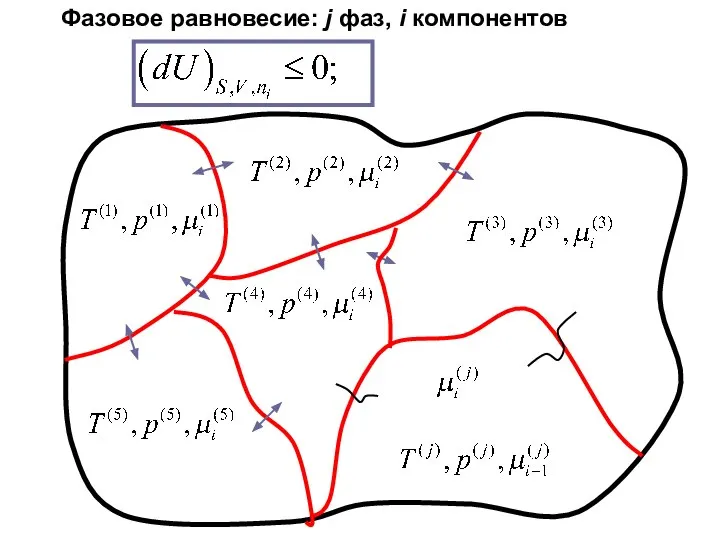
- 10. Фазовое равновесие: j фаз, i компонентов
- 11. Фазовое равновесие. Две фазы, два компонента
- 12. Химические потенциалы чистого (газ., жд., тв.) компонента
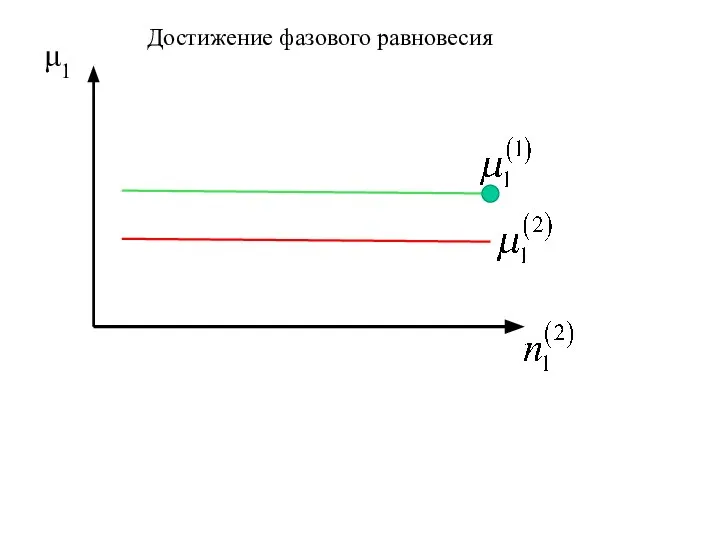
- 13. μ1 Достижение фазового равновесия
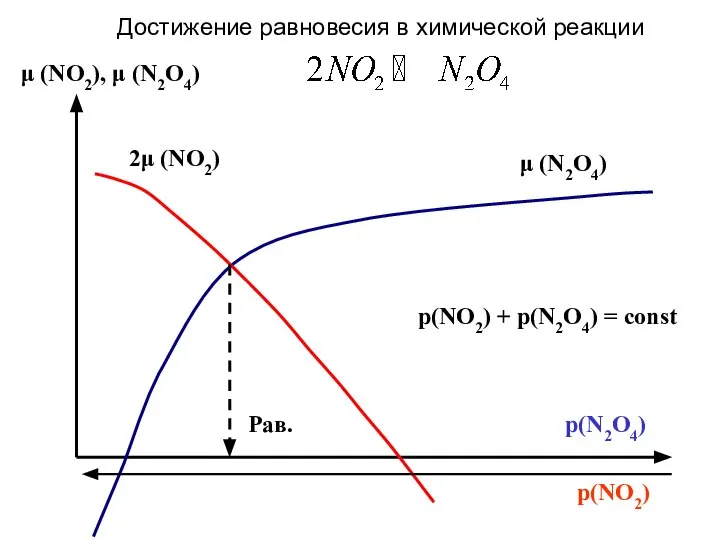
- 14. p(NO2) μ (NO2), μ (N2O4) Рав. μ (N2O4) 2μ (NO2) p(NO2) + p(N2O4) = const Достижение
- 15. Фазовое равновесие. Две фазы, один компонент.
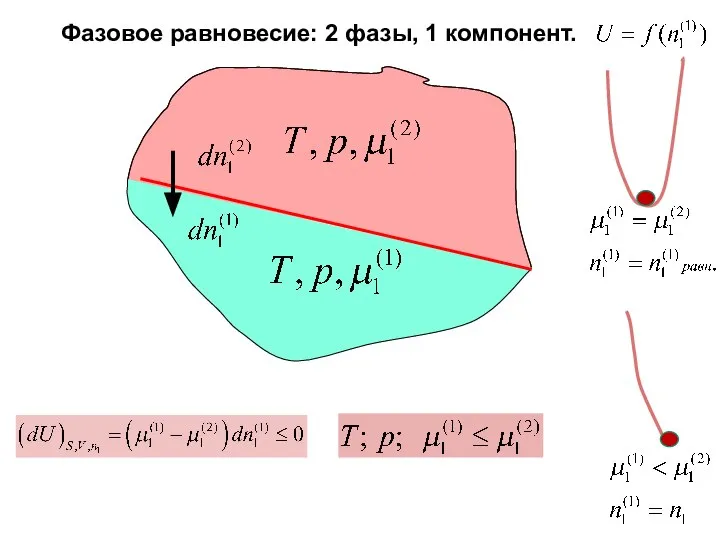
- 16. Фазовое равновесие: 2 фазы, 1 компонент.
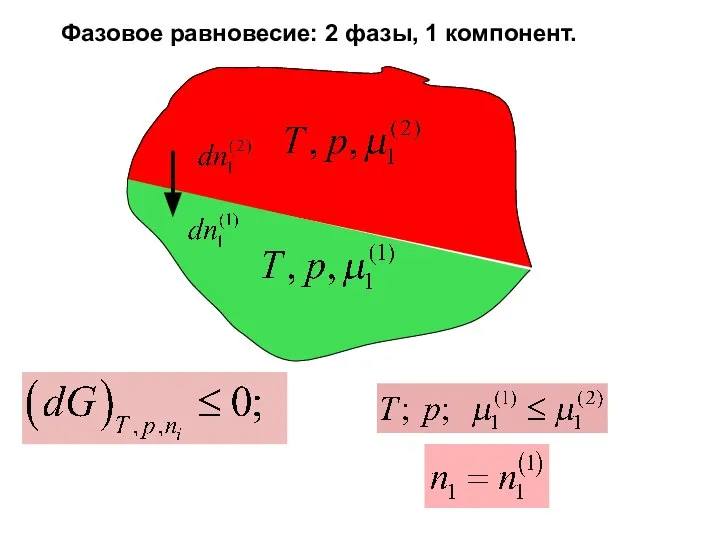
- 17. Фазовое равновесие: 2 фазы, 1 компонент.
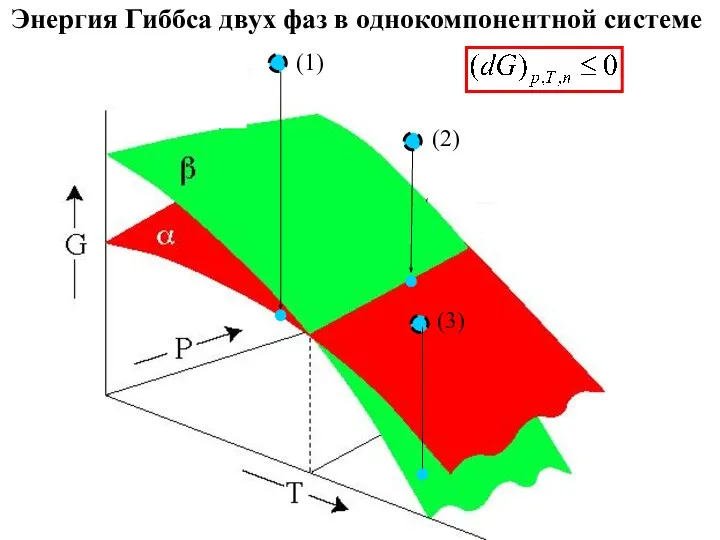
- 18. Энергия Гиббса двух фаз в однокомпонентной системе (1) (2) (3)
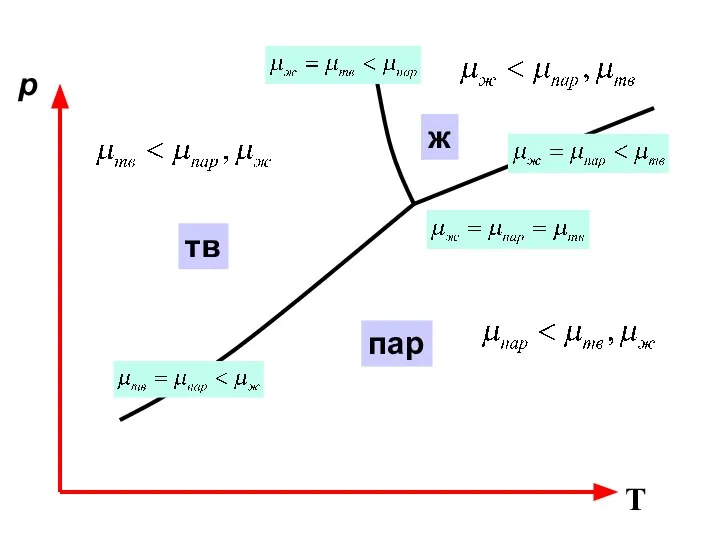
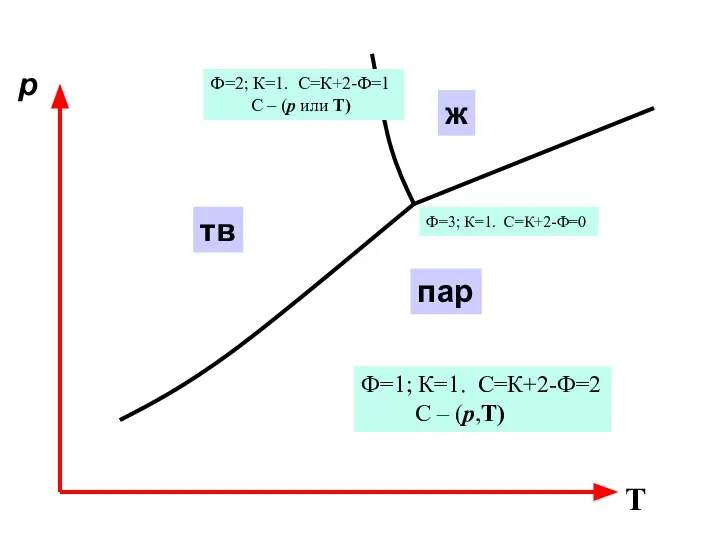
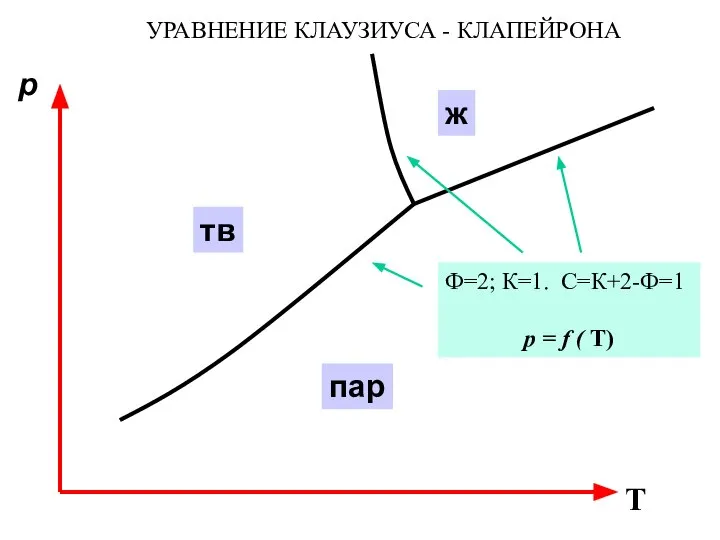
- 19. p T тв ж пар
- 20. p T тв ж пар Ф=1; К=1. С=К+2-Ф=2 С – (р,Т) Ф=2; К=1. С=К+2-Ф=1 С –
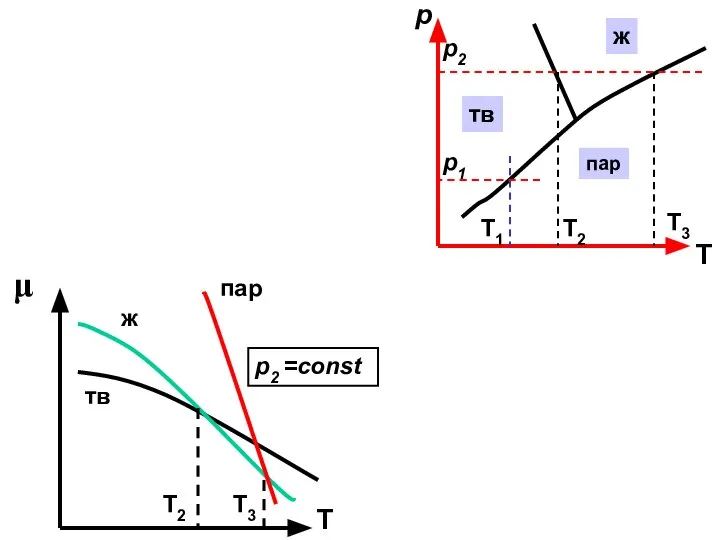
- 21. μ Т пар тв Т1 p1=const р Т Т1 Т2 Т3 p1 p2 пар ж тв
- 22. μ Т тв пар ж Т3 Т2 p2 =const р Т Т1 Т2 Т3 p1 p2
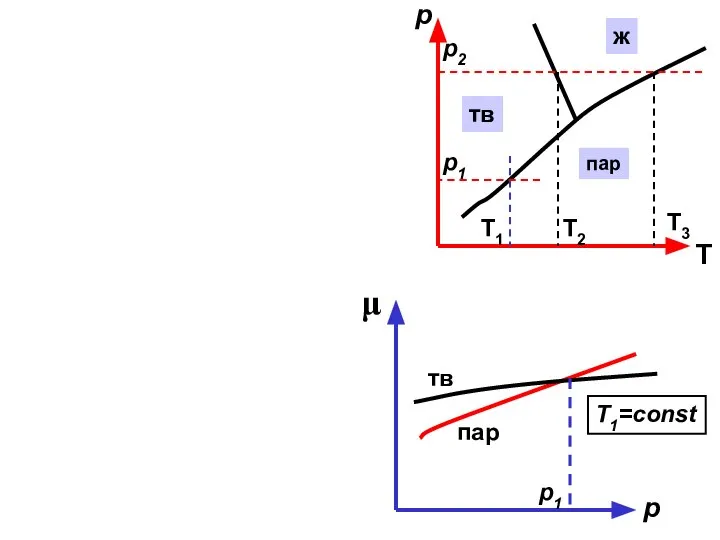
- 23. μ р тв пар T1=const p1 р Т Т1 Т2 Т3 p1 p2 пар ж тв
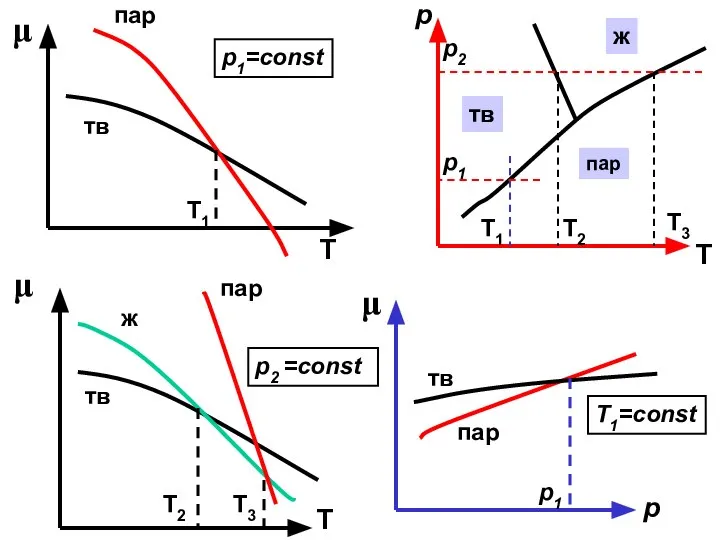
- 24. μ Т μ Т пар тв тв пар ж Т1 Т3 Т2 μ р тв пар
- 25. p T тв ж пар Ф=2; К=1. С=К+2-Ф=1 р = f ( Т) УРАВНЕНИЕ КЛАУЗИУСА -
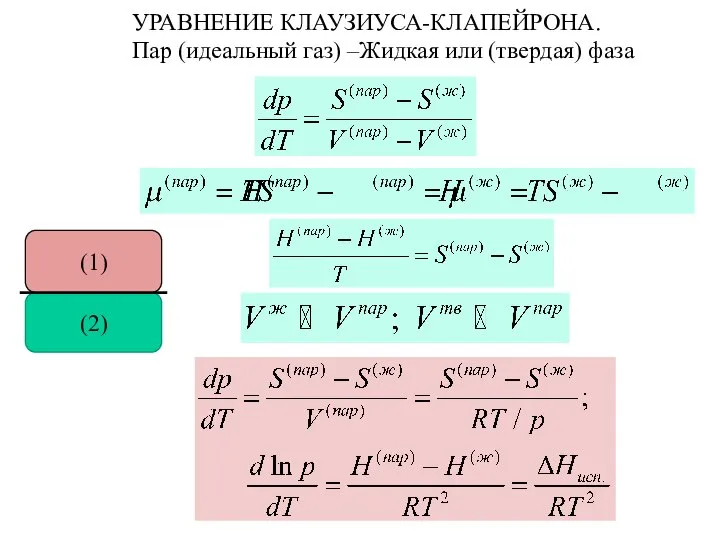
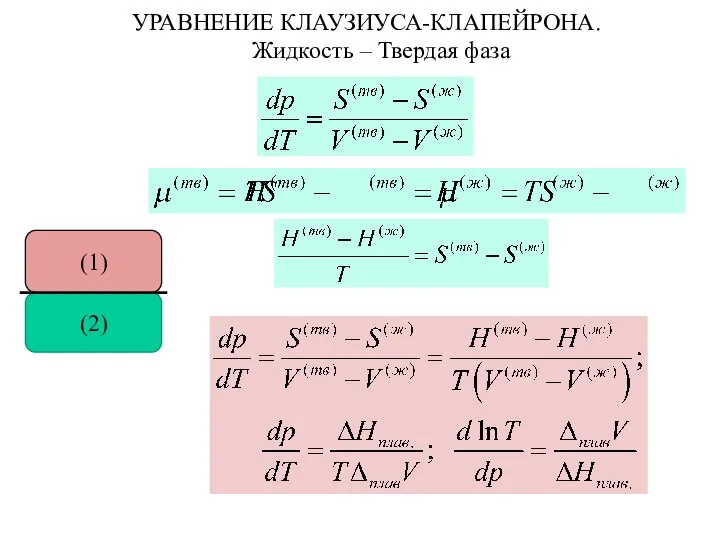
- 26. УРАВНЕНИЕ КЛАУЗИУСА-КЛАПЕЙРОНА (2) (1)
- 27. УРАВНЕНИЕ КЛАУЗИУСА-КЛАПЕЙРОНА. Пар (идеальный газ) –Жидкая или (твердая) фаза (2) (1)
- 28. УРАВНЕНИЕ КЛАУЗИУСА-КЛАПЕЙРОНА. Жидкость – Твердая фаза (2) (1)
- 29. ФАЗОВЫЕ ДИАГРАММЫ ОДНОКОМПОНЕНТНЫХ СИСТЕМ
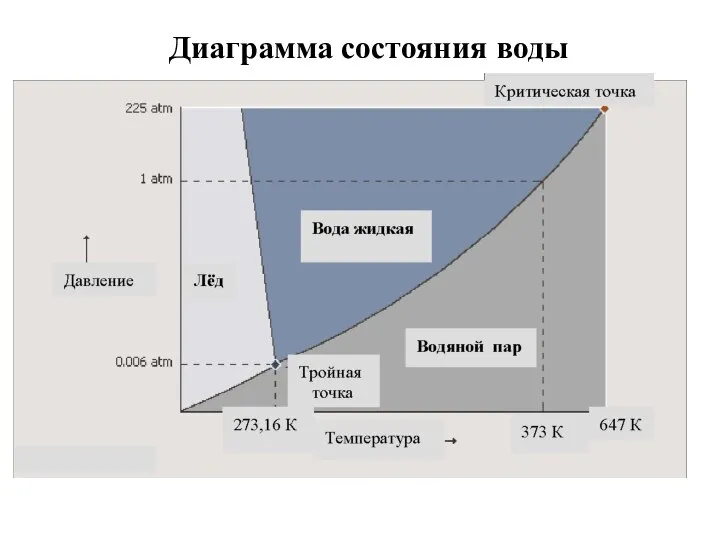
- 30. Диаграмма состояния воды
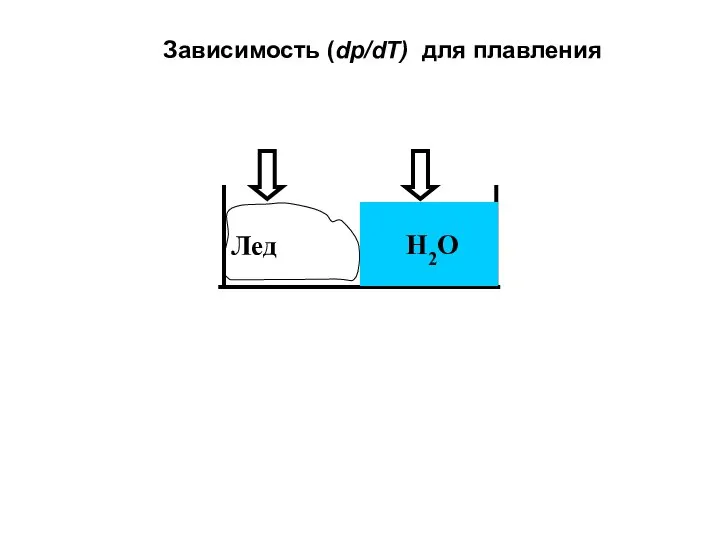
- 31. Лед Н2О Зависимость (dр/dT) для плавления
- 32. Полная диаграмма состояния воды
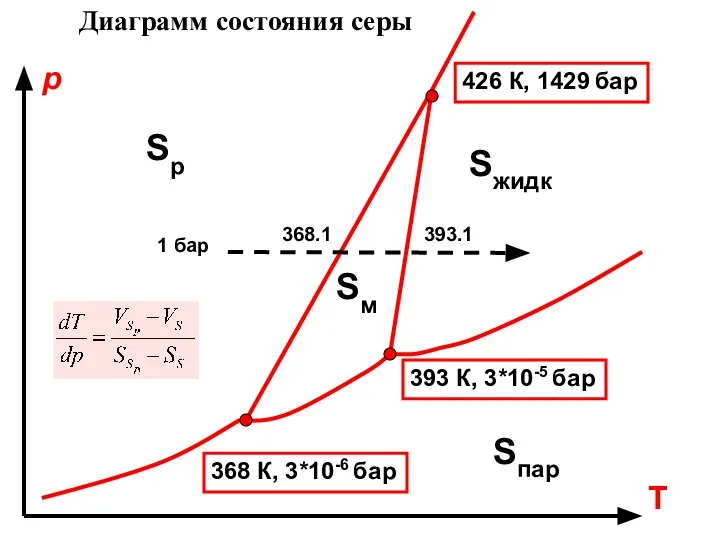
- 33. Диаграмм состояния серы Sр Sм Sпар Sжидк 393 К, 3*10-5 бар 368 К, 3*10-6 бар 426
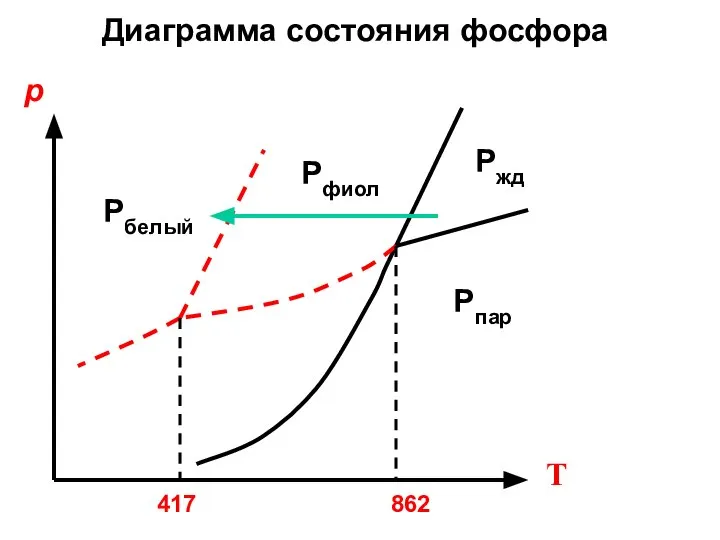
- 34. Рфиол Ржд Рпар Рбелый Диаграмма состояния фосфора р Т 862 417
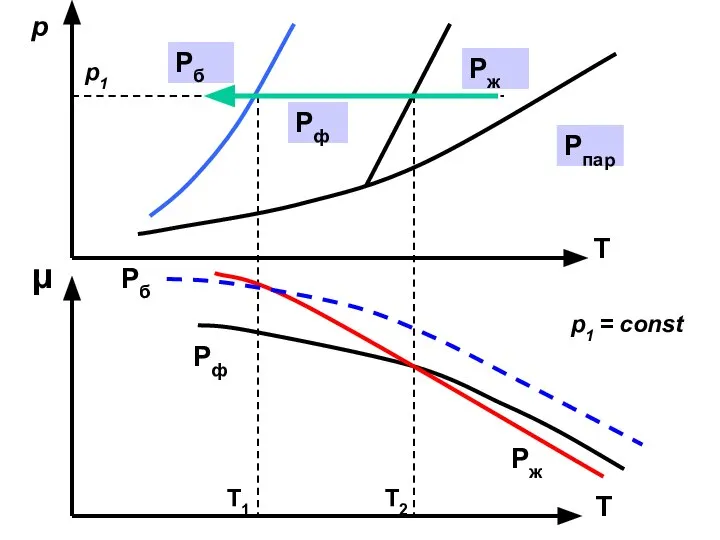
- 35. p T T μ p1 p1 = const Pпар Pж Pф Pб Pф Pб Pж T1
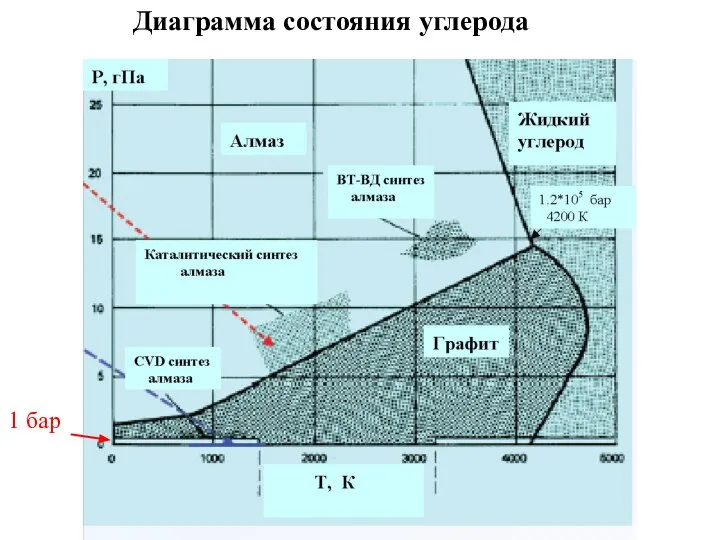
- 36. Диаграмма состояния углерода 1 бар
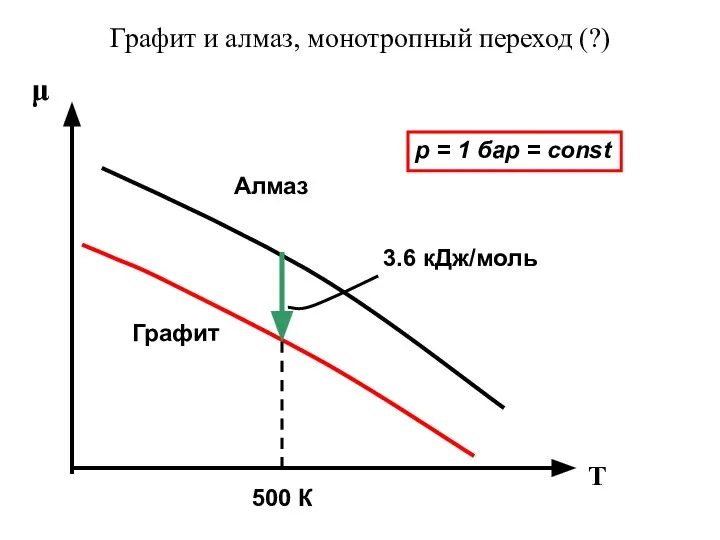
- 37. Графит и алмаз, монотропный переход (?) μ T Графит Алмаз 500 К 3.6 кДж/моль p =
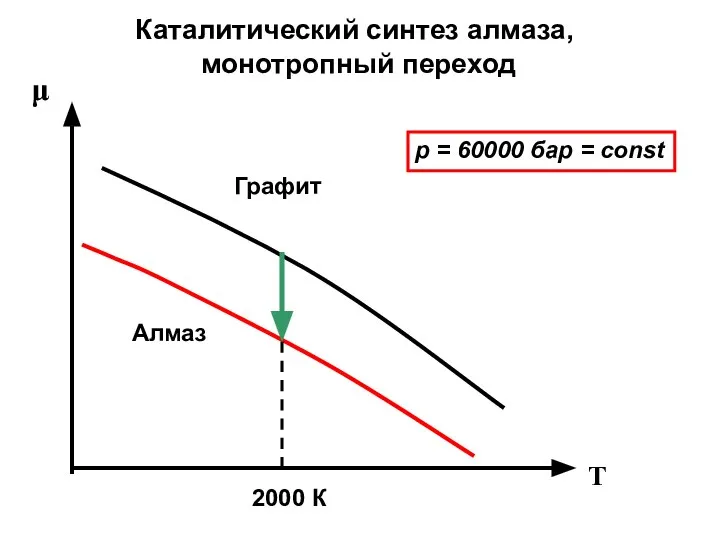
- 38. Каталитический синтез алмаза, монотропный переход μ T Алмаз Графит 2000 К p = 60000 бар =
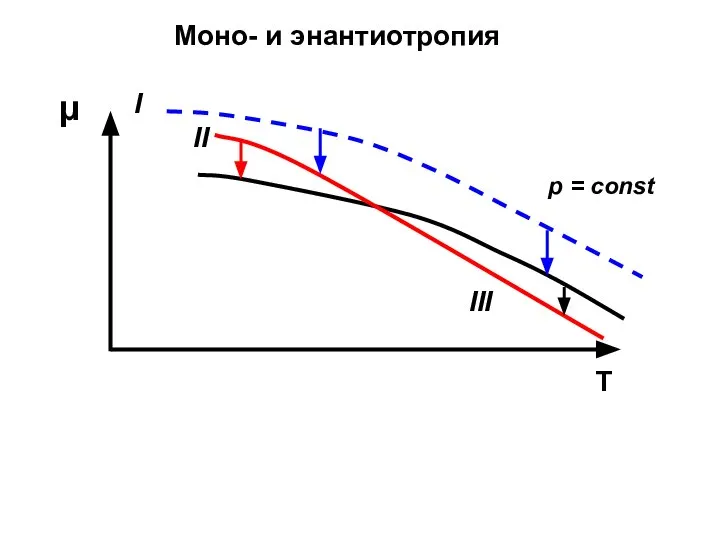
- 39. T μ II I III p = const Моно- и энантиотропия
- 40. НАНОУГЛОРОДНЫЕ МАТЕРИАЛЫ
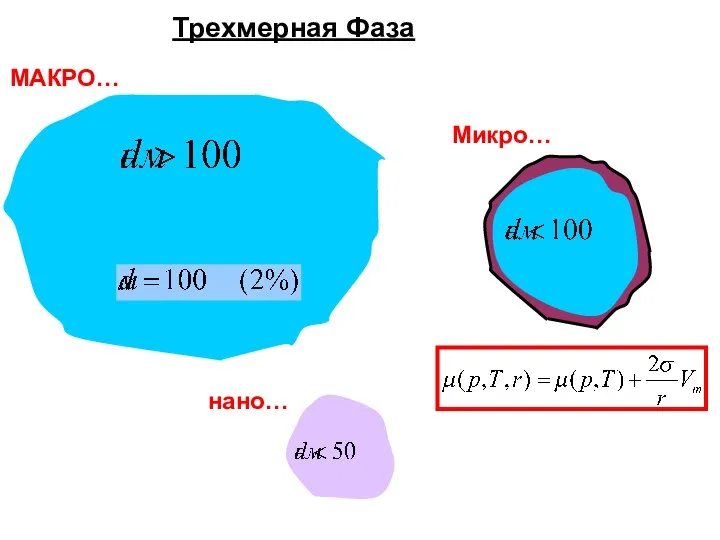
- 41. Трехмерная Фаза МАКРО… Микро… нано…
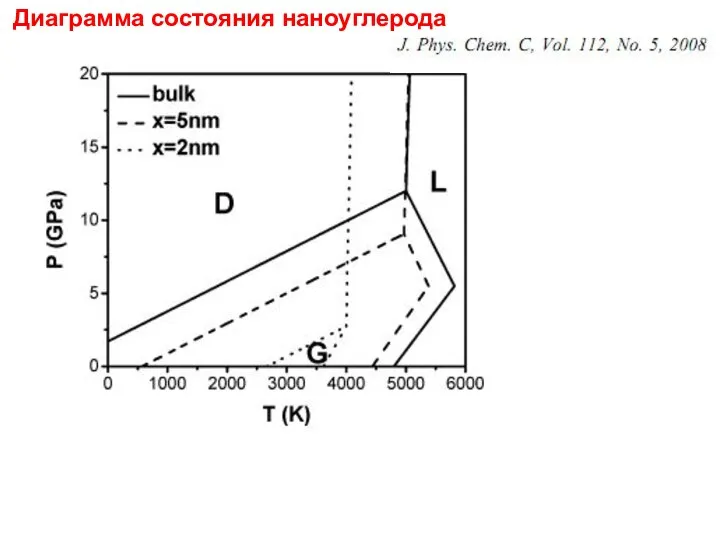
- 42. Диаграмма состояния наноуглерода
- 44. Скачать презентацию


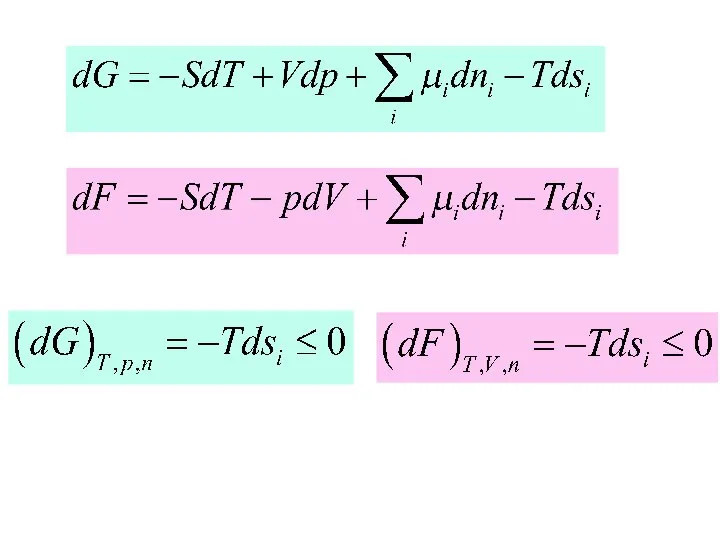













 ГЕОРГ СИМОН ОМ
ГЕОРГ СИМОН ОМ Презентация по физике "Первоначальные сведения о строении вещества" -
Презентация по физике "Первоначальные сведения о строении вещества" -  Техническая система и её элементы (6 класс)
Техническая система и её элементы (6 класс) Презентация по Физике на тему Электрический ток в различных средах
Презентация по Физике на тему Электрический ток в различных средах  Радиационный фон школьных помещений (ГБОУ школа №430
Радиационный фон школьных помещений (ГБОУ школа №430  Телескоп
Телескоп Машиностроение
Машиностроение Свободное падение
Свободное падение Схеми набираючої групи. (Заняття 29)
Схеми набираючої групи. (Заняття 29) Динамика материальной точки. Масса и импульс. Законы Ньютона
Динамика материальной точки. Масса и импульс. Законы Ньютона Термодинамика
Термодинамика Линзы. Оптическая сила линзы
Линзы. Оптическая сила линзы Вепольный анализ
Вепольный анализ Разделы физики
Разделы физики Ответы и решения.Решение задачи А1
Ответы и решения.Решение задачи А1 Кристаллические тела (10 класс)
Кристаллические тела (10 класс) Метод поиска решений творческих задач. Метод фокальных объектов
Метод поиска решений творческих задач. Метод фокальных объектов Элементы релятивистской механики. Специальная теория относительности. (Лекция 4.2)
Элементы релятивистской механики. Специальная теория относительности. (Лекция 4.2) Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2010 года по физике
Демонстрационный вариант контрольных измерительных материалов единого государственного экзамена 2010 года по физике ЭЛЕКТРОМАГНИТНАЯ ПРИРОДА СВЕТА
ЭЛЕКТРОМАГНИТНАЯ ПРИРОДА СВЕТА  Активационные методы. (Лекция 6)
Активационные методы. (Лекция 6) Закони динаміки. Сили та види взаємодій
Закони динаміки. Сили та види взаємодій Ионосфера. Прохождение. Диапазоны Лекция радиоклуба МИЭТ
Ионосфера. Прохождение. Диапазоны Лекция радиоклуба МИЭТ Оптические приборы. Глаз
Оптические приборы. Глаз Попов Александр Степанович 1859-1905
Попов Александр Степанович 1859-1905 Монтаж, ремонт и обслуживание комплектных распределительных устройств
Монтаж, ремонт и обслуживание комплектных распределительных устройств СОВРЕМЕННЫЕ ТЕРМОМЕТРЫ. ТЕМПЕРАТУРНЫЕ ШКАЛЫ. ВЕТРОВА ЕЛЕНА, учащаяся МУСОШ № 37 г. Иваново, НАУМОВА ЛАРИСА ГЕННАДЬЕВНА , учитель фи
СОВРЕМЕННЫЕ ТЕРМОМЕТРЫ. ТЕМПЕРАТУРНЫЕ ШКАЛЫ. ВЕТРОВА ЕЛЕНА, учащаяся МУСОШ № 37 г. Иваново, НАУМОВА ЛАРИСА ГЕННАДЬЕВНА , учитель фи Взаимодействие тел. Масса
Взаимодействие тел. Масса