Содержание
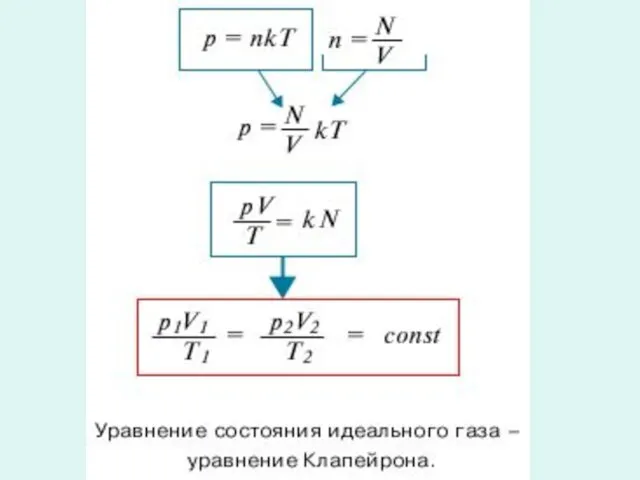
- 2. Температуру, объем, давление и некоторые другие параметры принято называть параметрами состояния газа . Выведем уравнение, устанавливающее
- 4. Клапейрон Бенуа Поль Эмиль (26.I.1799–28.I.1864) Французский физик, член Парижской АН (1858). Окончил Политехническую школу в Париже
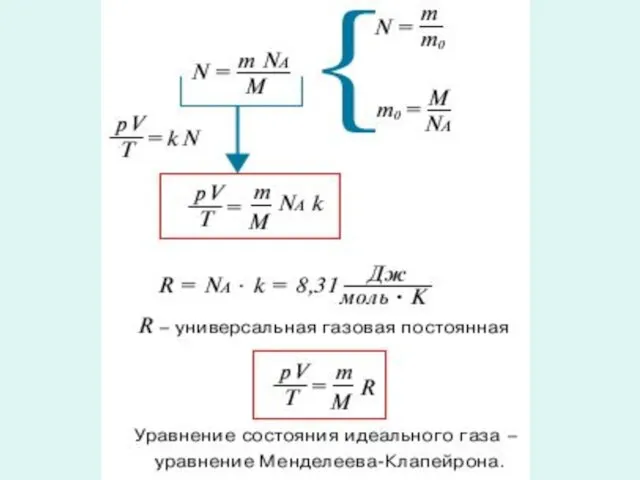
- 6. Менделеев Дмитрий Иванович (8.II.1834–2.II.1907) Русский ученый-энциклопедист.. В 1874 вывел общее уравнение состояния идеального газа, обобщив уравнение
- 7. Уравнение состояния - первое из замечательных обобщений в физике, с помощью которых свойства разных веществ выражаются
- 8. Процесс изменения состояния идеального газа при неизменном значении одного из макроскопических параметров - изопроцесс
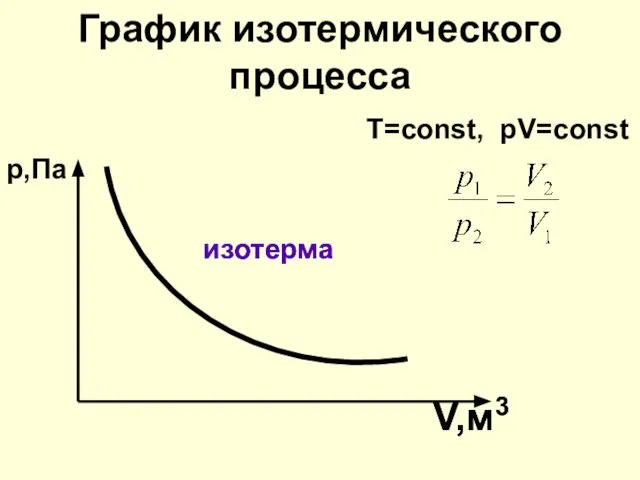
- 9. ИЗОТЕРМИЧЕСКИЙ ПРОЦЕСС T=const Процесс изменения состояния идеального газа при постоянной температуре m=const рV=const T=const закон Бойля
- 10. К этому выводу пришёл английский учёный Роберт Бойль в 1662 г. и французский физик Э.Мариотт в
- 11. Закон Бойля -Мариотта Для газа данной массы произведение давления газа на его объём постоянно, если температура
- 12. График изотермического процесса изотерма V,м3 Т=const, рV=const р,Па изотерма V,м3
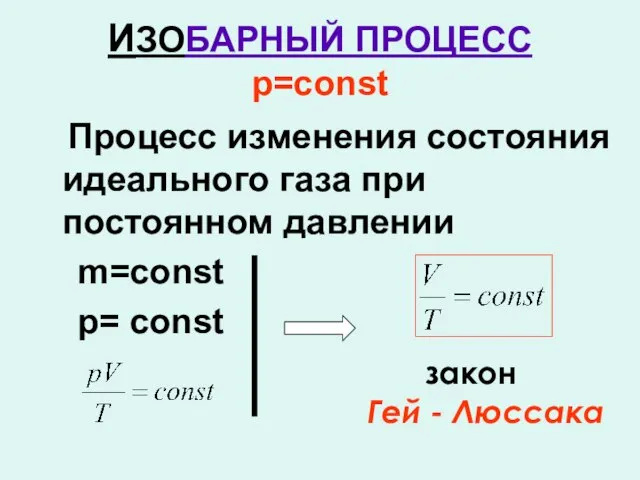
- 13. ИЗОБАРНЫЙ ПРОЦЕСС р=const Процесс изменения состояния идеального газа при постоянном давлении m=const р= const закон Гей
- 14. Этот закон экспериментально был открыт в 1802г. Французским учёным Гей-Люссаком
- 15. Закон Гей-Люссака Для газа данной массы отношение объёма к температуре постоянно, если давление не меняется.
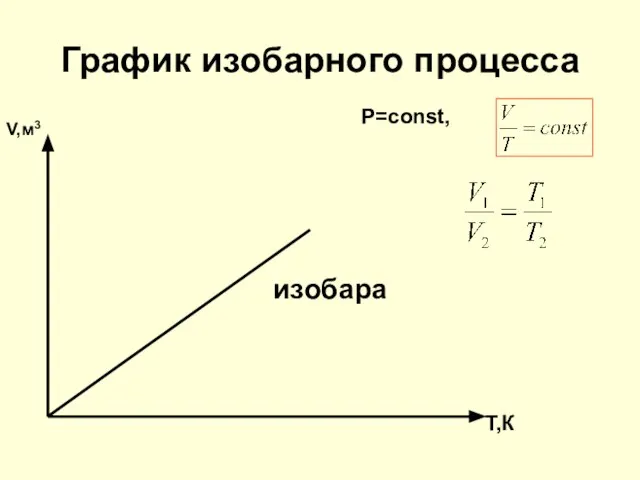
- 16. График изобарного процесса V,м3 P=const, изобара T,К
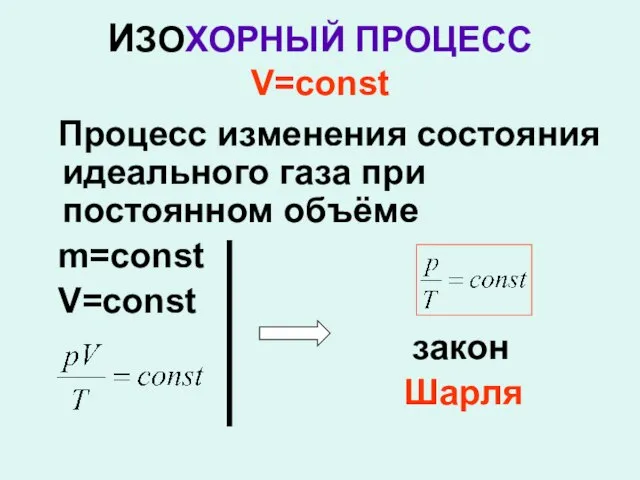
- 17. ИЗОХОРНЫЙ ПРОЦЕСС V=const Процесс изменения состояния идеального газа при постоянном объёме m=const V=const закон Шарля
- 18. Эту зависимость экспериментально установил в 1787г. французский физик Шарль
- 19. Закон Шарля Для данной массы газа отношение давления к температуре постоянно, если объём не меняется
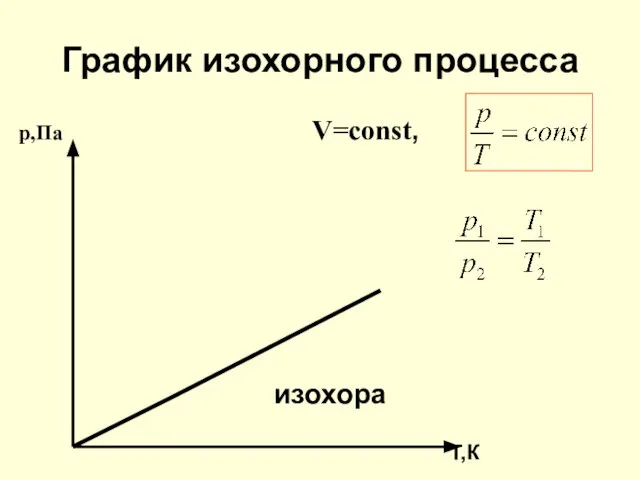
- 20. График изохорного процесса р,Па V=const, изохора Т,К
- 21. Эти законы справедливы для любых газов, а так же для смесей газов(например воздуха)
- 22. Задачи: 1. Почему баллон с любым сжатым газом представляет большую опасность при пожаре? 2. В двух
- 23. Задачи: 4. Какой объём будет занимать газ при температуре 77◦С, если при 27◦С его объём равен
- 24. V1-? «СИ» t1=77◦С Т1=77+273=350К t2=27◦С Т2 = 300К V2=0,006м3 Ответ: 0,007 м3.
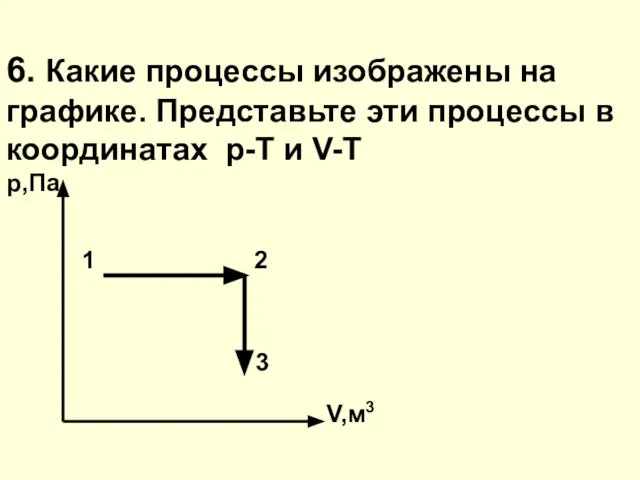
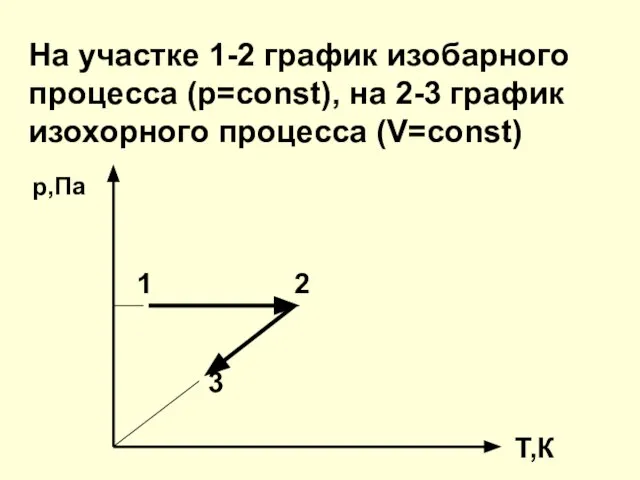
- 25. 6. Какие процессы изображены на графике. Представьте эти процессы в координатах р-Т и V-T р,Па 1
- 26. На участке 1-2 график изобарного процесса (р=const), на 2-3 график изохорного процесса (V=const) р,Па 1 2
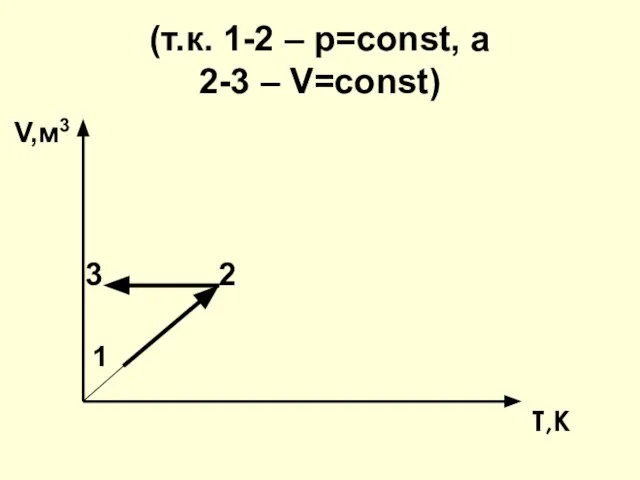
- 27. (т.к. 1-2 – р=const, а 2-3 – V=const) V,м3 3 2 1 T,К
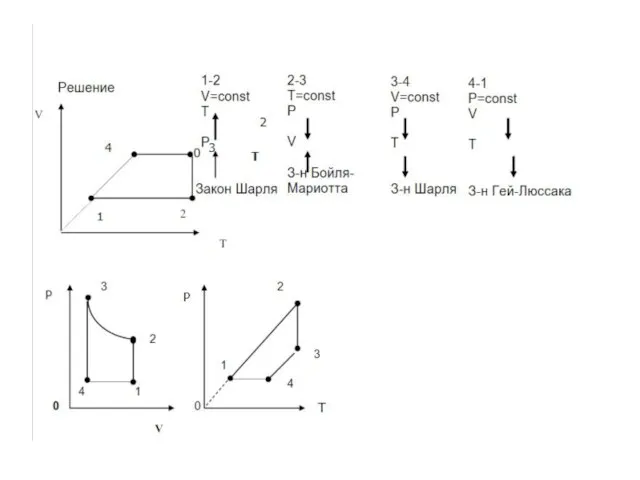
- 28. Идеальный газ изохорно нагревают так,что его температура изменяется на а давление — в 1,6 раза. Масса
- 34. Скачать презентацию




















 Феромагнетики. Феромагнітне тіло
Феромагнетики. Феромагнітне тіло Параллельная работа разных трубопроводов
Параллельная работа разных трубопроводов Рабочие процессы бензинового двигателя
Рабочие процессы бензинового двигателя Средневековая философия Схоластика
Средневековая философия Схоластика Двигатель внутреннего сгорания
Двигатель внутреннего сгорания Диэлектрики в электростатическом поле. Тема 4
Диэлектрики в электростатическом поле. Тема 4 Автор: Ермолаева Наталья 10Б Авт
Автор: Ермолаева Наталья 10Б Авт Постоянный электрический ток. Электрический ток, сила и плотность тока
Постоянный электрический ток. Электрический ток, сила и плотность тока Презентация по физике "Физический калейдоскоп" - скачать
Презентация по физике "Физический калейдоскоп" - скачать  Физика. Структура курса
Физика. Структура курса Современные методы разделения и концентрирования в химическом анализе. (Лекция 1)
Современные методы разделения и концентрирования в химическом анализе. (Лекция 1) Экспериментальные методы исследования частиц
Экспериментальные методы исследования частиц Електричне поле
Електричне поле Плотность
Плотность Специальная теория относительности (СТО)
Специальная теория относительности (СТО) Презентация по физике "Давление газа" - скачать
Презентация по физике "Давление газа" - скачать  Оценка угла места в системах локации метрового диапазона
Оценка угла места в системах локации метрового диапазона Учебный курс
Учебный курс  Атом водорода в квантовой физике. (Лекция 8)
Атом водорода в квантовой физике. (Лекция 8) Работа силы тяжести
Работа силы тяжести Уравнение неразрывности среды. Модель сплошной среды
Уравнение неразрывности среды. Модель сплошной среды ФИЗИКА в медицине Физика и медицина - наука о явлениях природы и наука о болезнях человека, их лечении и предупреждении - очень тес
ФИЗИКА в медицине Физика и медицина - наука о явлениях природы и наука о болезнях человека, их лечении и предупреждении - очень тес Роторный двигатель
Роторный двигатель Презентация Сила тяжести
Презентация Сила тяжести  Зубчатые передачи
Зубчатые передачи Распространение света в однородной среде
Распространение света в однородной среде Статика
Статика Презентация по физике "Напряжённость электрического поля" - скачать
Презентация по физике "Напряжённость электрического поля" - скачать